Периодический закон. Периодическая система элементов Д.И. Менделеева
Периодический закон открыт великим русским ученым Д.И. Менделеевым в 1869г. и первоначально был сформулирован следующим образом:
«Свойства простых тел, а также форма и свойства образуемых ими сложных тел находятся в периодической зависимости от величины их атомного веса.»
На основании Периодического закона Д.И.Менделеев построил периодическую систему элементов, т.е. систему классификации химических элементов по совокупности их свойств. Во времена Д.И.Менделеева причина периодичности свойств элементов не была известна, но благодаря открытиям в области физики стало больше известно о строении атома и стали ясны причины периодичности.
Периодичность – это повторяемость сходства химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элемента. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Поскольку свойства элементов, особенно химические, определяются в основном строением внешнего электронного уровня, причиной периодичности свойств является периодичность заполнения электронной оболочки атома.
На основе современных представлений о строении ядра и распределении электронов в атомах периодический закон формулируется так:
Свойства химических элементов, а также форма и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Периодический закон не имеет математического выражения. Он представлен в виде периодической таблицы, которая является графическим изображением Периодического закона*. Существует несколько вариантов периодической таблицы, но в любом случае распределение элементов по периодам и группам отвечает распределению электронов атомов этих элементов по уровням и подуровням электронной оболочки.
Структура периодической системы элементов
В соответствии с периодическим изменением свойств элементов система Д.И. Менделеева состоит из семи периодов.
Периодом называется горизонтальный ряд элементов, расположенных в порядке возрастания заряда ядра атомов. Каждый из периодов (кроме первого) начинается типичным металлом – Li, Na, K, Rb, Cs, Fr (первый период начинается с водорода – Н), атомы, у которых на внешних уровнях имеют один электрон. Заканчивается каждый период элементом, атомы которых на внешнем уровне имеют 2 (в первом периоде) или 8 электронов (во всех последующих) – атомами благородных газов (Ne, Ar, Kr, Xe, Rn). Порядок формирования периодов связан с постепенным заполнением электронами энергетических уровней.
Номер периода совпадает со значением главного квантового числа внешнего энергетического уровня. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен.
Вследствие различия периодов по длине известен ряд вариантов периодической системы. Чаще используют короткий вариант. Пользуются также длиннопериодным вариантом, в котором одинаково расположены начала и концы всех периодов.
По вертикали периодическая система подразделяется на 8 групп.
Группа – вертикальный ряд элементов, в котором собраны элементы с наиболее близкими химическими свойствами, что определяется сходством строения внешних электронных оболочек. В короткопериодном варианте каждая группа делится на две подгруппы: А – группу (главную), начинающуюся с элементов 1 или 2 периода и В – группу (побочную), состоящую только из элементов 4, 5, 6 и 7 периодов. Восьмая группа – особая, она содержит «триады» элементов, составляющие семейства железа (Fe, Co, Ni) и платиновых элементов (Ru, Rh, Pd, Os, Ir, Ph). Принадлежность к группе или подгруппе определяется аналогией структур внешнего (А- группы) или внешнего и предвнешнего (В- группы) квантовых уровней.
В зависимости от того, какой подуровень в атоме заселяет последний электрон, элементы подразделяются на электронные s -, p -, d - или f - семейства.
S – и p - элементы составляют А (главные) – группы периодической системы. Валентными, т.е. участвующими в образовании химических связей, электронами атомов этих элементов являются s - и p -электроны внешнего уровня. Число их равно номеру группы.
D – и f – элементы составляют В (побочные) – группы. У этих элементов меняется число электронов на предвнешних (d - и f -уровнях ), а на внешнем s - уровне остается постоянным 1 – 2 электрона. Для них характерна электронная конфигурация
(n – 1)d1-10ns2(1).
Таким образом различие электронного строения атомов является причиной различия свойств элементов А – и В – групп.
Особенности электронной структуры атомов различных элементов находят отражение в периодическом изменении энергетических характеристик атомов: энергия ионизации (I ), сродство к электрону (Ее), электроотрицательность (ЭО), а также радиусов атомов и ионов.
Размеры атомов и ионов
Понятие о размере атома не является строго однозначным. За радиус атома можно принять половину расстояния между ядрами соседних атомов в кристалле простого вещества, если представить себе атомы как соприкасающиеся шары.
Зависимость атомных радиусов (r ат) от заряда ядра имеет ярко выраженный характер. В периоде с увеличением заряда ядра радиус атома уменьшается, т.к. ростом заряда ядра притяжение между ним и каждым электроном внешнего уровня усиливается, что приводит к уменьшению радиуса атома. Особенно это заметно в коротких периодах.
Электроны каждого следующего энергетического уровня более удалены от ядра, чем предыдущего, поэтому с началом заполнения электронами нового уровня, т.е. при переходе к следующему периоду атомные радиусы возрастают. Таким образом, сверху вниз по подгруппе с увеличение заряда ядра атома размеры атомов увеличиваются.
При отдаче атомом электронов и образовании катионов радиусы ионов убывают, а при присоединении электронов и образовании анионов – увеличиваются. Поэтому r кат < r ат, a r ан > r ат.
Энергия ионизации
Энергия, которую необходимо затратить для отрыва наименее прочно связанного электрона от атома и удаления его на бесконечное расстояние, называетсяэнергией ионизации( I ): А0 + I = A+ + e-
Энергию ионизации измеряют в электрон-вольтах (эВ/ат) или в (кДж/моль). Значения энергий ионизации некоторых элементов приведены в таблице 1.
Таблица 1.
Значения энергий ионизации некоторых элементов
| Процесс | Энергия ионизации,эВ/ат | Процесс | Энергия ионизации,эВ/ат |
| Li – e → Li+ | 5,39 | Mg – e → Mg+ | 7,72 |
| Na – e → Na+ | 5,14 | Ca – e → Ca+ | 6,11 |
| K – e → K+ | 4,34 | Sr – e → Sr+ | 5,69 |
| Rb – e → Rb+ | 4,17 | Ba – e → Ba+ | 5,21 |
| Cs – e → Cs+ | 3,89 | Al –e → Al+ | 5,98 |
| Sn –e → Sn+ | 7,34 |
*Электроны внешнего уровня отрываются сравнительно легко; отрыв электронов предвнешнего уровня требует значительно большей энергии. При отрыве электрона от атома происходит повышение степени окисления, т.е. происходит окисление. Атомы, которые окисляются являются восстановителями. Способность атома отдавать электроны характеризует его восстановительную способность. Чем энергия ионизации меньше, тем выше восстановительная способность элемента. Как видно из таблицы 1, в подгруппе сверху вниз значение энергии ионизации уменьшается, следовательно восстановительные свойства элементов возрастают, а по периоду, с ростом I – убывают.
Энергию ионизации так же иногда называют ионизационным потенциалом. Многоэлектронные атомы имеют несколько энергий ионизации. Различают ионизационные потенциалы 1, 2 … порядков: I 1, I 2 …., соответствующие отрыву
1, 2… и последующих электронов. C увеличением порядка энергия ионизации возрастает, т.к. 1-й электрон отрывается от нейтрального атома, а последующие от положительно заряженного иона, заряд которого растет и сильнее притягивает электрон, поэтому энергии требуется больше. Т.е. : I 1 < I 2 < I 3….
Энергия электронного сродства
Энергия, которая выделяется при присоединении электрона к нейтральному атому, называется энергией электронного сродства (F е ): А0 + е- = А- + Ее
*Также как и энергию ионизации энергию электронного сродства измеряют в электрон-вольтах (эВ/ат) или в (кДж/моль).
При присоединении электрона к атому происходит понижение степени окисления: происходит процесс восстановления. Атомы, которые окисляются являются восстановителями. Способность атома отдавать электроны характеризует его окислительную способность. Чем сродство к электрону больше, тем выше окислительные свойства элементов. Наибольшим сродством к электрону обладают элементы VIIA подгруппы с электронной конфигурацией ns 2 np 5. Близкие к нулю или отрицательные значения имеют металлы и благородные газы, т.е. по периоду окислительные свойства усиливаются, а по группе сверху вниз – убывают.
Электроотрицательность
Электроотрицательность (ЭО) – количественнаяхарактеристикаспособности атомов в молекуле притягивать к себе электроны при образовании химической связи. Электроотрицательность определяется как энергией ионизации, так и сродством к электрону и часто выражается как полусумма этих характеристик:
ЭО = 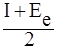
Для удобства на практике пользуются относительными значениями ЭО по шкале Л. Полинга. Относительные значения ЭО приведены в таблице 2.
Из таблицы видно, что в периодах слева направо, а в главных подгруппах снизу вверх ЭО возрастает. В результате химических реакций электроны смещаются (2H2 + F2 = 2H2F) или переходят к атомам (2Cs + F2 = 2CsF), с большим значением ЭО. Таким образом, по значению ЭО можно определить характер связи, которую атом данного элемента может образовать с атомами других элементов.
Таблица 2.
Относительные электроотрицательности атомов
| I | II | III | IV | V | VI | VII | VIII |
| H 2,1 | |||||||
| Li 0,97 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | |
| Na 0,93 | Mg 1,2 | Al 1,6 | Si 1,9 | P 2,1 | S 2,5 | Cl 3,0 | |
| K 0,91 | Ca 1,04 | Sc 1,3 | Ti 1,3 | Cr 1,6 | Mn 1,6 | Fe Co Ni 1,6 1,7 1,8 | |
| Zn 1,6 | Ga 1,8 | Ge 2,0 | As 2,0 | Se 2,4 | Br 2,8 | ||
| Rb 0,89 | Sr 0,99 | Y 1,3 | Zr 1,5 | Nb 1,7 | Ru Rh Pd 2,0 2,1 2,1 | ||
| Ag 1,9 | Cd 1,7 | In 1,5 | Sb 1,8 | Te 2,1 | I 2,6 | ||
| Cs 0,86 | Ba 0,9 | La 1,2 | Hf 1,7 | Os Ir Pt 2,1 2,1 2,1 | |||
| Hg 1,8 | Pb 1,6 | Bi 1,8 | Po 2,3 | At 2,2 | |||
| Fr 0,7 | Ra 0,9 |
Дата добавления: 2021-01-21; просмотров: 83; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
