Электронные конфигурации некоторых элементов
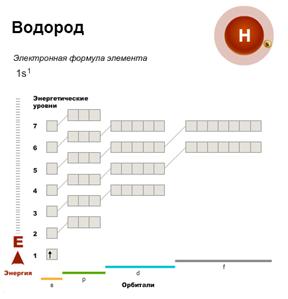
Первый энергетический уровень вмещает максимально два электрона. Поэтому первый период состоит лишь из двух элементов — водорода и гелия. Простейший из атомов — водород, H. Он содержит один электрон, который занимает орбиталь с самой низкой энергией — 1s-орбиталь. Электронная конфигурация атома водорода. В атоме гелия первый энергетический уровень полностью завершен.

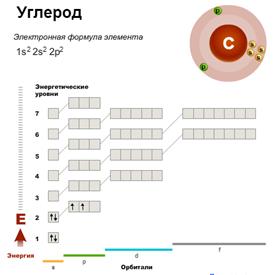
У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.
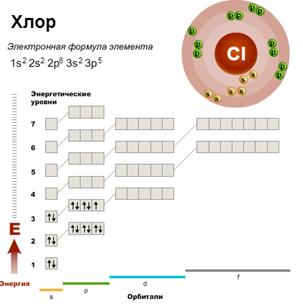
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.
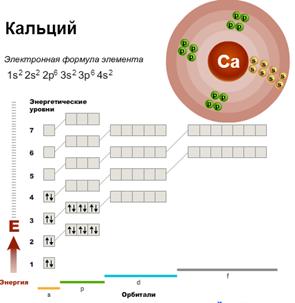
В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).
Определение
Элементы, в атомах которых происходит заполнение предвнешнего энергетического уровня, называют переходными.
|
|
|
Такие элементы расположены в побочных подгруппах периодической системы. Начиная с элемента галлия заполнение четвертого уровня продолжается.
Химические свойства элементов определяются не всеми электронами, а только внешними, обладающими наибольшей энергией.
Внешние электроны называют валентными, и их количество, как правило, равно номеру группы, в которой расположен элемент.
Их атом может отдавать в результате химических реакций, они обуславливают его химические свойства. У элементов главных подгрупп валентными являются электроны внешнего энергетического уровня. Число валентных электронов равно номеру группы, в которой находится элемент. Например, водород, натрий и калий, расположенные в первой группе, имеют по одному валентному электрону, а элементы четвертой группы — углерод и кремний — по четыре. Как вы помните, элементы, входящие в одну и ту же подгруппу, обладают сходными химическим свойствами. Это объясняется тем, что они имеют сходные электронные конфигурации, т. е. являются электронными аналогами. Полностью завершенные внутренние энергетические уровни не оказывают существенного влияния на химические свойства.
Элементы, в атомах которых валентные электроны расположены на s-подуровне, называют s-элементами, p-подуровне — p-элементами, d-подуровне — d-элементами, а f-подуровне — f-элементами.
|
|
|
s-элементы расположены в начале периодов, а р-элементы — в конце. В короткопериодном варианте периодической системы f-элементы (лантаноиды и актиноиды) вынесены за пределы таблицы. Малые периоды и главные подгруппы состоят лишь из s- и р-элементов. Все d- и f-элементы расположены в побочных подгруппах.
В длиннопериодном варианте s-, p-, d- и f-элементы занимают отдельные поля.
Именно конфигурация валентных электронов определяет то, является ли элемент металлом или неметаллом, с какими другими элементами он может взаимодействовать и какова его валентность. При заполнении орбиталей электронами конфигурация валентных электронов периодически повторяется, что приводит к периодическому изменению химических свойств элементов.
Пример
Записать электронную конфигурацию и энергетическую диаграмму атома серы, указав распределение электронов по уровням и подуровням.
РешениеСерарасположена в третьем периоде и VI (6) группе, порядковый номер — 16.
Значит, в атоме серы всего 16 электронов, которые расположены на трех энергетических уровнях (т. к. номер периода = 3), причем на последнем (валентном) уровне находится 6 электронов (т. к. номер группы = 6). В соответствии с принципом минимума энергии расположим электроны по подуровням.
|
|
|
Электронная конфигурация атома серы тогда выглядит следующими образом: 1S22S22P63S23P4.

1S22S22P63S23P4
«Проскок» или «провал» электрона
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди, исходя из вышенаписанного, должна иметь вид: Cu 1s22s22p63s23p64s23d9_. Однако в действительности один из двух 4s-электронов «проваливается» на 3d-подуровень, и атом меди имеет следующую конфигурацию: 1s22s22p63s23p64s13d10_.
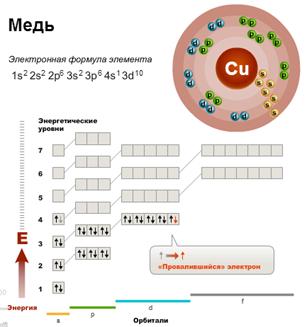
Для элементов IБ-подгруппы характерна конфигурация внешнего слоя: ns1(n−1)d10.
Для элементов Cr и Mo характерна конфигурация внешнего слоя: ns1(n−1)d5.
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s22s22p63s23p64s23d104p65s04d10_.
Возбужденное состояние атома
Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома.
|
|
|
Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень.
Определение
Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома.
Возбужденное состояние атома является неустойчивым, и через некоторое время электрон теряет энергию, перейдя на энергетическую орбиталь с меньшей энергией, испустив при этом квант света.
Определение
Состояние, которое требует для повышения энергии электрона наименьших энергетических затрат, называют первым возбужденным состоянием. Состояние, при котором все валентные электроны являются неспаренными, называют максимально возбужденным состоянием.
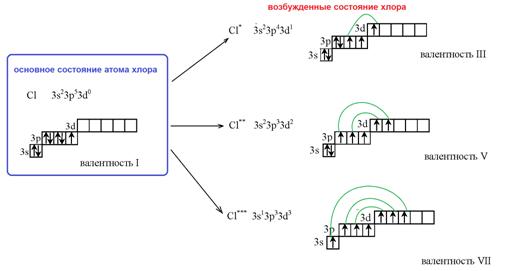
Например, для атома хлора возможны три возбужденных состояния, обозначенные на рисунке как Cl*, Cl**, Cl***, причем последнее является максимально возбужденным состоянием. У атомов в возбужденном состоянии меняется число валентных электронов и, соответственно, возможная степень окисления.
Гибридизация атома углерода
Сложность статьи улучшить школьные оценкиузнать больше, чем в школепобедить в олимпиаде
Определение
Гибридизация АО - смешение атомных орбиталей (электронных облаков) различного типа (например, s и p), в результате которого образуются одинаковые по форме и энергии гибридные орбитали.
Число образующихся гибридных орбиталей равно числу орбиталей, которые участвуют в гибридизации. Химические связи возникают при перекрывании гибридных АО с АО других атомов.
Основные типы гибридизации, характерные для атома углерода: sp3, sp2, sp.
sp3 - гибридизация
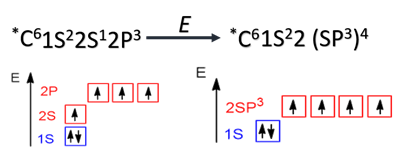
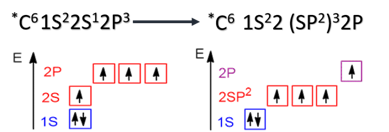
sp3-Гибридизация характерна для предельных органических соединений. В этом случае атомы углерода образуют четыре одинарные связи, т.е. валентность атомов углерода равна IV. Такую валентность атом углерода имеет в возбужденном состоянии: 2s12p3.
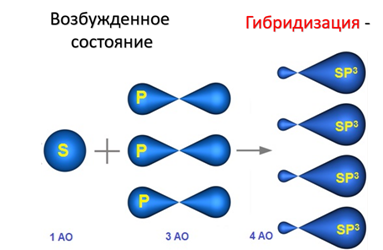
В результате гибридизации одной 2s-орбитали и трех 2p-орбиталей образуются четыре sp3-гибридные орбитали, одинаковые по форме и энергии:
Образование sp3-гибридизованных АО в атоме углерода, можно показать также с помощью графической картинки:
Четыре гибридные орбитали располагаются под углом 109^o5^'109^o5^' друг к другу и направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода:
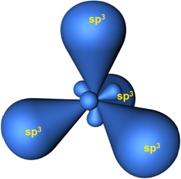
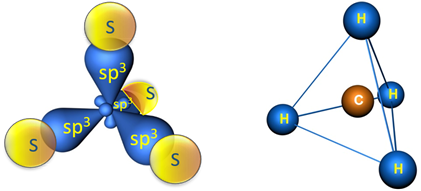
Образовавшиеся гибридные АО могут перекрываться другими АО, например 1s-орбиталями атомов водорода. Химические связи в молекуле метана образуются вдоль линии, соединяющей ядра атомов. Геометрическая форма молекулы CH4 - тетраэдр:
sp2 - ГИБРИДИЗАЦИЯ
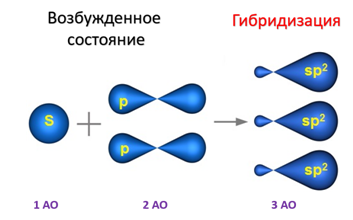
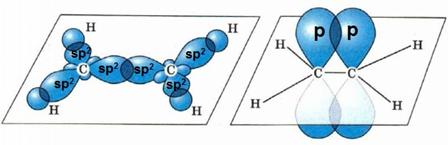
sp2-гибридизация характерна для органических соединений, содержащих двойную связь. В этом случае одна 2s-орбиталь и две 2p-орбитали образуют три sp2-гибридные орбитали, одинаковые по форме и энергии, а негибридизованная 2р-АО выше по энергии и имеет форму гантели:
Образование sp2-гибридизованных АО в атоме углерода можно показать также с помощью графической картинки:
Три гибридные орбитали располагаются под углом 120o друг к другу и направлены к вершинам правильного треугольника, в центре которого находится ядро атома углерода:
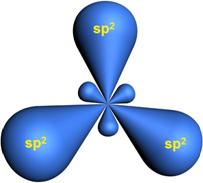
Три sp2-гибридные орбитали атома углерода образуют три σ-связи с 1s-орбиталями атомов водорода или орбиталями других атомов, например углерода . Негибридная р-АО также участвует в образовании связи в результате бокового перекрывания с другой негибридной p-АО орбиталью другого атома углерода:
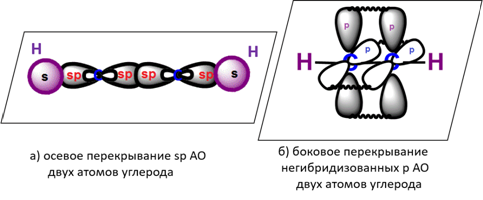
sp - ГИБРИДИЗАЦИЯ
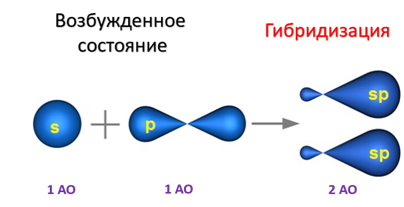
sp-Гибридизация характерна для органических соединений, содержащих тройную связь. В этом случае одна 2s-орбиталь и одна 2p-орбиталь образуют две sp-гибридные орбитали, одинаковые по форме и энергии, а негибридизованные две 2р-АО выше по энергии и имеют форму гантели:
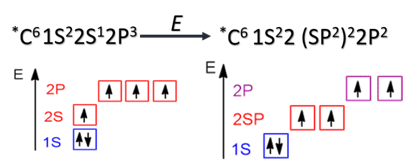
Образование sp-гибридизованных АО в атоме углерода можно показать также с помощью графической картинки:
Две гибридные орбитали располагаются под углом 180o друг к другу:

Две гибридные sp-АО участвуют в образовании σ-связей, а две негибридные 2р-АО образуют две π-связи с соседними негибридными p-АО в результате бокового перекрывания:
Дата добавления: 2021-01-20; просмотров: 62; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
