МОДЕЛЬ РЕЗЕРФОРДА. ЯДРО АТОМА
Лекция №1.Предмет химии. Строение атома.
Сложность статьи узнать больше, чем в школепобедить в олимпиаде
Ещё в XVIII веке совокупность всех наук, занимающихся исследованием природы, называли натурфилософией. С развитием научной мысли натурфилософия разделилась на несколько блоков естественных наук, в зависимости от главного объекта изучения:
1) физика, химия, физическая химия (объект исследования - материя, вещество);
2) биология, ботаника, зоология (объект исследования - жизнь);
3) анатомия, физиология, учение о происхождении и развитии, учение о наследственности (объект исследования - человек);
4) геология, минералогия, палеонтология, метеорология, география (объект исследования - Земля);
5) астрономия, астрофизика, астрохимия (объект исследования - Вселенная).
Наряду с физикой химия является одной из важнейших и обширных областей естествознания. И физика, и химия занимаются изучением различных веществ и явлений, происходящих с ними. Явления условно можно разделить на физические и химические.
Определение
Физическое явление - процесс, при котором происходит изменение формы предмета или изменение агрегатного состояния вещества с сохранением химического состава вещества.
Химическое явление - процесс, при котором происходит изменение состава одного или нескольких веществ.
В качестве примеров физических явлений можно привести таяние льда, испарение воды, нанесение краски на поверхность. К химическим явлениям относят горение газа, гашение соды уксусом, ржавление железа и пр.
|
|
|
Химия помогает предсказать поведение или свойства вещества в тех или иных условиях; для этого нужно знать состав вещества, то есть провести химический анализ. С помощью последовательности химических превращений (реакций) можно получить вещество с заданными свойствами; для этого применяют метод химического синтеза.

Свойства, которые проявляют вещества в химических превращениях, называются химическими свойствами. Их изучение является одной из задач химии.
Определение
Химия - наука о веществах, их свойствах и взаимных превращениях.
Предмет химии - химические элементы и их соединения, а также закономерности, которым подчиняются химические реакции.
Современная химия - настолько обширная область естествознания, что многие её разделы представляют собой самостоятельные (хотя и связанные друг с другом) дисциплины. По признаку изучаемых веществ химию традиционно принято делить на неорганическую и органическую; взаимодействие химии и физики привело к образованию области, занимающейся объяснением сущности химических явлений и установлением их закономерностей на основе физических принципов и экспериментальных данных - физической химии. Изучением и разработкой методов, позволяющих определить качественный и количественный состав вещества, занимается аналитическая химия. Химическая технология - наука, излагающая технологические основы современных производств; она позволяет разработать наиболее энергетически и экономически выгодные процессы получения веществ из природного и синтетического сырья. Химические и физические превращения с участием радиоактивных изотопов изучает радиохимия. Изучением химических процессов, протекающих в живых организмах, занимается биохимия. В последнее время появляются всё новые разделы химического знания - нанохимия, супрамолекулярная химия, материаловедение.
|
|
|
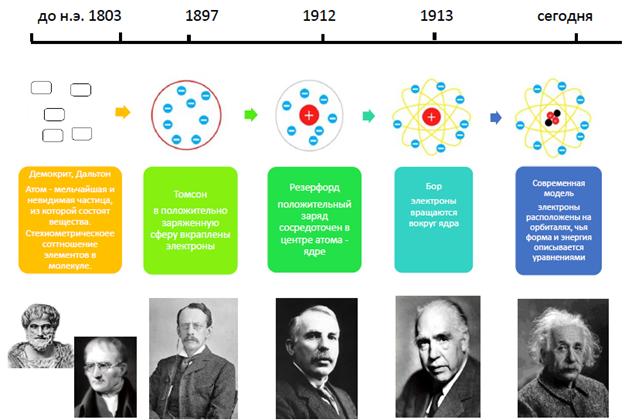
Атом: термин и эволюция понятия
Идея о том, что все вещества состоят из мелких, невидимых частиц возникла у людей еще до нашей эры в Древней Индии и Древней Греции. Известный греческий философ Демокрит, будучи одним из первых материалистов, впервые ввел термин "атом" (от греч.atomos- неделимый). Последователь идей Демокрита, Эпикур (341-270 г. до н.э.) впервые высказал предположение об атомном весе.
|
|
|


Согласно его теории атом - неделимая частица, которая существует вечно. По теории Демокрита:
- все тела состоят из бесчисленного количества сверхмалых, невидимых глазом, неделимых частиц-атомов;
- атомы непрерывно двигаются в пустоте;
- атомы никто не создавал, они были всегда;
- никто не может уничтожить атомы;
- атомы материальны: имеют вес, размеры, форму;
- одни атомы имеют крючочки, другие петельки с помощью которых соединяются друг с другом.

Дальнейшее развитие атомизм, как теория, получил в философии и науке Средних веков и Нового времени. В середине XVII в. французский философ и физик Пьер Гассенди (1592—1655) заново пересказал учение Демокрита и Эпикура, дополнив его новым понятием «молекула» для обозначения различного сочетания атомов друг с другом.

Р. Бойль (1627-1691 г.г.) написал знаменитую книгу «Химик-скептик», в которой доказал нереальность «начал» Аристотеля и ввел представление о химических элементах как о веществах, не поддающихся дальнейшему разложению. Определив задачей химии изучение элементов и их соединений. Р. Бойль поставил ее на научную основу.
Далее атомистическая теория получила свое логическое развитие в работах Ломоносова, Лавуазье, Дальтона и оформилась в атомно-молекулярное учение.
|
|
|
Модель Томпсона ("сливовый пудинг" или "булочка с изюмом"). Открытие электрона
До 1897 г атом считался мельчайшей неделимой частицей (элементарной). Именно этот год считается датой открытия электрона, первой субатомной частицы. Во второй половине 19 в. многие физики занимались исследованием так называемых «катодных лучей» - лучей, исходящих с поверхности катода при пропускании электрического разряда между катодом и анодом в стеклянной трубке с сильно разреженным газом.

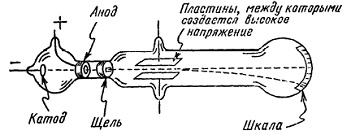
В своих опытах по отклонению катодных лучей в электрических и магнитных полях, Томсон убедительно показал, что эти лучи представляют собой поток заряженных частиц, а самое главное, ему удалось измерить удельный заряд (e/m) этих частиц. (Он оказался примерно в 2000 раз меньше удельного заряда иона водорода, известного из опытов по электролизу.) Томсон сразу же предположил, что электроны входят в состав атомов – откуда еще им было взяться? Дальнейшие работы ученых-физиков подтвердили это предположение. Таким образом, к концу 19 века электрон считался элементарной заряженной частицей, масса которой в 2000 раз меньше массы атома водорода.
После открытия электрона Томпсон предложил модель строения атома, которую обычно называют "сливовый пудинг" (или "пудинг с изюмом") или на русский манер "булочка с изюмом". Согласно Томпсону атом представляет собой положительно заряженную сферу, в которую вкраплены (как изюм в булочке) отрицательно заряженные электроны. Однако, эта модель была опровергнута опытом Резерфорда.


МОДЕЛЬ РЕЗЕРФОРДА. ЯДРО АТОМА
Опыт заключался в бомбардировке тонкого листа золотой фольги пучком альфа-частиц, которые, как тогда уже было известно, представляют собой заряженные атомы гелия. Если бы модель Томсона была верна, то все альфа-частицы проходили бы через лист фольги, лишь немного отклоняясь от первоначального направления движения (рисунок а).
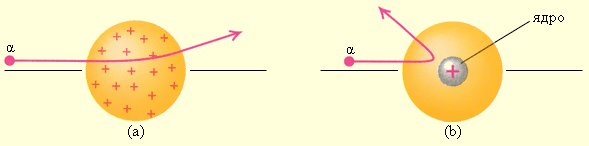
В действительности же результаты оказались удивительными: большинство альфа-частиц действительно отклонялось очень слабо, однако небольшая часть отклонялась на большие углы, а некоторые вообще отражались назад (рисунок b). Из результатов эксперимента Резерфорд сделал вывод, что «модель пудинга» была неверна, а в действительности же положительный заряд и подавляющая часть массы атома сосредоточены в небольшой области в центре атома, размеры которой значительно (более чем в тысячу раз) меньше размеров самого атома. Эта область позже получила название атомного ядра.
В 1917 Резерфордом был открыт протон - положительно заряженная элементарная частица. Тогда же он предположил и о существовании нейтрально заряженных частиц - нейтронов, чье существование и было экспериментально подтверждено позже Дж. Чэдвиком.
На основании полученных результатов Резерфордом была предложена следующая модель атома: . Атом состоит из положительно заряженного ядра и электронов вокруг него.
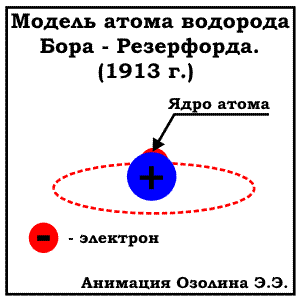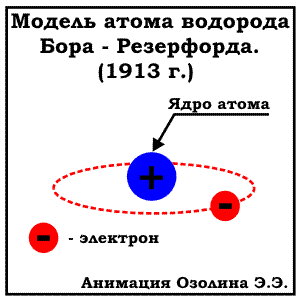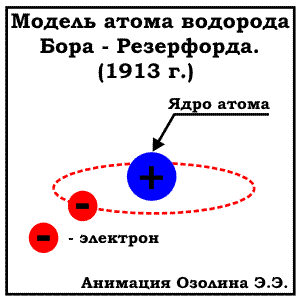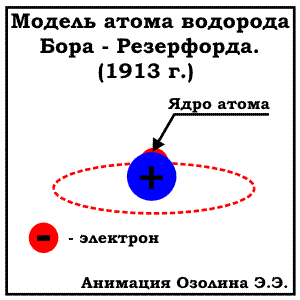
МОДЕЛЬ БОРА (ПЛАНЕТАРНАЯ МОДЕЛЬ). ЭНЕРГЕТИЧЕСКИЕ УРОВНИ
В 1913 Нильсом Бором была предложена модель строения атома, известная как "планетарная модель". По Бору электроны вращаются по орбитам расположены на строго определенном удалении от атомного ядра, точно также как планеты Солнечной системы вращаются вокруг солнца (отсюда и название модели). Эти орбиты (сейчас всем известны как энергетические уровни)- стационарные и вне их электрон существовать не может. К сожалению, объяснить это утверждение Бору на тот момент не удалось. Кроме того, предложенная модель Бора противоречила законам физики:
В начале прошлого века на смену планетарной модели строения атома пришла волновая модель, которая разрешила возникшие противоречия и на сегодняшний момент считается общепринятой.
Современное представление о строении атома было бы невозможно без открытия явления радиоактивности, элементарных частиц (электрона, протона и нейтрона). Решающий вклад в установлении строения атома внесли Дальтон, Дж.Дж. Томпсон (или Томсон), Э. Резерфорд, Н. Бор, Э. Шредингер, М. Планк, Люис, Паули.
История развития представлений о строении атома условно изображена на схеме ниже:
Дата добавления: 2021-01-20; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
