Принципы построения электронной конфигурации элемента
Количество электронов в атоме элемента равно его порядковому номеру.
Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням.

Разместим уже известные нам орбитали на энергетической диаграмме. Каждую незаполненную орбиталь мы обозначим пустым квадратиком (вертикальная ось показывает направление возрастания энергии).
Для полного описания электронного строения атома надо знать, как именно распределены электроны по энергетическим уровням. Перечень энергетических уровней, заполненных электронами, называют электронной конфигурацией атома.
При заполнении орбиталей электронами используют следующие правила.
- Принцип минимума энергии
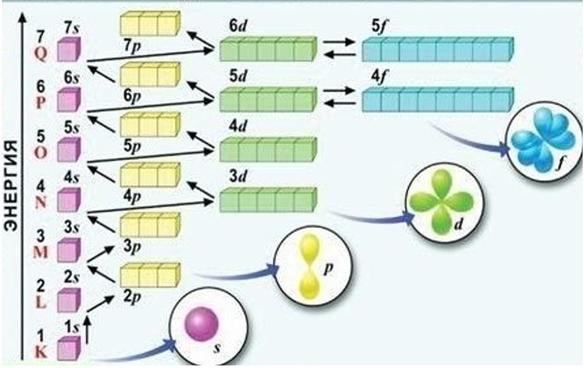
Орбитали заполняются в порядке увеличения энергии, снизу вверх. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией.
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
- Принцип Паули
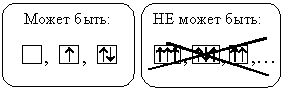
На каждой орбитали может находиться не более двух электронов. Если два электрона находятся на одной орбитали, то они обладают противоположными спинами (стрелки направлены в разные стороны). Такие электроны называют спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.
|
|
|
- Правило Хунда (Гунда)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.

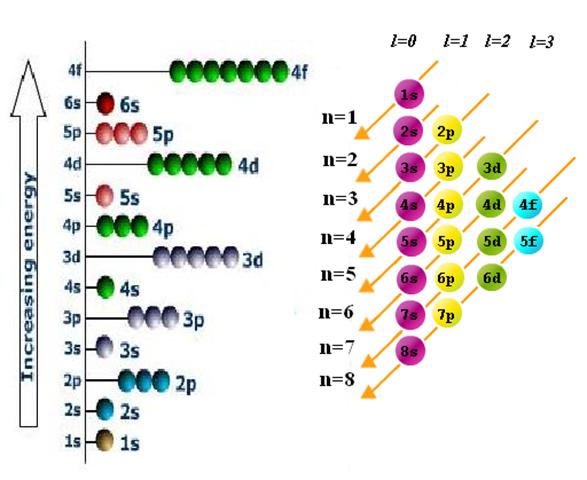
Обратите внимание, что 4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь. Это означает, что в первую очередь электроны заполнят 4s-подуровень и лишь затем 3d-подуровень. Для удобства запоминания порядка заполнения энергетических подуровней лучше воспользоваться следующей схемой: в каждой отдельной строке написать возможные типы орбиталей для каждого уровня, провести стрелки под углом 450 и «расселять» электроны по подуровням, ориентируясь по стрелкам сверху вниз.
Запись электронной конфигурации атома
Подробные электронные конфигурации атомов изображают двумя способами:
- графически, с помощью квадратиков со стрелками (часто называют энергетическими диаграммами);
- в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.
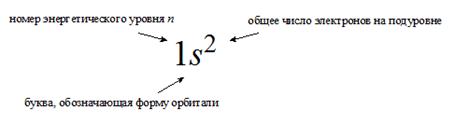

|
|
|
Рассмотрим порядок заполнения электронами энергетических уровней, воспользовавшись периодической системой. Число электронов в атоме элемента, как вы помните, равно заряду его ядра, а следовательно, и порядковому номеру элемента в периодической системе. Так, например, в атоме водорода (N = 1) содержится всего один электрон, а в атоме кислорода (N = 8) — восемь. В каждом периоде периодической системы электронная оболочка атома каждого последующего элемента повторяет строение электронной оболочки предыдущего элемента с добавлением одного электрона.
Число заполненных энергетических уровней в атоме равно номеру периода, в котором расположен элемент.
Дата добавления: 2021-01-20; просмотров: 114; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
