Современная модель строения атома (волновая модель)
Атом состоит из положительно заряженного ядра, окружённого отрицательно заряженной электронной оболочкой
Атом — электронейтрален, то есть количество положительно заряженных частиц в нем равно количеству отрицательно заряженных частиц.
Долгое время считалось, что протоны и нейтроны являются элементарными (то есть неделимыми) частицами. Но на сегодняшний момент признано, что они имеют сложное строение и состоят из кварков. Электрон же до сих пор считается элементарной частицей. Положительно и нейтрально заряженные частицы (протоны и нейтроны, соответственно) сосредоточены в ядре, чья масса составляет около 99,97% от массы атома. Радиус атома, как правило, составляет несколько ангстрем (10−10 м), радиус ядра в 10 000 раз меньше радиуса атома.
Ядро - самая тяжелая и самая маленькая часть атома.

Из заряженных частиц электрон является самой легкой (см.таблицу ниже), его масса в 1837 раз меньше массы атома водорода. Поэтому в относительных единицах масса протона и нейтрона принята за 1, а масса электрона - за 0. Учитывая заряд каждой из частиц принята запись:
для протона: 11p или p+
для нейтрона: 10n или n0
для электрона: 0−1e или e¯
| Частица | Обозначение | Заряд | Масса | |
| г.а.е.м. | отн. ед.м. | |||
| Электрон | e¯ | -1 | 9,10⋅10−28 | 0,00055 |
| Протон | p+ | +1 | 1,67⋅10−24 | 1,0073 |
| Нейтрон | n0 | 0 | 1,67⋅10−24 | 1,0087 |
Порядковый номер и массовое число элемента.
|
|
|
Атом состоит из ядра, в котором располагаются протоны и нейтроны, и из электронов, расположенных на электронных оболочках.
Определение
Частицы, содержащиеся в ядре называются нуклонами (протоны и нейтроны).
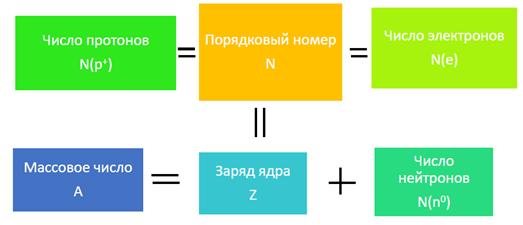
Атом электронейтрален, поэтому число протонов N(p+) и электронов N(e¯)в нем одинаково и равно порядковому номеру элемента (обозначается N):
N=N(e¯)=N(p+)
Весь положительный заряд ядра создается протонами. Их общее число равно заряду ядра(обозначается Z). Во всех атомах одного и того же химического элемента число протонов всегда одинаково (и равно заряду ядра), а число нейтронов N(n0)бывает разным.
Сумму числа протонов и нейтронов в ядре называют массовым числом атома (обозначается A):
A = Z + N,
где A- массовое число, Z - число протонов, N- число нейтронов
То есть именно заряд ядра является основной характеристикой атома, отличающей атомы одного вида от атомов другого вида. Зная строение ядра атома, мы можем дать строгое определение понятию "химический элемент":
Определение
Химический элемент – это вид атомов, составляющих физические тела, и характеризующийся одним и тем же зарядом ядра.
Изотопы
У одного и того же химического элемента могут быть разновидности атомов с разной атомной массой.
|
|
|
Определение
Изотопы ‑ это атомы одного и того же элемента, которые имеют разную массу (массовое число).
Ядра изотопов содержат одинаковое количество протонов, но разное число нейтронов. Так, например, в природе встречаются три разновидности атомов кислорода, три изотопа, различающиеся массой – О16О, О17О, О18О. Химические свойства изотопов одинаковы, а некоторые физические свойства незначительно различаются.
Обычно изотопы изображаются следующим образом: Z→6A→12C, где порядковый номер N=6, массовое число A=12.
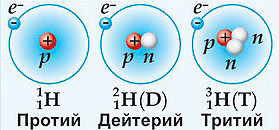
Как правило, изотопы различных элементов не имеют специальных названий, их называют «кислород-16», «кислород-17 и т.д.». Однако, изотопы водорода имеют не только специальные названия, но также и специфичные символы (см.рисунок): протий 11H, дейтерий 12D и тритий 13T.
Задача
Какое количество электронов, протонов и нейтронов содержится в изотопах углерода 12 и 13?
Решение
Дано: 612C и 613C
Решение.
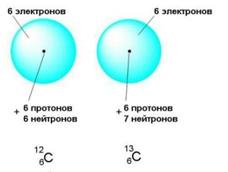
Для изотопа углерода 12:
Z→6A→12C , порядковый номер N=6, массовое число A=12
N=N(e¯)=N(p^+)=6
N(n0) = A — Z = 12 — 6 = 6
Углерод-12 содержит 6 электронов, 6 протонов и 6 нейтронов
Для изотопа углерода 13:
Z→6A→13C, порядковый номер N=6, массовое число A=13
|
|
|
N=N(e¯)=N(p^+)=6
N(n0) = A — Z = 13 — 6 = 7
Углерод-13 содержит 6 электронов, 6 протонов и 7 нейтронов
Атомная орбиталь
Все химические свойства веществ, то есть способность вступать в химические реакции, определяются строением электронных оболочек атомов. Электрон — главная элементарная частица для химии, так как именно благодаря обмену электронами могут образовываться новые химические соединения. Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех других частиц, он одновременно является и частицей, и волной. Говоря научным языком, имеет двойственную природу. С одной стороны, обладая малой массой (почти в 2 тыс. раз меньше, чем масса протона и нейтрона), электрон проявляет свойства частицы. С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако». В этой области пространства электронная плотность достаточно велика. Этим объясняются волновые свойства электрона. Дуализм электрона подтверждается экспериментально. Так, например, для потока электронов, как и для световых волн, характерны явления интерференции (наложения) и дифракции (огибание препятствия).
|
|
|


Определение
Атомная орбиталь — это область пространства, в которой вероятность нахождения электрона максимальна.
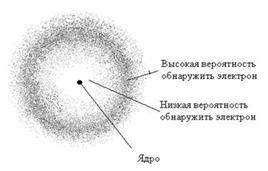
На каждой орбитали могут максимально размещаться два электрона, обладающие равной энергией, но отличающиеся особым свойством, спином.
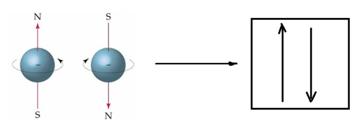
Если очень условно уподобить электрон детской игрушке — волчку, то электроны с разными спинами будут соответствовать волчкам, вращающимся в разные стороны. Графически орбиталь принято изображать в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз. Стрелки, направленные в противоположные стороны, означают электроны с двумя противоположными спинами.
Электронныеорбитали имеют определенную форму и энергию. Ряд орбиталей, обладающих равной или близкой энергией, образует энергетический уровень (слой). Номер уровня обозначают числом (n = 1, 2, 3…) или заглавной латинской буквой (K, L, M и дальше по алфавиту). Различают первый (n = 1 или K), второй (n = 2 или L), третий (n = 3 или M) и т. д. энергетические уровни, вплоть до бесконечности (n=∞ означает, что электрон улетает из атома, и атом превращается в ион). Уровень с номером n включает ровно n2 орбиталей, на которых может разместиться максимально 2n2 электронов. Номер энергетического уровня n называют главным квантовым числом.
Таким образом, на первом энергетическом уровне могут максимально находиться 2 электрона, на втором — 8, на третьем — 18 и т. д.
Формы атомныхорбиталей
Каждый энергетический уровень делится на энергетические подуровни, которые образованы орбиталями, имеющими одинаковую форму и равную энергию. По форме различают s-, p-, d- и f-орбитали. s-орбитали имеют форму шара, иными словами, электрон, находящийся натакойорбитали (его называют s-электроном), большую часть времени проводит внутри сферы. s-орбиталь, находящуюся на первом энергетическом уровне, обозначают 1s, на втором — 2s и т. д.
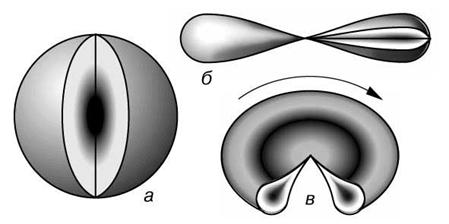
р-орбитали имеют форму объемной восьмерки (см. рис. б и в). Следует подчеркнуть, что любая орбиталь является объемной. Они могут быть направлены по одной из трех координатных осей (обозначаются px,py, pz), поэтому на каждом энергетическом уровне (кроме первого, где есть только s-орбиталь) существуют три р-орбитали, обладающие одинаковой энергией. Формы d- и f-орбиталей намного сложнее. На рисунке видно, что существует 5 форм d-орбиталей и 7 форм f-орбиталей. На каждой из орбиталей, как вы помните, могут размещаться не более двух электронов, следовательно, s-подуровень максимально вмещает 2 электрона, p — 6, d — 10, f — 14.
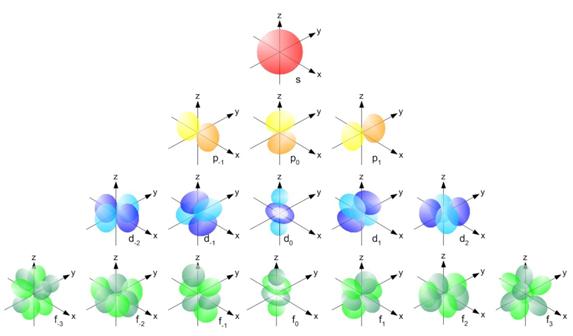
Орбитали одной и той же формы, но находящиеся на разных энергетических уровнях (например, 1s, 2s и 3s-орбитали), отличаются по энергии. Чем больше номер уровня, тем выше энергия орбитали и тем больше ее размер.
Рассмотрим три первых энергетических уровня. На первом уровне (n = 1) есть только 1s-подуровень (одна 1s-орбиталь), на котором максимально могут находиться два электрона (2 = 2×1). Второй энергетический уровень включает два подуровня: 2s- подуровень (одна 2s- орбиталь) и 2p-подуровень (три 2p-орбитали), всего четыре орбитали, на которых может находиться до 8 электронов (8 = 2×22). В состав третьего уровня (максимально 18 электронов) входят три подуровня: 3s- (одна орбиталь), 3p- (три орбитали) и 3d- (пять орбиталей), всего 9 орбиталей, содержащих не более 18 электронов (18 = 2×32).
| Номер энергетического уровня (n) | Подуровни и их схематичное изображение | Максимальное число электронов на энергетическом уровне (N=2n2) | |||
| s- | p- | d- | f- | ||
| 1 | ◻1s | 2 | |||
| 2 | ◻2s | ◻◻◻2p | 8 | ||
| 3 | ◻3s | ◻◻◻3p | ◻◻◻◻◻3d | 18 | |
| 4 | ◻4s | ◻◻◻4p | ◻◻◻◻◻4d | ◻◻◻◻◻◻◻4f | 32 |
Электроны занимают уровни и орбитали последовательно, в порядке увеличения энергии. Сначала заполняется первый энергетический уровень, после его завершения — второй и т. д.
Дата добавления: 2021-01-20; просмотров: 169; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
