Управление простыми обратимыми реакциями. Получение серной кислоты
Обратимыми называются процессы, в которых одновременно протекают прямая и обратная реакции.
Рассмотрим реакцию aA + bB ↔ cC + dD.
В начальный момент времени скорость прямой реакции, которая пропорциональна произведению концентраций реагентов А и В
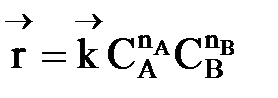 ,
,
больше скорости обратной реакции, пропорциональной произведению концентраций продуктов С и D
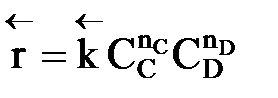 .
.
Но с течением времени, по мере увеличения концентрации веществ CиD скорость обратной реакции увеличивается, а скорость прямой реакции уменьшается. В некоторый момент времени они становятся равными 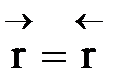 ; наступает химическое равновесие. После достижения равновесия соотношение участников реакции остается постоянным во времени. Это соотношение называется константой равновесия.
; наступает химическое равновесие. После достижения равновесия соотношение участников реакции остается постоянным во времени. Это соотношение называется константой равновесия.
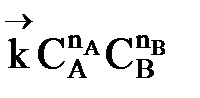 =
= 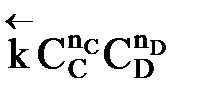
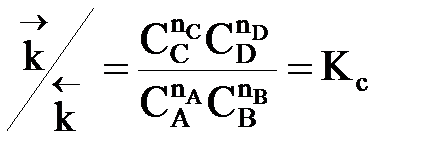
При управлении обратимым процессом важно не только обеспечить высокую скорость процесса, но и создать условия, при которых химическое равновесие смещено в сторону образования целевого продукта
Характеристика модели:
1) Процесс простой – можно описать одним стехиометрическим уравнением аА + bВ ↔ cС + dD, где С – целевой продукт;
β = α, так как весь реагент превращается только в целевой продукт.
2) Процесс обратимый – αmax = α*≠ 100%.
| C* |
| С |
| τ |
| α |
| τ |
| α* |
| С0 |
1) Процесс гомогенный – скорость процесса равна скорости химической реакции.Однако следует помнить, что в обратимых процессах скорость равна разности скорости прямой и обратной реакции 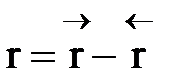 . Она уменьшается во времени и при
. Она уменьшается во времени и при 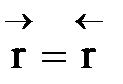 (в момент наступления химического равновесия) равна нулю.
(в момент наступления химического равновесия) равна нулю.
|
|
|
Объекты управления: скорость химической реакции и положение равновесия.
Инструменты управления: кинетические параметры.
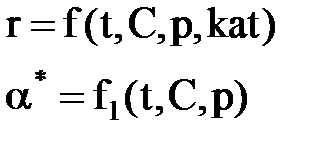
Получение серной кислоты.
1) Получают SO2 из колчедана
2) Превращают SO2 в SO3
3) Поглощение SO3 водой
Окисление SO2 u SO3 :
2SO2 + O2 ß à 2SO3 dH=-94/23 кДж / моль кат -V205
Процесс простой,обратимый, гетерогенно-каталитический,экзотермический,кат-1,газофазный.
Объект управления скорость процесса,положение равновесия.
Кат- ванадиевые контактные массы,содержание-7%
Получение серной кислоты осуществляется из серосодержащего сырья (Н2S, S, серный колчедан) до оксида S+4, далее в SO3 и он поглощается водой.
2SO2(г)+O2  2SO3(г) ∆H= -94 КДж/моль ( простой, обратимый, катал, газофазный, экзотермический, гетерогенно-катал). Объект управления: r проц и положение равновесия.Серный колчедан подают в печь кипящего соля. Полученный обжиговый газ SO2 падают сначала в котел-утилизатор а затем на стадии сухой очистки пыли циклон-4 и в сухой фильтр пять, в котле-катализатор происходит охлаждение газа с одновременным получением неорганических водяных паров кипящего имеющего параметры температура 450 градусов и давлении 4 Мпадалее вы честном отделение на промывание башни 6 и 7 на мокрые электрофильтры 8 и 9 и сушильной башни 10 перед башней обжиговый газ разбавляют воздухом после сушильной башни обжиговый газ проходит через фильтр брызгаловитель 12 и поступает в трубопровод где нагревается продуктами реакции до температуры 420440 градусов затем газ поступает на первый аппарат. в первом слое катализатора происходит окисление so2 на 74 %,увеличение температуры до температуры 600 градусов. теперь необходимо охладить. после охлаждения до 465 градусов газ поступает на второй слой аппаратов. степень превращения на втором слое катализатора составляет 86%, температура на втором слое 514 градусов первой ступени в абсорберы.
2SO3(г) ∆H= -94 КДж/моль ( простой, обратимый, катал, газофазный, экзотермический, гетерогенно-катал). Объект управления: r проц и положение равновесия.Серный колчедан подают в печь кипящего соля. Полученный обжиговый газ SO2 падают сначала в котел-утилизатор а затем на стадии сухой очистки пыли циклон-4 и в сухой фильтр пять, в котле-катализатор происходит охлаждение газа с одновременным получением неорганических водяных паров кипящего имеющего параметры температура 450 градусов и давлении 4 Мпадалее вы честном отделение на промывание башни 6 и 7 на мокрые электрофильтры 8 и 9 и сушильной башни 10 перед башней обжиговый газ разбавляют воздухом после сушильной башни обжиговый газ проходит через фильтр брызгаловитель 12 и поступает в трубопровод где нагревается продуктами реакции до температуры 420440 градусов затем газ поступает на первый аппарат. в первом слое катализатора происходит окисление so2 на 74 %,увеличение температуры до температуры 600 градусов. теперь необходимо охладить. после охлаждения до 465 градусов газ поступает на второй слой аппаратов. степень превращения на втором слое катализатора составляет 86%, температура на втором слое 514 градусов первой ступени в абсорберы.
|
|
|
здесь поглощают серную кислоту 98 градусов процентов не поглощенный so2 вновь отправляется. после абсорбера газ нагревают до 430 градусов и подают на четвертый слой. в четвертом слое происходит превращение so2 на 80% температура повышается до 450 градусов реакционная смесь охлаждённый до температуры 410 градусов и направленные на пятый слой катализатора контактного аппарата. в этом слове общая степень превращения равна 99 ,95% газовой смеси после охлаждения до 100% нагревают абсорбер второй ступени поглощенный газ составляет состоит из воздуха очищает и выбрасывают в атмосферу на выходе получают 98%-ю серную кислоту.
|
|
|
Дата добавления: 2020-04-25; просмотров: 203; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
