Катализ в химической технологии.Типы промышленных катализаторов.Требования,предьявляемые к промышленным катализаторам.
Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который, согласно теории промежуточных соединений, многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1]
Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Катализа́ция (явление катализа) распространена в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.: большая часть всех промышленных реакций — каталитические). Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции как в прямом, так и в обратном направлениях. Поэтому они не смещают химическое равновесие[2].
Требования :
1) Каталитическая активность - скорость превращения реагента, отнесенная к единице объёма или к массе
или к массе
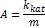
|
|
|

1-Период созревания
2-Период постоянной активности
3-Период деактивации kat
2) Селективность- способность катализатора ускорять только целевую реакцию
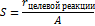
A-активность
3)Производительность катализатора- количество целевого продукта , произведенного в единицу времени с единицы поверхности.
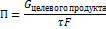
Типы промышленных ктализаторов:
1) Модифицированные катализаторы. Модификатор – добавка к катализатору небольшого (до10 – 12 мас. %) количества другого вещества, каталитически не активного для данной реакции, но улучшающего те или иные качества катализатора (термостойкость, прочность, ядоустойчивость). Fe.
2) Смешанные катализаторы. Смешанными называют катализаторы, содержащие несколько каталитически активных для данной реакции составляющих, взятых в соизмеримых количествах.
3) Катализаторы на носителях. Носитель определяет форму и размер гранул, оптимальную пористую структуру, прочность, термостойкость, снижение стоимости. Иногда увеличивает активность (см. теорию поля лигандов). Классификация носителей: синтетические – силикагель, активированный уголь, оксид алюминия (g, a), керамика; природные – пемза, диатомит; по объему пор – пористые (более 10%), непористые (10 и менее %);
|
|
|
10)Катализатор. Механизм ускоряющего действия катализатора. Классификация катализаторов. Физические и химические свойства катализаторов .
Катализатор-вещество присутствующее в реакционной смеси в небольших кол-вах и ускоряющее хим. реакцию.
A+kat=Akat
Akat+B=ABkat
ABkat=C+D+kat
Eakat<Eaнеkat
rkat>rнеkat
Катализатор увеличивает скорость хим. реакции изменяя ее путь и снижая энергию активации A=Kkat/K= (K0e^(Eakat/RT))/K0e^(Ea/RT)=e^((Eakat-Ea)/RT)
Классификация катализаторов
По механизму действия
1.Ионные катализаторы: протонные и апротонные кислоты на носителях, природные и синтетические алюмосиликаты
2. Электронные катализаторы: металлы и некоторые оксиды металлов.
3. Бифункциональные:Pt на Al2O3, смесь ZnO, Al2O3 и Mg
По составу : смешанные, модифицированные, катализаторы на носителях.
По методу приготовления: природные(силикаты и алюмосиликаты),плавленные в виде проволочных сеток, катализаторы на носителях получаемые путем пропитки носителя, осажденные.
Физические свойства:
1. поверхность
2. кристалличность
3.теплопроводность
4. механическая прочность
5. термическая стабильность
Способ увеличения поверхности катализатора:
1. уменьшение размера зерен катализатора
2. усложнение формы зерен катализатора
|
|
|
3. увеличение пористости катализатора
Химические свойства катализатора:
Каталитическая активность-скорость превращения реагента, отнесенная к единице объема, поверхности или массы катализатора А=Kkat/kat
Селективность катализатора- способность катализатора ускорять только целевую реакцию.
Производительность катализатора - количество целевого продукта, произведенного в единицу времени с единицы поверхности катализатора
Дата добавления: 2020-04-25; просмотров: 227; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
