Влияние температуры на скорость химической реакции
Влияние температуры на количество столкновений молекул может быть показано с помощью модели. В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций): В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:где g - tтемпературный коэффициент, принимающий значения от 2 до 4. С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц a, зависящую от температуры: - a = exp(-E/RT). и вывел уравнение Аррениуса для константы скорости реакции:
k = koe-E/RT
где ko и E dзависят от природы реагентов. Е - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.
Влияние давления на скорость химической реакции
Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации.
p/RT = c
Давление и молярная концентрация газа связаны прямо пропорционально. Поэтому в закон действующих масс мы можем подставлять вместо концентрации p/RT.
2. Зависимость скорости реакции от давления
определяется уравнением Клапейрона – Менделеева, которое связывает концентрацию и давление:
pV = nRT, откуда
С = p/RT
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления. Эта зависимость актуальна в первую очередь для процессов, идущих с участием газов. Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит υ – она станет в 2 раза больше.
|
|
|
Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс: υ = k[A]a·[B]b
Очевидно, что с увеличением концентраций реагирующих веществ, υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами. Причем, важно учитывать порядок реакции: если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества. Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 22 = 4 раза, а увеличение концентрации в 3 раза ускорит реакцию в 32 = 9 раз.
Влияние катализаторов на скорость химической реакции.
Катализатор - вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.Катализатор может участвовать в реакции бесконечное число раз. Но следует учесть, что в реакциях могут присутствовать соединения, понижающие активность катализатора. Такие вещества называется каталитическими ядами, а сам процесс – отравлением.
|
|
|
Гомогенный катализ.
2SO2 + O2= 2SO3 (1),
(А + В = АВ),
Катализатор – NO.
O2 + 2NO = 2NO2 (2),
(В + К = ВК),
2NO2 + 2SO2 = 2SO3+ 2NO (3),
(ВК + А = АВ + К).
Гетерогенный катализ.
При гетерогенном катализе происходит адсорбция реагирующих веществ поверхностью катализатора (она неоднородна, и здесь расположены активные центры, под действием которых связь между атомами реагентов ослабляется, молекула деформируется, а иногда даже распадается).
2SO2 + O2 = 2SO3,
Катализатор V2O5, Pt.
SO2 + V2O5 = SO3 + 2VO2,
2VO2 + ½ O2= V2O5.
Для катализатора характерна избирательность действия (определенный катализатор для определенной реакции). Подбор оптимальных катализаторов является насущной проблемой многих производств: переработка газов, крекинг углеводородов, нефтяная промышленность, получение полимеров, каучука и т. д.В живой природе катализаторы также играют большую роль, только называются они ферментами




5 )Области протекания гетерогенного процесса. Механизм (стадии) гетерогенного процесса. Способы интенсификации в системе "газ-тв". Получение серной кислоты. Обжиг колчедна. Реактор
|
|
|
Гетерогенные химические процессы основаны на реакциях между реагентами, находящимися в разных фазах. Химические реакции являются одной из стадий гетерогенного процесса и протекают после перемещения реагентов к поверхности раздела фаз, а в ряде случаев и через межфазную поверхность.
Гетерогенные процессы сложны и протекают в несколько стадий (по меньшей мере три):
I стадия - перенос реагирующих веществ к реакционной зоне (поверхности раздела фаз);
II стадия - собственно гетерогенная химическая реакция;
III стадия - отвод продуктов реакции из зоны реагирования.
Во всех стадиях скорости процессов пропорциональны величине поверхности раздела фаз. Следовательно, скорости гетерогенных реакций зависят от отношения величин поверхности раздела фаз к их объёму.
Суммарная скорость гетерогенного процесса определяется скоростями отдельных стадий. Скорость процесса определяет стадия с наименьшей скоростью.
Если самой медленной стадией процесса является подвод реагирующих веществ в зоне реакции или отвод из нее продуктов реакции, то процесс протекает в диффузионном режиме, в диффузионной области.
|
|
|
Если стадия с наименьшей скоростью связана с химическим или физическим превращением, то скорость процесса определяется скоростью реакции, процесс протекает в кинетическом режиме, в кинетической области.
В случае сравнимых скоростей диффузии и химического превращения процесс протекает в промежуточной области.
Пути интенсификации процесса “Г-Т”.
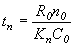 . Чем интенсивнее процесс, тем меньше tn. Для уменьшения tn:
. Чем интенсивнее процесс, тем меньше tn. Для уменьшения tn:
а) уменьшение Ro, т.е. измельчение твердого материала;
б) повышение концентрации реагента в газовой фазе Co.
Некоторые меры эффективны только для определенного режима. Так, нужно повышать Kn, но для каждого режима Kn имеет свой смысл (бетта) – для диффузионного и кинетического. Поэтому при диффузионном режиме дает эффект увеличение скорости обтекания частицы газом (бетта возрастает), а при кинетическом – повышении температуры (Kn возрастает)
внешняя диффузия молекул регентов из заряда потока к поверхности катализатора
внутренняя диффузия молекул в порах катализатора
активированная адсорбция молекул на поверхности катализатора с образованием поверхностных непрочных химических соединений активированных комплексов.
перегруппировка атомов с образованием поверхностных комплексов
десорбция молекул продуктов с поверхности
внутренняя диффузия молекул продуктов в порах катализатора
внешняя диффузия молекул продуктов от поверхности катализатора в ядро потока.
Области протекания:
Внешнедиффузионная- диффузия к внешней поверхности катализатора(инструмент- гидродинамические факторы)
.Внутидиффузионная- диффузия внутри пор катализатора(инструменты управления-размеры пор катализатора)
Кинетическая- химическая реакция на поверхности катализатора( инструмент- кинетические факторы )
Получение серной кислоты осуществляется из серосодержащего сырья (Н2S, S, серный колчедан) до оксида S+4, далее в SO3 и он поглощается водой.
2SO2(г)+O2 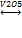 2SO3(г) ∆H= -94 КДж/моль ( простой, обратимый, катал, газофазный, экзотермический, гетерогенно-катал). Объект управления: r проц и положение равновесия.Серный колчедан подают в печь кипящего соля. Полученный обжиговый газ SO2 падают сначала в котел-утилизатор а затем на стадии сухой очистки пыли циклон-4 и в сухой фильтр пять, в котле-катализатор происходит охлаждение газа с одновременным получением неорганических водяных паров кипящего имеющего параметры температура 450 градусов и давлении 4 Мпадалее вы честном отделение на промывание башни 6 и 7 на мокрые электрофильтры 8 и 9 и сушильной башни 10 перед башней обжиговый газ разбавляют воздухом после сушильной башни обжиговый газ проходит через фильтр брызгаловитель 12 и поступает в трубопровод где нагревается продуктами реакции до температуры 420440 градусов затем газ поступает на первый аппарат. в первом слое катализатора происходит окисление so2 на 74 %,увеличение температуры до температуры 600 градусов. теперь необходимо охладить. после охлаждения до 465 градусов газ поступает на второй слой аппаратов. степень превращения на втором слое катализатора составляет 86%, температура на втором слое 514 градусов первой ступени в абсорберы.
2SO3(г) ∆H= -94 КДж/моль ( простой, обратимый, катал, газофазный, экзотермический, гетерогенно-катал). Объект управления: r проц и положение равновесия.Серный колчедан подают в печь кипящего соля. Полученный обжиговый газ SO2 падают сначала в котел-утилизатор а затем на стадии сухой очистки пыли циклон-4 и в сухой фильтр пять, в котле-катализатор происходит охлаждение газа с одновременным получением неорганических водяных паров кипящего имеющего параметры температура 450 градусов и давлении 4 Мпадалее вы честном отделение на промывание башни 6 и 7 на мокрые электрофильтры 8 и 9 и сушильной башни 10 перед башней обжиговый газ разбавляют воздухом после сушильной башни обжиговый газ проходит через фильтр брызгаловитель 12 и поступает в трубопровод где нагревается продуктами реакции до температуры 420440 градусов затем газ поступает на первый аппарат. в первом слое катализатора происходит окисление so2 на 74 %,увеличение температуры до температуры 600 градусов. теперь необходимо охладить. после охлаждения до 465 градусов газ поступает на второй слой аппаратов. степень превращения на втором слое катализатора составляет 86%, температура на втором слое 514 градусов первой ступени в абсорберы.
здесь поглощают серную кислоту 98 градусов процентов не поглощенный so2 вновь отправляется. после абсорбера газ нагревают до 430 градусов и подают на четвертый слой. в четвертом слое происходит превращение so2 на 80% температура повышается до 450 градусов реакционная смесь охлаждённый до температуры 410 градусов и направленные на пятый слой катализатора контактного аппарата. в этом слове общая степень превращения равна 99 ,95% газовой смеси после охлаждения до 100% нагревают абсорбер второй ступени поглощенный газ составляет состоит из воздуха очищает и выбрасывают в атмосферу на выходе получают 98%-ю серную кислоту.
Дата добавления: 2020-04-25; просмотров: 186; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
