Сущность эффекта Доннана (распределение электролитов между клеткой и средой), биологическое значение.
В живых тканях всегда наряду с растворами белков и их солей, присутствуют также ионы обычных электролитов (NaCI, KCI,CaСI2,Na2HPO4,NaHCO3).
Присутствие в организме солей белков, отделенных клеточной мембраной от растворов электролитов, приводит к перераспределению электролитов и соответственно влияет на осмотическое давление по обе стороны мембраны. Перераспределение электролитов подчиняется уравнению мембранного равновесия, выведенного Доннаном.
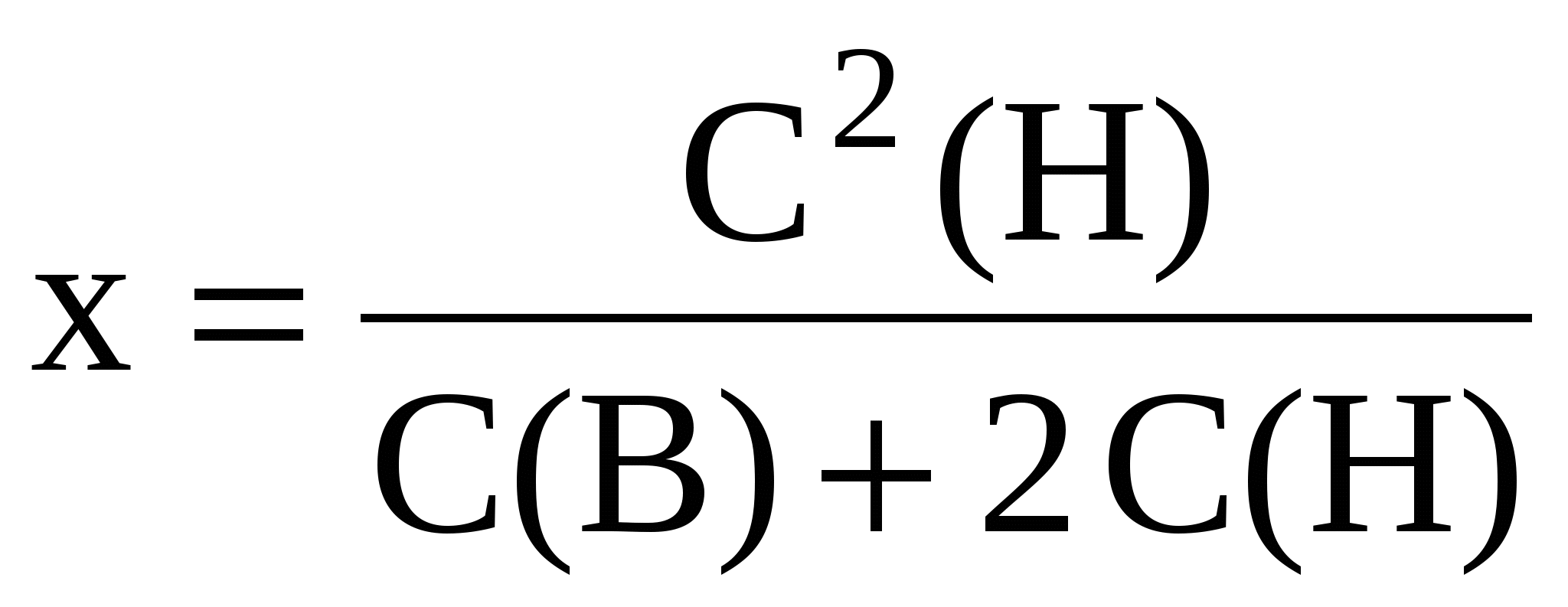
где: х – количество ионов, прошедших через мембрану внутрь клетки; С(Н) – количество ионов электролита снаружи мембраны; С(В) – количество ионов электролита внутри клетки.
В присутствии полиэлектролитов всегда наблюдается явление перераспределения ионов через мембрану (эффект Доннана), что будет сказываться на осмотическом давлении, величине биопотенциалов. Поэтому, в живом организме эффект Доннана является одной из причин сложных процессов изменения осмотического давления, изменения мембранного потенциала, ввиду перераспределения электролитов в присутствии полиэлектролитов - белков.
Мембранным равновесием Доннана называют равновесие, устанавливающееся в системе растворов, разделённых мембраной, непроницаемой хотя бы для одного вида ионов, присутствующих в системе.
эффект Гиббса-Доннана- неравномерное распределение электролитов между клеткой и межклеточным веществом
-межклеточное в-вои цитоплазма клетки - растворы электролитов, при этом в цитоплазме есть белки в виде анионов, и белков, практически, нет в межклеточном веществе
-эти растворы разделены полупроницаемой клеточной мембраной
-мембрана проницаема для ионов Сl- и непроницаема для белков
-межклеточное вещество и цитоплазма клетки - электронейтраленые растворы
-подвижные анионы Сl- уравновешивают заряд катионов в клетке и в межклеточном веществе
в клетке заряд недиффундирующих белков-анионов должен быть уравновешен большей концентрацией катионов К+ и меньшей концентрацией анионов Сl-
биологическое значение доннановского равновесия:
в результате неравномерного распределения ионов К+ и Сl- возникает мембранный потенциал.
Таким образом, внутри клетки количество ионов всегда больше, чем
снаружи. Этим объясняется повышенное осмотическое давление клетки по сравнению с давлением окружающей клетки жидкости. Это обстоятельство поддерживает тургор клеток.
Эффект Доннана (т.е. неравномерное распределение электролитов между клетками и омывающей их жидкостью) оказывает большое влияние на жизнедеятельность клеток, на величину биопотенциалов, распределение электролитов и пр. наряду с физиологическими механизмами.
Как и почему отличаются коллигативные свойства растворов электролитов и неэлектролитов?
Раствор неэлектролита состоит из растворителя и растворенного вещества в виде недиссоциированных молекул. Коллигативными свойствами раствора неэлектролита являются свойства, которые зависят от концентрации и практически не зависят от природы неэлектролита. К таким свойствам относятся:
Относительное понижение давления насыщенного пара растворителя над раствором (Iзакон Рауля)
Понижение температуры замерзания (IIзакон Рауля)
Повышение температуры кипения (IIзакон Рауля)
Осмотическое давление раствора (закон Вант-Гоффа)
Раствор электролита состоит из растворителя и растворенного вещества (электролита), которое частично или полностью диссоциирует на ионы. В растворе число частиц в результате диссоциации увеличивается. Коллигативные свойства растворов электролитов описываются уравнениями с поправочным множителем – изотоническим коэффициентом ( i), учитывающим процесс диссоциации. Изотонический коэффициент показывает во сколько раз опытное значение для растворов электролитов больше теоретически вычисленных для раствора неэлектролита с той же концентрацией.
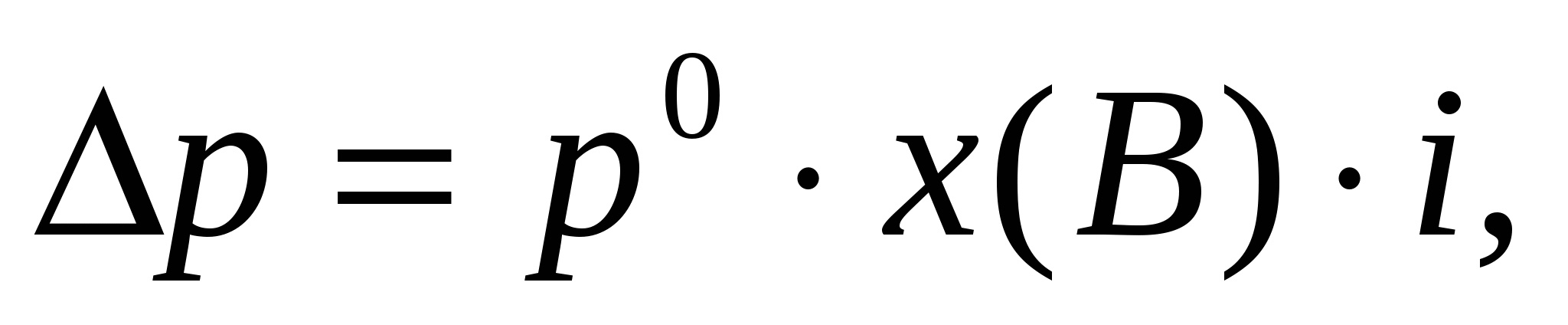
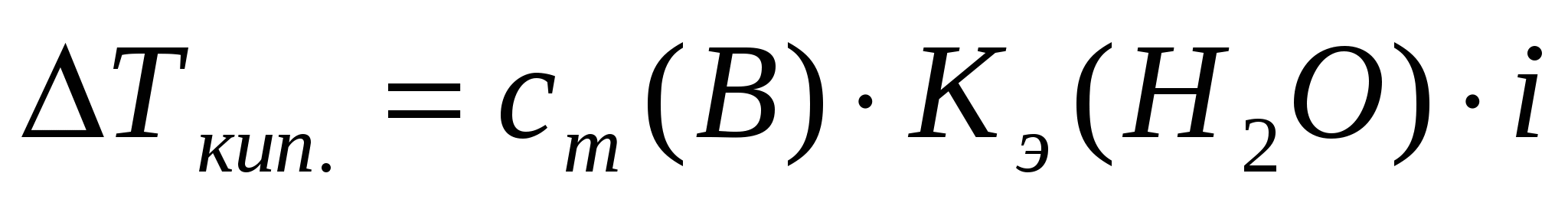
pосм= С×R×T×i,
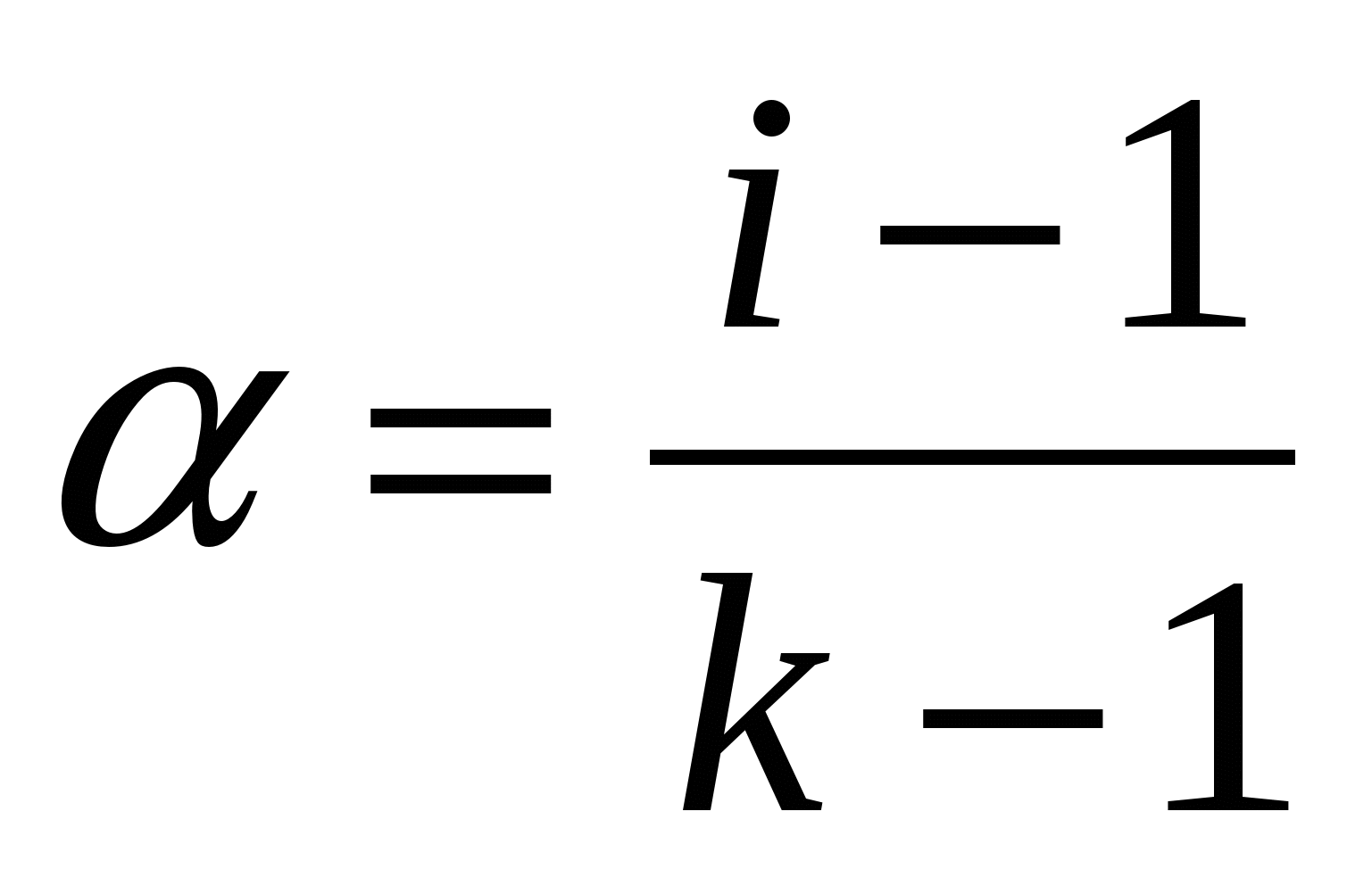
α – степень диссоциации электролита;
k– число частиц, образующихся при диссоциации 1молекулы электролита.
Изотонический коэффициент зависит от степени диссоциации электролита и от природы электролита.
Причиной отклонения от коллигативных свойств растворов для электролитов от растворов неэлектролитов является диссоциация электролитов.
Дата добавления: 2020-04-25; просмотров: 879; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
