Химическое равновесие в гетерогенных системах. Закон действующих для гетерогенного химического равновесия.
При протекании гетерогенных химических реакций реагенты могут находиться в различных фазах. Например, при термическом разложении карбоната кальция по уравнению CaCO3(тв)= CaO(тв) + CO2(г)
CaCO3 и CaO образуют две твердые фазы, а CO2- газовую фазу.
Если гетерогенная реакция протекает при постоянной температуре в закрытой системе, то в ней рано или поздно будет достигнуто состояние химического равновесия.
ЗДМ для гетерогенных систем: в выражениях для констант химического равновесия фигурируют: для газообразных реагентов- равновесные фугитивности (летучести), парциальные давления, концентрации; для твердых, жидких реагентов, растворенных веществ и растворителей- равновесные активности и концентрации. Равновесные активности чистых твердых и чистых жидких веществ- постоянные величины (обычно принимаемые равными их мольным долям- единице).
Химическое сродство. Стандартный потенциал Гиббса как мера химического сродства.
Химическое сродство — способность каждого простого тела соединяться с другими элементами и образовывать с ними сложные тела, в большей или меньшей степени склонные давать новые, сложнейшие соединения, составляет основной характер каждого элемента.
Движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS). При р = const и Т = const общую движущую силу процесса, которую обозначают 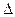 G, можно найти из соотношения ∆G=(H2-H1)-(TS2-TS1); ∆G=∆H-T∆S, где: величина G называется изобарно-изотермическим потенциалом или энергией Гиббса.
G, можно найти из соотношения ∆G=(H2-H1)-(TS2-TS1); ∆G=∆H-T∆S, где: величина G называется изобарно-изотермическим потенциалом или энергией Гиббса.
|
|
|
Мерой химического сродства является убыль энергии Гиббса , которая зависит от природы вещества, его количества и температуры.
Энергия Гиббса является функцией состояния, поэтому
∆Gx.p.=∑ ∆Goбpпрод-∑∆Goбpисх
Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения 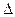 G. Если
G. Если 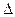 G < 0, процесс принципиально осуществим; если
G < 0, процесс принципиально осуществим; если 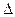 G>0, процесс самопроизвольно проходить не может. Чем меньше
G>0, процесс самопроизвольно проходить не может. Чем меньше 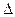 G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором
G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором 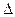 G = 0 и
G = 0 и 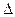 H= T
H= T 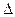 S. Из соотношения
S. Из соотношения 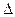 G =
G = 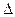 H – T
H – T 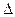 S видно, что самопроизвольно могут протекать и процессы, для которых
S видно, что самопроизвольно могут протекать и процессы, для которых 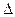 H>0 (эндотермические). Это возможно, когда
H>0 (эндотермические). Это возможно, когда 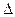 S>0, но |T
S>0, но |T 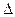 S| > |
S| > | 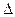 H| и тогда
H| и тогда 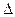 G<0. С другой стороны, экзотермические реакции (
G<0. С другой стороны, экзотермические реакции ( 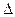 H<0) самопроизвольно не протекают, если при
H<0) самопроизвольно не протекают, если при 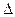 S<0 окажется, что
S<0 окажется, что 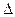 G>0.
G>0.
ВМС
1. Понятие о ВМС. Значения их молекулярных масс. Классификация полимеров по происхождению, примеры. Биополимеры.
ВМС – вещества, состоящие из макромолекул (молекулы, содержащие 1000 и более химически связанных атомов), с массой 104<М<106.
|
|
|
Полимеры – соединения, у которых макромолекулы построены из регулярных, структурных, элементарных звеньев – мономеров.
Классификация полимеров:
А) природные – встречающиеся в природе биополимеры (натуральный каучук, крахмал, целлюлоза)
Б) искусственные (модифицированные) – дополнительно измененные природные полимеры (резина)
В) синтетические – полимеры, полученные методом синтеза (капрон, лавсан, синтетический каучук)
Биополиме́ры — класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин.
2. Типы пространственной структуры полимеров (примеры полимеров). Понятие о конформациях макромолекул ВМС.
А) линейные – химически не связанные одиночные цепи мономерных звеньев (каучук, желатин, целлюлоза)
Б) разветвленные – крахмал, гликоген
В) лестничные – целлюлозные и искусственные волокна
Г) – сетчатые (сшитые) – бывают 2х-мерные, 3х-мерные
Конформации – энергетические равноценные пространственные формы, возникающие при повороте мономерных звеньев полимерных цепей без разрыва химической связи.
3. Сравнение растворов полимеров и гидрофобных коллоидных растворов.
|
|
|
Растворы ВМС- самопроизвольно образующиеся гомогенные, однофазные, термодинамически устойчивые и обратимые, не нуждающиеся в стабилизаторе истинные растворы. Растворы коллоидов-золи.
| Характеристика | ВМС | Коллоиды |
| Размер | Больше 100 ммк | 1-100 ммк |
| Гидрофильность | + | - |
| Устойчивость | + | +- |
| Поверхность раздела | - | + |
| Набухание | + | - |
| Вязкость | Высокая | Низкая |
| Конус Тиндаля | размытый | Четкий |
4. Набухание полимеров. Степень набухания. От каких факторов зависит степень набухания полимера?
Увеличение объема и массы ВМС вследствие поглощения им растворителя. Количественно измеряется степенью набухания
α=(m-m0)*100%/m0 или α=(V-V0)*100%/V0
факторы, влияющие на величину набухания:
• Температура
• Степень измельчения полимера
• Возраст полимера
• Ионы электролитов
• Реакция среды
• Природа полимера и растворителя («подобное растворяется в подобном»…)
5. Механизм набухания
Первая стадия – за счет сольватации полярных групп ВМС молекулами растворителя (поглощение 20-50% растворителя от массы полимера)
Вторая стадия – за счет осмотического всасывания растворителя, которое возникает благодаря односторонней диффузии растворителя в полимер
|
|
|
6. Влияние природы веществ на набухание. Классификация полимеров о способности к набуханию, примеры. Графическое отображение кинетики набухания полимеров с различной способностью к набуханию.
Классификация полимеров по способности к набуханию.
• Неограниченно набухающие – набухание идет до полного растворения полимера (полимеры линейного характера)
• Ограниченно набухающие – растворения не происходит, но имеет место увеличение массы (полимеры с сетчатой структурой)
• Не испытывающие набухания
Полимеры из сферических макромолекул растворяются без набухания (гемоглобин, гликоген)
7. Влияние температуры на набухание
При повышении температуры скорость набухания увеличивается, а степень предельного набухания уменьшается. Это хорошо согласуется с принципом Ле-Шателье (процесс набухания экзотермичен)
8. Возможные механизмы влияния электролитов на набухание.
Чем слабее ион гидратирован, тем сильнее процесс набухания. Действие ионов на набухание связано с дегидратацией молекул ВМС.
9. Лиотропный ряд (обращенный ряд Гофмейстера):
Ba2+ > Sr2+ > Ca2+ > Mg2+ > Cs+ > Rb+ > K+ > Na+ > Li+ – катионов
CNS- > J- > Br- > NO3- > Cl- > [ацетат]- > [тартрат]2- > [цитрат]3- > F- > SO42- – анионов
Анионы до хлора хорошо адсорбируются на полимерах
10. Влияние рН среды на набухание
В кислой или щелочной среде :
• В результате адсорбции Н+ и ОН- появление на макромолекулах избыточного положительного или отрицательного заряда
• Повышение степени гидратации макромолекул
• Увеличение электростатических сил отталкивания и нарушение целостности структуры полимера
11. Давление набухания, значение явления
Давление набухания- Давление, которое оказывает набухающий полимер на ограничивающие его пористые стенки, проницаемые для растворителя
Имеет место:
• При отеке тканей
• При прорастании зерен
• При разрушении твердых горных пород корнями растений
• Использование в анатомических музеях для расчленения костей черепа
12. Коацервация – слияние водных оболочек нескольких частиц без объединения самих частичек (используется при микрокапсулировании лекарств)
13. Высаливание ВМС, значение процесса. Схема Кройта.
Высаливание – осаждение ВМС в концентрированных растворах электролитов. Механизм высаливания. Заключается в понижении растворимости ВМС в концентрированных растворах электролитов
• Малые концентрации солей – осаждение наиболее крупных, тяжелых и обладающих наименьшим зарядом
• При повышении концентрации солей – осаждение более мелких и устойчивых белковых фракций
14. Понятие о вязкости. Чем объясняется аномальная вязкость растворов полимеров?
Вязкость-сопротивление жидкости при перемещении одной ее части относительно другой
Ламинарное течение характеризуется двумя законами: Ньютона и Пуазейля.
15. График от концентрации
Зависимость вязкости от концентрации. Аномальная вязкость растворов ВМС:
• Большие размеры цепных молекул
• Способность молекул менять конфигурацию и сцепляться друг с другом
• Уменьшение количества свободного растворителя
16. График от давления
Зависимость вязкости от давления. I : Хаотично расположенные молекулы с повышением давления ориентируются вдоль слоев жидкости
• II : Ориентация молекул завершена
• III : Возрастание вязкости связано с переходом в турбулентный режим
17. Определение молекулярной массы полимера вискозиметрическим методом с помощью уравнения Штаудингера
способы выражения вязкости: Относительная
ηотн = η/η 0
• Удельная
ηуд = (η – η0)/ η0 =( η–η0)-1
• Приведенная вязкость (число вязкости)
ηпривед = ηуд / С
• Характеристическая вязкость (предельное число вязкости)
lim (ηуд / С) = [η]; при С стремящ. 0
Уравнение Штаудингера. Зависимость вязкости раствора ВМС от его концентрации и молекулярного веса
[η] = К·Мα
К – постоянная для данного полимергомологического ряда
α – отражает зависимость вязкости от формы макромолекул (½ <=α <= 1)
М – молекулярный вес
С ростом температуры вязкость растворов ВМС быстро падает
18. Вязкость плазмы и цельной крови. Факторы, влияющие на вязкость крови.
| Жидкость | |
| Вода | 0,00101 |
| Плазма крови | 0,00150 |
| Цельная кровь | 0,00400 |
Факторы, влияющие на вязкость крови:
• Концентрация
• Температура
• Давление
• Размер частиц
19. Понятие о студне. Способы получения студней
Студни(гели)- Твердообразные нетекучие структурированные системы, возникающие в результате действия молекулярных сил сцепления между макромолекулами полимеров
Получение:
• Из растворов ВМС
• При набухании полимеров (столярный клей, сухой желатин, крахмал)
• В результате реакций полимеризации и конденсации (получение пластмасс, каучука)
• Под воздействием ферментативных процессов (простокваша, кефир, сыр)
20. Механизм процесса застудневания. Факторы, влияющие на застудневание.
механизм застудневания:
• В молекуле ВМС различают гидрофильные (-OH, -COOH, -NH2, -SH) и гидрофобные (-CH-, -CH2-) участки
• Макромолекулы соединяются между собой гидрофобными участками
• Связи образуются за счет взаимодействия полярных групп макромолекул
• Взаимодействуя между собой, макромолекулы образуют ячеистое строение студня
Факторы, влияющие на застудневание:
• Концентрация
• Природа веществ
• Температура
• Время процесса
• Форма частиц
• Электролиты
Реакция среды
21. Период созревания студня. Влияние концентрации и температуры на застудневание.
Период созревания – время, необходимое для образования ячеистой объемной сетки (от нескольких минут до нескольких недель)
Растворы соединений, имеющих нитевидные или лентообразные частицы, хорошо застудневают.
Увеличение концентрации и понижение температуры приводят к застудневанию
22. Влияние электролитов и рН среды на застудневание. Прямой лиотропный ряд Гофмейстера
На растворение влияют главным образом анионы:
А) ускоряют застудневание ( соли серной и уксусной кислот)
Б) замедляют (хлориды и иодиды)
В) приостанавливают (роданиды)
Сульфат-цитрат-тартат-ацетат-хлор-нитрат-бром-иод-CNS
Реакция среды: Заряд белка зависит от реакции среды: от соотношения количетсва СООН и NH2 групп
23. Явление синерезиса и тиксотропии в студнях
Тиксотропия – обратное превращение студня в раствор и наоборот
Синерезис – процесс самопроизвольного расслаивания в студнях
А) секреция желез
Б) образование патологических опухолей
В) старение организма
Скорость синерезиса увеличивается с повышением температуры и увеличением концентрации
24. Особенности диффузии в студнях. Периодические реакции в студнях, примеры
· Диффузия макромолекул затруднена
· Диффузия НМС
· Отсутствие перемешивания и конвенции
· Реакции осаждения
· Явление слоистости у минералов (яшма, агат)
· Желчные и почечные камни
ДИСПЕРСНЫЕ СИСТЕМЫ. ЛИОФОБНЫЕ КОЛЛОИДНЫЕ РАСТВОРЫ (ЗОЛИ)
1) дисперсная система, дисперсная фаза, дисперсионная среда.
дисперсная система:
Дисперсионная среда – растворитель, в котором распределено вещество в раздробленном состоянии
Дисперсная фаза – раздробленное вещество
Между дисперсной фазой и дисперсионной средой существует поверхность раздела
2) Понятие о степени дисперсности.
для характеристики раздробленности дисперсной фазы советский физико-химик А.В.Думанский ввел понятие степень дисперсности , которая измеряется величиной, обратной среднему диаметру, или для несферических частиц величиной, обратной среднему эквивалентному диаметру
3) Классификация дисперсных систем по степени дисперсности.
Грубодисперсные (больше 10-7м). Быстро оседают, видимы в микроскоп, остаются на бумажном фильтре, неустойчивы (суспензии, эмульсии, взвеси)
Коллоидно-дисперсные (10-7-10-9м). Относительно устойчивы
Молекулярно- и ионно-дисперсные. Гомогенны, устойчивы (истинные растворы)
4) Сравнительная характеристика дисперсных систем с различной степенью дисперсности.
Грубодисперсные: размер частицы дисперсной фазы >10-7м. степень дисперсности <107. Коллоидно-дисперсные системы: размер частицы дисперсной фазы 10-7-10-9. Степень дисперсности 107-109.
5) Классификация дисперсных систем по агрегатному состоянию фаз. Примеры.
Газ(воздух, туман, пыль), жидкость(пена, эмульсия), ТВ тело( пенопласт, сплавы).
6)Классификация систем по характеру взаимодействия дисперсной фазы с дисперсионной средой.
дисперсная фаза + дисперсионная среда= пример.
Газ+газ=воздуз
Газ+жидкость=пар
Газ+ТВ=пыль
Жидкость+газ=пена
Жидкость+жид=эмульсия
Жидкость+ТВ=суспензии
ТВ+газ=ТВ пена
ТВ+ж=ТВ эмульсия
ТВ+ТВ=сплав
7) Условия получения веществ в коллоидном состоянии
Дисперсная фаза должна обладать плохой растворимостью
Размеры диспергируемого вещества должны быть доведены до размеров коллоидных частиц (10-7-10-9м)
Необходимы стабилизаторы, которые на поверхности раздела фаз образуют ионный или молекулярный слой и гидратную оболочку
8) Дисперсионные методы получения коллоидных систем.
Дисперсионные методы – дробление вещества до коллоидной степени дисперсности:
Механические (шаровые и коллоидные мельницы, ступка) – диспергирование с добавлением стабилизаторов
Ультразвуковые – диспергирование частиц под действием сжатий и расширений
9) Получение коллоидных растворов методом физической конденсации.
Конденсационные методы – укрупнение молекул и ионов до размеров коллоидных частиц. Основой физической конденсации явл физическое воздействие. Для получения золя исп метод замены р-ля. Вначале готовят истинный раствор в-ва в летучем р-ле и добавляют к жидкости, в кот в-во нерастворимо. Летучий р-ль удаляют нагреванием. В рез-те происходит резкое понижение р-ти. М. в-ва конденсируются в частицы коллоидных размеров и образ коллоидный р-р.
10) Методы химической конденсации в получении коллоидных растворов.
Окисление
2H2S + O2 = 2H2O + 2S
Восстановление
Ag2O + H2 = 2Ag0 + H2O
Реакции обмена
BaCl2 + K2SO4 = BaSO4 + 2KCl
Гидролиз
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
Fe(OH)3 + HCl = FeOCl + 2H2O
FeOCl =FeO+ + Cl-
Нейтрализация
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Замена растворителя
При вливании спиртовых растворов серы, канифоли, в воду, в которой эти вещества плохо растворимы, они начинают конденсироваться в частицы коллоидных размеров и могут находиться во взвешенном состоянии
11) Получение коллоидных растворов пептизацией.
Пептизация – процесс перехода вещества из осадка в золь при добавлении диспергирующих веществ (Al(OH)3, Fe(OH)3 + электролит)
12) Способы очистки коллоидных растворов от примесей.
Диализ – основан на способности животных и растительных мембран пропускать ионы и задерживать коллоидные частицы (медленный)
Электродиализ
Компенсационный диализ (вивидиализ)
Ультрафильтрация
Гельфильтрация
Седиментация
13) Сущность диализа, электродиализа.
Диализ – основан на способности животных и растительных мембран пропускать ионы и задерживать коллоидные частицы (медленный)
14) Особенности и применение компенсационного диализа,вивидиализа. Компенсационный диализ применяют, когда необходимо освободить к/р-р лишь от части низкомолекулярных примесей. В диализаторе р-ль зам р-ры Нмс, которые необходимо остановить в к/р-ре. На принципе вивидиализа основано действие искусственной почки. Диализирующий р-р содержит в одинаковых с кровью концентрациях в-ва, кот необходимо сохранить в крови.
15) Сущность и цели ультрафильтрации дисперсных систем.
Ультрафитрация прим для очистки систем, содержащих частицы коллоидных размеров. В основе метода лежит продавливание разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы низкомолекулярных в-в.
16) Седиментация. От каких факторов зависит скорость седиментации частиц дисперсных систем?
седиментация это оседание частиц дисперсной фазы под действием различных сил. Зависит от радиуса частицы, разности плотностей дисперсной фазы и среды, вязкости. Определение скорости оседания положено в основу седиментационного анализа, опред размер частиц и их фракционный состав. Седиментация исп для качественной оценки функционального состояния эритроцитов.
17) Седиментационный анализ.Сущность и назначение ультрацентрифугирования дисперсных систем.
сед анализ прим для:
Определение размера и фракционного состава частиц (число частиц разного размера)
Определение молекулярного веса полимерных материалов, белков, нуклеиновых кислот
Качественная оценка функционального состояния эритроцитов. СОЭ значительно меняется при различных заболеваниях
18) Броуновское движение. Факторы, влияющие на его интенсивность.
Присуще частицам с размерами не более 10-6м
Не зависит от природы вещества
Обусловлено тепловым движением молекул
Изменяется в зависимости от температуры, вязкости среды и размеров частиц
19) Уравнение Эйнштейна-Смолуховского для броуновского движения. (в лекции есть!)
20) Диффузия в коллоидных системах. Скорость диффузии.
Диффузия- это самопроизвольный процесс выравнивания концентраций частиц по всему объему системы; причина его хаотического движения частиц- это одно из проявлений 2 закона ТД, идет в сторону увеличения энтропии. Диффузия идет в любых системах, но в коллоидных системах отличается лишь скоростью.
Закон Фика для диффузии:
Скорость диффузии в случае коллоидных растворов меньше, чем в истинных.
21) Характеристика осмотического давления коллоидных систем.
Осмотическое давление коллоидных растворов подчиняется закону Вант-Гоффа
?осм = КБ · СV · T
СV – частичная концентрация. Cv=mдф/mч*V
Как правило, в 1 000 раз меньше осмотического давления истинных растворов
22) Светорассеяние в дисперсных системах. Уравнение Рэлея, анализ уравнения.
Закон Релея
Светорассеяние- это явление которое выражается в том, что каждая частица является как бы вторичным источником света, свет подвергается дифракции и огибает каждую частицу. Выражается оно в том, что наблюдается опалесценция- матовое свечение чаще всего голубоватых оттенков.
Уравнение Рэлея:
Интенсивность рассеянного света прямо пропорционально числу частиц, квадрату объема частиц и обратно пропорционально 4 степени длины волны.
Анализ уравнения:
23) Опалесценция. Эффект Фарадея-Тиндаля.
Опалесценция – некоторая мутность раствора при рассмотрении его в отраженном свете; явление рассеяния света мельчайшими частицами
Дихроизм
Зависит:
От природы вещества (поглощение света)
От степени дисперсности
Окраска драгоценных камней (рубинов, изумрудов, сапфиров)
Грубодисперсные золи золота – синяя окраска
Большей степени дисперсности – фиолетовая
Высокодисперсные золи – ярко красная
24) Факторы, влияющие на окраску золей.
на окраску золей влияют длина волны падающего света, поглощение света, частичная концентрация, радиус частиц, вязкость.
25) Сущность ультрамикроскопии. Применение ультрамикроскопи для изучения свойств дисперсных систем.
ультрамикроскопия:
Определение массы и объема коллоидной частицы
Исследование сыворотки и плазмы крови
Исследование инъекционных растворов
Определение чистоты воды и других сред
Форма частиц
26) Прямые электрокинетические явления: электрофорез и электроосмос (сущность явлений).
Электрофорез – движение коллоидных частиц в электрическом поле к противоположно заряженному электроду
Электроосмос – перемещение дисперсионной среды к электроду под влиянием внешней разности потенциалов
27) Практическое применение электрофореза.
В технике и различных производствах:
Фарфоровое дело
Очистка воздуха
Покрытие изделий защитными пленками
В клинической практике:
Местное введение лекарственных форм
Электрофоретическое разделение белков по отдельным фракциям
Исследование нормальных и патологических сывороток, нуклеопротеидов, чистых белков и их смесей
28)Обратные электрокинетические явления: потенциал седиментации и потенциал протекания. обратные кинетические явления:
Смещение заряженной частицы по отношения к дисперсионной среде вызывает потенциал оседания (эффект Дорна)
При течении жидкости происходит смещение жидкой фазы по отношению к твердой и на концах капилляра возникает потенциал (эффект Квинке)
29) Понятие об электротермодинамическом и электрокинетическом потенциалах,их возникновение в коллоидных системах.
Электрокинетический потенциал (?) – заряд гранулы – важнейшая характеристика коллоидных растворов, влияющая на их устойчивость. Разность потенциалов между дисперсной фазой и дисперсной средой – электродинамический потенциал(?).
30) Уравнение Гельмгольца-Смолуховского для электрокинетического потенциала(дзета-потенциала).
Расчет скорости движения коллоидных частиц в электрическом поле (U):
U =Не?/4??
U – скорость движения частицы
Н – напряженность электрического поля
е – диэлектрическая проницаемость среды
? – вязкость среды
31) Строение мицелл гидрофобных золей (покажите на конкретном примере и напишите мицеллярную формулу).
Внутренняя нейтральная часть содержит большую часть массы частицы. Внешний ионный слой (оболочка), в которой выделяют 2 слоя: адсорбционный и диффузный. Строение коллоидной частицы зависит от способа поучения.
Получение коллоидного раствора реакцией осаждения:
KJ + AgNO3 = AgJ + KNO3
Молекулы AgJ объединяются в более крупные частицы- агрегаты.
J- потенциалопределяющие ионы. Совокупность их зарядов формирует электротермодинамический потенциал.
Агрегат + потенциалопределяющие ионы = ядро частицы.
Противоины- это ионы противоположного знака (К+)
Потенциалопределяющие ионы + большая часть противоинов = адсорбционный слой. Остальная часть противоинов- диффузный слой.
Агрегат + адсорбционный слой = гранула (имеет заряд)
Гранула + диффузный слой = мицелла (электронейтральна)
Электрокинетический потенциал (дзета)- заряд гранулы- важнейшая характеристика коллоидных растворов влияющая на их устойчивость.
Мицеллярная формула:
32) Объясните влияние температуры на величину дзета-потенциала (заряд гранулы) дисперсных систем.
Температура (часть ионов из адсорбционного слоя выйдет в диффузный в результате теплового движения - ?-потенциал увеличивается)
33) Объясните влияние разбавления на величину дзета-потенциала (заряд гранулы) дисперсных систем.
Добавление к коллоидному раствору электролитов (сжимают диффузный слой, часть ионов из него переходит в адсорбционный и ?-потенциал уменьшается)
Чем больше полярность растворителя, тем больше ?-потенциал
34) Объясните влияние рН среды на величину дзета-потенциала (заряд гранулы) дисперсных систем.
рН среды (и Н+ и ОН- хорошо адсорбируются на коллоидных частицах)
35) Понятие о кинетической устойчивости коллоидных растворов. Факторы, обусловливающие кинетическую устойчивость.
Способность дисперсных частиц удерживаться во взвешенном состоянии под влиянием броуновского движения и противостоять действию сил тяжести
Факторы кинетической устойчивости:
Броуновское движение
Степень дисперсности
Вязкость дисперсионной среды
Разность плотностей фазы и среды
36) Понятие об агрегативной устойчивости коллоидных растворов.Факторы, обусловливающие агрегативную устойчивость.
Способность частиц дисперсной фазы поддерживать определенную степень дисперсности (препятствовать образованию агрегатов)
Факторы агрегативной устойчивости:
Заряд частиц
Сольватная оболочка
Температура
37)Понятие о старении и коагуляции коллоидных растворов. Факторы, вызывающие коагуляцию.
Процесс объединения частиц в более крупные агрегаты
Скорость коагуляции тем больше, чем меньше ? - потенциал (меньше заряд частицы)
Процесс самопроизвольной коагуляции золей – старение . Факторы влияющие на скорость коагуляции: Температура
Концентрация золя
Электрический ток
Лучистая энергия
Добавление электролитов
38) Механизм коагулирующего действия электролитов.
Коагулирующим действием в электролите обладают те ионы, которые имеют заряд, противоположный заряду гранул
Для начала коагуляции необходимо достичь порога коагуляции – некоторой минимальной концентрации электролита (ммоль/л), который нужно добавить к 1л золя, чтобы вызвать его явную коагуляцию. Механизм коагулирующего действия ионов:
Сжатие диффузного слоя противоионов
Избирательная адсорбция ионов
Уменьшение ? - потенциала
Уменьшение расклинивающего действия дисперсионной среды
39) Порог коагуляции, коагулирующая способность электролитов.Правило "значности" Шульце-Гарди для коагуляции золей электролитами.
Для начала коагуляции необходимо достичь порога коагуляции – некоторой минимальной концентрации электролита (ммоль/л), который нужно добавить к 1л золя, чтобы вызвать его явную коагуляцию. Правило значности Шульце Харди: Коагулирующая сила иона тем больше, чем больше его заряд
Коагулирующая способность двухзарядных ионов в десятки раз, а трехзарядных – в сотни раз выше, чем у однозарядных ионов
As2S3 – отрицательно заряженный золь
K+ Ba2+ Al3+
1 : 72 : 540
Fe(OH)3 – положительно заряженный золь
Механизм коагулирующего действия:
Сжатие диффузного слоя противоионов
Избирательная адсорбция ионов
Уменьшение ? - потенциала
Уменьшение расклинивающего действия дисперсионной среды
Коагулирующая способность зависит от:
От способности ионов адсорбироваться на коллоидных частицах
От степени гидратации
40) Лиотропные ряды коагулирующей способности ионов.
Коагулирующая способность зависит от:
От способности ионов адсорбироваться на коллоидных частицах
От степени гидратации
Лиотропные ряды:
Cs+
и т.д.................
Дата добавления: 2020-04-25; просмотров: 363; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
