Расположение молекул ПАВ в поверхностном слое водного раствора.
Строение: Дифильное – разные участки молекулы характеризуются различным отношением к растворителю. Молекулы ПАВ состоят из полярной гидрофобной УВ группы(хвост) и полярной гидрофильной группы(головка).
Изотерма поверхностного натяжения. Сравните изотермы для водных растворов карбоновых кислот.
Графическая зависимость поверхностного натяжения от концентрации растворенного вещества(график).
Применение ПАВ в медицине и в быту.
Получение растворимых форм лекарственных веществ (твины и спаны)
· В качестве антисептиков в хирургии – влияют на проницаемость мембран и на ферментативную активность микробов
· В качестве моющих средств в быту
· Получение эмульсий масла в воде, пеногасителей
Сорбция, адсорбция, абсорбция, сорбент, сорбтив.
Сорбция – поглощение каким-либо веществом других веществ
· Сорбент – вещество, которое поглощает другое
· Сорбтив – поглощаемое вещество
· Адсорбция – процесс поглощения вещества поверхностью сорбента
· Абсорбция – процесс поглощения вещества всем объемом сорбента
Характеристика физической и химической адсорбции.
Физическая – осуществляется за счет сил межмолекулярного притяжения (сил Ван-дер-Ваальса). Теплота: 4-40 кДж/моль. Обратима
· Химическая – кроме сил межмолекулярного притяжения имеет место образование химических связей между сорбтивом и сорбентом. Теплота: 40-400 кДж/моль
|
|
|
Количественное выражение адсорбции на твёрдом и жидком адсорбентах.
Выражается количеством молей вещества (сорбтива), приходящегося на единицу площади (массы) поверхности адсорбента.Г= x/S, Г=x/m
Изотерма адсорбции, её характеристика.
Г∞– предельная адсорбция; наблюдается в случае большой концентрации ПАВ, когда на поверхности раствора образуется сплошной мономолекулярный слой («частокол Ленгмюра») .(график)
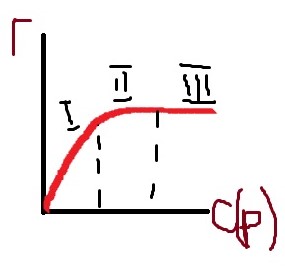
I) Адсорбция прямо пропорциональна концентрации
II) Скорость адсорбции уменьшается, зависимость теряет прямо пропорциональный характер.
III) Скорость адсорбции не увеличивается, величина адсорбции максимальна
От каких факторов и как зависит адсорбция газов жидкими и твёрдыми телами?
· Природа веществ
· Смачивание поверхности
· Величина удельной поверхности
· Температура
· Концентрация и давление пара или газа
Изотерма адсорбции Фрейндлиха, математическое выражение, способ нахождения констант в уравнении.
I– адсорбция прямо пропорциональна концентрации
· II–скорость адсорбции уменьшается, зависимость теряет прямопропорциональный характер
· III– скорость адсорбции не увеличивается, величина адсорбции максимальна(график).
|
|
|
· Г = КФ · С n
· КФ– константа Фрейндлиха
· С – концентрация растворенного вещества или давление газа
· n– константа, характерная для определенного процесса (0,1≤n≤0,6)
· Для нахождения констант – логарифмирование процесса. lgГ =lg КФ · nlgС
| lgГ |
| lgС(p) |
| lgK |
Tg  =n =n
|
Уравнение Фрейндлиха справедливо для средних концентраций адсорбированного вещества. Не соответствует данным опята в области больших и малых концентраций.
Изотерма адсорбции Лэнгмюра, анализ уравнения.
Г=Г∞ *(С/Кл +С). Кл-константа Лэнгмюра.Г-величина адсорбции. Г∞ -предельная адсорбция.
1)При С стр к 0 Г=Г∞ *(С/Кл )-первый участок. (отражает прямо пропорциональную зависимость)
2)При С>> Кл :Г=Г∞ -третий участок.3) нет прямо пропорциональной зависимости-промежуточное значение.
Дата добавления: 2020-04-25; просмотров: 326; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
