Понятие о комбинированных методах: хромато-масс-спектрометрия, хроматоспектрофотометрия.
ГЖХ применяется в сочетании с различными методами анализа с целью идентификации, выяснения химического строения молекул разделяемых компанентов смеси – с ИК спектроскопией, с хромато-масс-спектрометрией.

Жидкостная хроматография, высокоэффективная жидкостная хроматография. Сущность метода. Параметры удерживания. Параметры разделения (степень разделения, коэффициент разделения). Влияние температуры на разделение. Практика метода. Особенности проведения хроматографирования. Методы количественной обработки хроматограмм (абсолютной калибровки, внутренней нормализации, внутреннего стандарта). (Все параметры и т.д. в вопр. 91)
Высокоэффективная жидкостноя хроматография основанная на тех же принципах, что и ГЖХ, но вместо газа носителя в качестве ПФ применяется поток жидкости, не смешивающийся с жидкой НФ. В ВЭЖХ обе фазы – жидкости. Разделение компонентов основано на различии их коэфициентов распределения между НФ и ПФ.
Электрохимические методы анализа. Общие понятия. Классификация электрохимических методов анализа. Методы без наложения и с наложением внешнего потенциала: прямые и косвенные электрохимические методы.
Электрохимические методы – это методы, основанные на использовании процессов, происходящих в электрохимической ячейке (система, состоящая из пары электродов и электролита, контактирующих между собой)
Электрод – граница раздела, на которой электронный механизм переноса заряда меняется на ионный.
|
|
|
Электрод – это проводник электрического тока с электронной проводимостью.
Электролит – среда, в которой происходит перенос заряда в результате направленного движения ионов.
Электрохимические методы:
· Кондуктометрия
· Потенциометрия
· Кулонометрия
· Вольтамперометрия
Электрохимические ячейки:
1.1 Ячейки без жидкостного соединения
1.2 ячейки с жидкостным соединением
2. В зависимости от режима работы:
2.1 гальванический элемент – энергия химической реакции превращается в электрическую (потенциометрия)
2.2 электролитическая ячейка – электрическая энергия, передаваемая извне, преобразуется в химическую (кондуктометрия, кулонометрия, вольтамперометрия)
Электроды:
1. Индикаторный – электрод, на котором происходит электрохимические процессы, приводящие к возникновению аналитического сигнала.
· рабочий – индикаторный электрод, который за время работы оказывает существенное влияние на состав анализируемого раствора.
2. Электрод сравнения – эталон, относительно которого измеряется потенциала индикаторного электрода.
Требования:
· хорошая воспроизводимость,
|
|
|
· стабильность во времени,
· независимость от состава анализируемого раствора, действия электрического тока
Хлорсеребряный электрод, каломельный электрод.
Электрохимические методы:
· Прямые –используются зависимость электрического параметра от концентрации вещества.
· Косвенные – изменение величины электрического параметра, используется для обнаружения КТТ.
Кондуктометрический анализ (кондуктометрия). Принцип метода, основные понятия. Способы определения концентрации по измеряемому параметру. Прямая кондуктометрия. Способы определения концентрации по измеряемому параметру (расчетный метод, метод градуировочного графика).
Кондуктометрия - это метод анализа, основанный на измерении электропроводности анализируемого раствора.
Для измерения проводимости растворов электролитов используют специальные кондуктометрические ячейки.
Кондуктометрические ячейки обычно имеют вид стеклянного колоколообразного сосуда, в дно которого впаяны два параллельных плоских платиновых электрода, площадью приблизительно 1 см2

Удельная электропроводность – это электрическая проводимость слоя электролита, находящегося между сторонами куба с длиной сторон 1 см, численно равная току, проходящему через слой раствора электролита с площадью поперечного сечения 1 см2 при градиенте приложенного электрического потенциала 1 В/см.
|
|
|
Эквивалентная электропроводность - проводимостью раствора, содержащего 1 моль вещества эквивалента и находящегося между двумя параллельными электродами, расстояние между
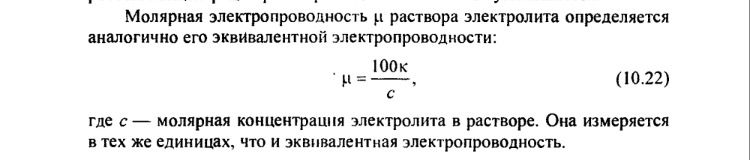 которыми 1 см.
которыми 1 см.

Прямая кондуктометрия (ПК) используют для определения общей концентрации
ионов в растворе.

Дата добавления: 2020-04-25; просмотров: 468; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
