Факторы, определяющие выбор протолитического растворителя.
Необходимо учитывать основные факторы влияющие на полноту протекания реакций кислотно-основного титрования в неводных растворителях. Учет этих факторов заключается, по крайней мере, в следующем.
1) Константа автопротолиза КSH растворителя должна быть как можно меньше. Это следует, в частности, из уравнений, в которых величина КSH является знаменателем. Следовательно, чем меньше KSH, тем больше константа равновесия, К т е. тем выше полнота протекания реакции титрования.
2) Следует учитывать кислотно-основные свойства растворителей. Для титрования оснований пригодны протогенные растворители, а для титрования кислот — протофильные растворители.
3) Предпочтительно применять растворители с высокой диэлектрической проницаемостью.
4) Определяемый (титруемый) протолит должен хорошо растворяться в данном растворителе. Желательно также полное растворение продуктов реакции в используемом растворителе.
5) Для раздельного титрования смеси определяемых веществ следует подбирать растворители с диференцирующим действием.
6) Растворитель не должен вступать в побочные реакции.
7) В практическом плане важно, чтобы растворители были доступными и малотоксичными.
Общая характеристика инструментальных (физико-химических) методов анализа, их классификация, достоинства и недостатки.
Методы основаны на использовании зависимости между измеряемыми физическими свойствами веществ и их качественным и количественным составом.
|
|
|
Классификация основана на учете измеряемых физико-химических свойств веществ:
- Оптические методы основаны на измерении оптических свойств веществ;
- Хроматографические методы основаны на использовании способности различных веществ к избирательной сорбции;
- Электрохимические методы основаны на измерении электрохимических свойств системы;
- Радиометрические методы основаны на измерении радиоактивных свойств веществ;
- Термические методы основаны на измерении тепловых эффектов соответствующих процессов
- Масс-спектрометрические методы основаны на изучении ионизированных фрагментов веществ
| Достоинства: | Недостатки: |
|
|
Оптические методы анализа. Общий принцип метода. Классификация оптических методов анализа (по изучаемым объектам, по характеру взаимодействия электромагнитного излучения с веществом, по используемой области, электромагнитного спектра, по природе энергетических переходов).
|
|
|
Методы основаны на измерении оптических свойств веществ (испускание, поглощение, рассеяние, отражение, преломление, поляризация света), проявляющихся при взаимодействии электромагнитного излучения с веществом.
По изучаемым объектам:атомный и молекулярный спектральный анализ
По характеру взаимодействия электромагнитного излучения с веществом:
- Атомно-абсорбционный анализ – измерение поглощения монохроматического излучения атомами определяемого вещества в газовой фазе после атомизации вещества
- Эмиссионный спектральный анализ – измерение интенсивности света, излучаемого веществом при его энергетическом возбуждении
- Пламенная фотометрия – основана на использовании газового пламени в качестве источника энергетического возбуждения излучения
- Молекульрный абсорбционный анализ – измерение светопоглощения молекулами или ионами изучаемого вещества
- Люминесцентный анализ – измерение интенсивности излучения люминесценции
- Нефелометрический анализ – измерение рассеивания света частицами дисперсной системы
- Турбидиметрический анализ – измерение ослабления интенсивности излучения при его прохождении через дисперсную среду
- Рефрактометрический анализ – измерение показателей светопреломления веществ
- Поляриметрический анализ – измерение угла вращения плоскости поляризации света оптически активными веществами
По области используемого электромагнитного спектра:
|
|
|
- Спектрофотометрия – в ближней УФ области (200-400нм) и в видимой области (400-760нм)
- Инфракрасная спетрофотометрия – в интервале 0,76-1000мкм
По природе энергетических переходов:
- Электронные спектры (УФ и видимая область) – возникают при изменении энергии электронных состояний частиц (атомов, ионов, молекул, радикалов)
- Колебательные спектры (охватывают ИК область) – возникают при изменении энергии колебательных состояний (энергия около положения равновесия) частиц ( двух- и многоатомных ионов, радикалов, молекул, жидких и твердых фаз)
- Вращательные спектры (охватывают дальнюю ИК и микроволновую область) – возникают при изменении энергии вращательных состояний (энергия в пространстве как единого целого) молекул, двух- и многоатомных ионов, радикалов.
|
|
|
Молекулярный спектральный анализ в ультрафиолетовой и видимой области спектра. Сущность метода. Основные законы светопоглощения Бугера. Объединенный закон светопоглощения Бугера—Ламберта—Беера—Бернара. Оптическая плотность и светопропускание , связь между ними. Коэффициент поглощения света и коэффициент погашения — молярный и удельный; связь между молярным коэффициентом погашения и коэффициентом поглощения света.
Метод основан на использовании способности вещества селективно поглощать электромагнитную энергию в видимой и УФ-области спектра – от 185 до 760нм.
Луч света от источника возбуждения проходит через кювету, заполненную анализируемым раствором. При этом часть световой энергии, соответствующая длине волны собственного электронного возбуждения анализируемого вещества, селективно поглощается этим веществом. Свет, прошедший через кювету с раствором, направляется на входную щель спектрофотометра, в котором разлагается на спектр.

· Метод добавок: Сх = Сст(Ах/Ах+ст – Ах)
· Метод одного стандарта: Сх = (СстАх)/Аст
Закон светопоглощения: количество электромагнитного излучения, поглощенного раствором, прямо пропорционально концентрации поглощающих частиц и толщине поглощающего слоя.
lg ( I 0 / I ) = kCl, где  – интенсивность падающего света, I – интенсивность выходящего света, С – концентрация, l – толщина слоя, k – коэф. поглощения.
– интенсивность падающего света, I – интенсивность выходящего света, С – концентрация, l – толщина слоя, k – коэф. поглощения.
Связь оптической плотности и светопропускания:
A = lg ( I 0 / I ); A = - lgT , A- оптическая плотность, T - светопропускание
T = lg(I/I0); T = 10-A
A = εCl, ε – коэфф. погашения
Коэффициент поглощения света k , коэффициент погашения ε.
ε = k/2,3
| Молярный коэфф. погашения ε | Удельный коэфф. погашения Е |
| Если концентрация выражена в моль/л, а толщина слоя в см ε =МЕ/10 | Если концентрация выражена в г/100мл, а толщина слоя в см Е = 10 ε /М |
Рефрактометрия. Сущность метода. Определение концентрации анализируемого раствора: метод градуировочного графика, метод одного стандарта, определение концентрации по измеряемому параметру, метод добавок стандарта.
Метод основан на измерении показателя светопреломления жидкости или кристаллов.
Основной закон светопреломления: n1sinα = n2sinβ, Где n1, n2 – абсолютные показатели преломления относительно вакуума

Следствия:
1. Если луч переходит из менее плотной среды в более плотную, то угол падения будет больше угла преломления (если n1> n2, то sinα < sinβ)
2. Если луч переходит из более плотной среды в менее плотную, то угол падения будет меньше угла преломления (если n1< n2, то sinα > sinβ)
Показатель преломления лежит в диапазоне 1,2 – 1,9 для жидкостей и газов, для твердых веществ до 4,0.

1 - осветительное зеркало; 2 - вспомогательная откидная призма; 3 - основная измерительная призма; 4 - матированная грань откидной призмы; 5 - исследуемая жидкость; 6 - призмы Амичи компенсатора; 7 - объектив зрительной трубы; 8 - поворотная призма; 9 - окуляр зрительной трубы
Определение концентрации:
· Метод градуировочного графика (по y – n, по x – C)
· Метод стандартов: по значению аналитического рефрактометрического фактора F
Сх = ( n 21 – n 0 )/ F , где n 0 – показатель преломления растворителя
F = ( n 2 - n 1 )/ ( Cx 2 – Cx 1 )
Поляриметрия. Сущность метода. Определение концентрации анализируемого раствора: метод градуировочного графика, метод одного стандарта, определение концентрации по измеряемому параметру, метод добавок стандарта.
Метод основан на измерении угла оптического вращения плоскости поляризации монохроматического света при прохождении его через оптически активное вещество. Пропускание линейно поляризованного света через среду оптически активного вещества сопровождается отклонением плоскости его поляризации от ее первоначального положения на некоторый угол α, называемый углом вращения.
Для количественной характеристики способности оптически активных веществ вращать плоскость поляризации света вводят удельное вращение [α], которое определяют как угол вращения плоскости поляризации монохроматического излучения при l = 1 дм и содержании оптически активного вещества 1г/мл.
Измерение проводят на поляриметрах.
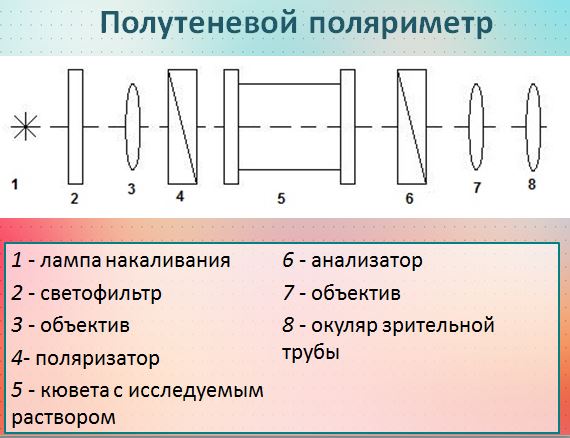
1. Метод градуировочного графика. Для серии стандартных растворов измеряют угол вращения плоскополяризованного света и строят график в координатах α =f (С). График линеен и проходит через начало координат.
2. С = 100α/[α] l l – толщина слоя оптически активной среды
Дата добавления: 2020-04-25; просмотров: 277; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
