Цериметрическое титрование. Сущность метода. Титрант метода, его приготовление, стандартизация. Расчеты результатов титрования.
1)Титрант-соли Се(4),Сe(SO4)2
2)  Условия:сильнокислая среда,Е=1,74 В,fэкв.=1(?)
Условия:сильнокислая среда,Е=1,74 В,fэкв.=1(?)
3)Титрант-вторичный стандарт.
Стандартизация по оксалату натрия:
 Фиксация КТТ:безиндикаторный способ(ферроин,дифениламин)
Фиксация КТТ:безиндикаторный способ(ферроин,дифениламин)
4)Применение метода:определяют олово(2),ртуть(1),сурьма(3),железо(2),иодиды,нитриты.
Комплексиметрическое титрование. Сущность метода. Требования к реакциям в комплексиметрии. Классификация методов Расчеты результатов титрования.
Комплексиметрия-это группа методов анализа, основанных на использовании реакции комплексообразования между определяемым компонентом анализируемого раствора и титрантом.
Требования:
1.Стехиометричность. В реакции должен образовываться 1 продукт точно определенного вещ-ва.
2.Полнота протекания реакции. Она должна протекать не менее чем на 99,99 %.
3.Должна протекать быстро.
4.Должна обеспечивать отчетливую фиксацию КТТ.
Классификация:
- меркуриметрия
- цианометрия
- фторометрия
- комплексонометрия
Комплексонометрическое титрование. Понятие о комплексонатах металлов. Равновесия в водных растворах ЭДТА. Состав и устойчивость комплексонатов металлов. Сущность метода комплексонометрического титрования. Кривые титрования. Титрант метода. Виды (приемы) комплексонометрического титрования (прямое, обратное, заместительное). Расчеты результатов титрования.
Комплексоны-это органические соединения, в молекулах которых содержится большое число основных донорных центров и кислых функциональных групп, расположенных так, что при их взаимодействии образуются комплексонаты.
|
|
|
| Нитрилотриуксусная кислота | Этилендиаминтетрауксусная кислота(ЭДТУК) | Этилендиаминтетраацетат(ЭДТА) | Диаминциклогексантетрауксусная кислота |
| N(CH2COOH)3 | (HOOCCH2)2N-CH2CH-N(CH2COOH)2 | Na2H2Y*2H2O | 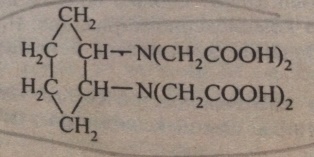
|
| Дентантность=4 | Дентантность=6 | Дентантность=6 | Дентантность=6 |
Комплексон Н4Y-четырехосновная кислота.При pH<1.6 она протонируется:протоны присоединяются к молекуле ЭДТУК,образуя формы H5Y,H6Y.

В водных растворах существуют и находятся в равновесии все формы ЭДТУК,в зависимости от кислотности среды.
Состав и устойчивость комплексонатов:
1.Если в растворе доминирует форма H2Y^2-,то реакции комплексообразования протек по схеме:

2.При образовании комплексоната металла возникают несколько хелатных циклов,поэтому комплексонаты-устойчивые соединения(устойчивость зависит от природы катиона Ме,его заряда,состав комплекса,температуры)
3.Катионы щелочных Ме образуют малостойкие эдетеаты как с Y^4- и c HY^3-
Титрант: стандартные водные растворы ЭДТА.
Прямое титрование: при прямом титровании анализируемого раствора, содержащего определяемый катион металла, стандартным раствором комплексона: к аликвотной части раствора прибавляют буферную смесь для достижения требуемого значения рН раствора, индикатор и титруют стандартным раствором комплексона до изменения окраски титруемого раствора.
|
|
|
Обратное титрование: к анализируемому раствору, содержащему определяемый катион, прибавляют избыточное количество стандартного раствора ЭДТА. После окончания реакции образования комплексоната определяемого катиона избыток не вступившего в реакцию ЭДТА оттитровывают стандартным раствором соли магния, цинка или др катионов в присутствии индикатора.
Заместительное титрование: к раствору, содержащему определяемые катионы металла, срособные образовывать прочные комплексонаты, прибавляют избыток раствора, содержащего менее прочный комплексонат другого металла. Менее прочный комплексонат разрушается с выделением катионов, которые затем оттитровывают стандартным раствором ЭДТА.
Кривые титрования – зависимость концентрации определяемых катионов металла в растворе от количества прибавляемого титранта.
Дата добавления: 2020-04-25; просмотров: 329; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
