ХРОНИЧЕСКАЯ ГЕМОЛИТИЧЕСКАЯ АНЕМИЯ С ПОСТОЯННОЙ ГЕМОСИДЕРИНУРИЕЙ И ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИЕЙ (ПНГ). БОЛЕЗНЬ МАРКИАФАВА
Заболевание является особой формой хронической гемолитической анемии, характеризующейся внутрисосудистым гемолизом. Отличительной особенностью болезни служит постоянное выделение с мочой гемосидерина, а временами и свободного гемоглобина.
Болезнь встречается преимущественно у лиц среднего возраста (20—40 лет). Характеризуется хроническим циклическим течением с наклонностью к обострениям под влиянием различных экзогенных и эндогенных факторов. Наряду с тяжелым течением описаны случаи заболевания, протекающие относительно благоприятно — длительностью до 32 лет. Имеются даже единичные наблюдения выздоровления от болезни Маркиафава.
Клиническая картина. Клиника болезни Маркиафава складывается из проявлений тяжелой гемолитической анемии, постоянной гемосидеринурии с периодическими гемоглобинурийными кризами, гемолитической желтухи и сосудистых тромбозов. Жалобы больных общего характера: слабость, головокружения, одышка, сердцебиения, головные боли и повышенная утомляемость — обусловливаются выраженностью анемии. Другие жалобы: боли в пояснице, абдоминальные боли, темная моча, рвота, озноб, коллапс — связаны с гемоглобинурийными и тромботическими кризами.
Специфическим проявлением болезни Маркиафава является пароксизмальная ночная гемоглобинурия. На этом основании принято обозначать болезнь, как ПНГ. Следует, однако, помнить, что это название отражает лишь наиболее выраженную степень гемолиза, проявляющуюся в виде гемоглобинурийных кризов, частота которых весьма вариабильна. В клинической практике нередко наблюдаются случаи, протекающие с длительными — помногу месяцев — «светлыми» (в буквальном смысле слова) интервалами, когда единственным достоверным клиническим симптомом болезни является почти постоянная гемосидеринурия. Если не учитывать этого обстоятельства, то болезнь будет не распознана в течение длительного времени, до тех пор, пока не выявится типичный пароксизм ночной гемоглобинурии. Поэтому название ПНГ, хотя и отражает весьма яркий момент клинической картины рассматриваемого заболевания, для болезни, отличающейся по существу необычайно длительным, хроническим течением, может быть принято лишь условно, для краткости обозначения.
|
|
|
Генез ночной гемоглобинурии объясняется физиологическим ацидозом, наступающим во время сна, и активацией в ночное время свертывающей и пропердиновой систем крови, провоцирующих гемолиз.
Связь внутрисосудистого гемолиза с состоянием физиологического ацидоза во время сна ярко демонстрируется следующим опытом: если изменить ритм сна и бодрствования, то изменится и ритм выведения кровяных пигментов с мочой — в случае гемолитического криза ночная гемоглобинурия становится дневной.
|
|
|
Из физиологии известно, что гемоглобин, поступающий из распавшихся эритроцитов непосредственно в кровь, соединяется со специфическим белком — носителем из группы a-глобулинов — гаптоглобином. В результате возникает крупномолекулярный комплекс гемоглобин—гаптоглобин (мол. вес 310000), не проходящий через почечный фильтр.
По данным современных исследователей, у здоровых лиц в сосудистом русле распадается около 10% эритроцитов циркулирующей крови. В нормальных условиях в плазме содержится 1—4 мг% гемоглобина.
Физиологическая роль гаптоглобина заключается в связывании этого .небольшого количества гемоглобина, чем предупреждаются потери гемоглобина с мочой и развитие гемосидероза почек. Дальнейший метаболизм гемоглобина плазмы осуществляется в клетках ретикуло-гистиоцитарной системы, главным образом печени, по типу внутриклеточного гемоглобинолиза.
Гемоглобинсвязывающая способность гаптоглобина (при нормальном содержании последнего) такова, что гемоглобин плазмы начинает проходить через почечный фильтр при концентрации, превышающей 135 мг%.
|
|
|
Как показали исследования современных авторов, при болезни Маркиафава отмечается резкое снижение гаптоглобина (гипогаптоглобинемия).
Поэтому у больных ПНГ прохождение гемоглобина в мочу — гемоглобинурия может иметь место и при невысокой концентрации гемоглобина в плазме — не более 30—50 и даже 22 мг% (И. Ф. Корчмару).
Появление в плазме свободного гемоглобина, не связанного гаптоглобином, ведет к прохождению гемоглобина через клубочковый фильтр. Образующийся на уровне эпителия почечных канальцев гемосидерин выделяется с мочой — таков механизм гемосидеринурии как постоянного симптома неинтенсивного внутрисосудистого гемолиза, В моче гемосидерин обнаруживается в виде золотисто-коричневатых зерен и глыбок, обычно включенных в почечные эпителиальные клетки и цилиндры и дающих положительную реакцию на железо при прибавлении железосинеродистого калия и соляной кислоты (образуется берлинская лазурь).
При более значительной степени гемоглобинемии, достигающей 100—150 (в среднем 135) мг%, канальцевая реабсорбция оказывается недостаточной и гемоглобин появляется в моче — возникает гемоглобинурия, свойственная массивному внутрисосудистому распаду крови (рис. 54, а, б, в).
|
|
|
Таким образом, усиление внутрисосудистого гемолиза проявляется вначале повышением гемоглобинемии, затем выделением с мочой гемосидерина и, наконец, гемоглобинурией. Одновременно с гемоглобинурией наблюдается иногда и гематурия, т. е. выделение выщелоченных и поврежденных эритроцитов.
Характерной особенностью болезни Маркиафава является возникновение обострений под влиянием самых различных факторов: (интеркуррентные инфекции, переливания крови, лекарственные препараты — железа, мышьяка, витамины, вакцины, аспирин, хинин, камполон, сода, нитриты): менструации, алкоголь, психическое и физическое переутомление, оперативные вмешательства, пищевые нагрузки (мясо, рыба) и даже прием кортикостероидов (!). Наиболее сильным провоцирующим влиянием обладают инфекции, гемотрансфузии и стимуляторы эритропоэза.
В отличие от пароксизмальной холодовой гемоглобинурии пароксизмальная ночная гемоглобинурия, как правило, не провоцируется холодом.
Гемоглобин распавшихся эритроцитов, не прошедший через почечный фильтр (реабсорбировавшийся на уровне почечных канальцев), подвергается в органах ретикуло-гистиоцитарной системы расщеплению до конечных безжелезистых продуктов — билирубина и уробилина. Результатом этого процесса является развитие желтухи гемолитического типа.
В крови отмечается периодически повышенная непрямая билирубинемия и постоянно — гемоглобинемия. Плейохромия желчи и испражнений выражена в меньшей степени, чем при других гемолитических анемиях, так как выделение пигментов (гемоглобина) происходит преимущественно с мочой. Все эти симптомы усиливаются в периоды гемолитических кризов.

Рис. 54. Патофизиология гемосидеринурии и гемоглобинурии (по Казалю).
а — в нормальных условиях в плазме крови ничтожные следы свободного гемоглобина, не пропускаемые почечным фильтром; б — гемосидеринурия. При гемоглобинемии меньше 1,35 г/л часть гемоглобина, проходящая через почечные клубочки на уровне канальцев, полностью подвергается реабсорбции. В результате возникает гемосидероз эпителия почечных канальцев и в моче появляется гемосидерин; в — гемоглобинурия. При гемоглобинемии выше 1,35 г/л гемоглобин, подвергающийся обратному всасыванию на уровне почечных канальцев, полностью «насыщает» эпителиальные клетки. Излишек гемопобина выделяется с мочой, придавая ей черноватый цвет. Из реабсорбированного на уровне канальцев гемоглобина образуется гемосидерин. Часть его, теряя железо, превращается в билирубин, поступающий в кровь и дающий картину гемолитической желтухи.
В связи с гемоглобинурийными кризами состояние больных резко ухудшается: анемия и желтуха усиливаются, развивается цианоз, больные впадают в коллаптоидное состояние; в редких случаях наступает смертельный исход при явлениях анемической комы в период так называемых арегенераторных кризов. Обычно же вслед за гемоглобинурийным кризом наблюдается регенерация крови и наступает состояние субкомпенсации — анемия и желтуха полностью не исчезают. Вне приступов гемоглобинурии больные бледны и несколько иктеричны.
Спленомегалия нехарактерна для болезни Маркиафава. Лишь на высоте тяжелого гемоглобинурийного криза наблюдается умеренное преходящее увеличение печени и селезенки. В отдельных случаях, осложненных тромбозами в системе воротной и селезеночной вен, отмечается более стойкое увеличение селезенки. Последняя может быть увеличенной и в связи с развитием посттрансфузионного гемосидероза.
Несмотря на постоянное выделение почками гемосидерина, концентрационная и выделительная функции почек в большинстве случаев не нарушаются.
Травматизация мочевых путей продуктами кровяного распада создает благоприятную почву для развития в них инфекции, что в некоторых случаях, при снижении иммунной сопротивляемости организма, может служить причиной развития сепсиса и гибели больных. В других Случаях осложнение болезни пиелонефритом приводит к развитию почечной недостаточности.
Редким осложнением (по данным Г. Б. Берлинера, у 2 из 72 больных) является возникающая на высоте тяжелого гемоглобинурийного криза «гемолитическая почка» с развитием преходящей острой анурии и азотемии.
Более постоянным симптомом является увеличение печени. Возникновение гепатомегалии связано в основном с дистрофическими изменениями, а также с застойными явлениями на почве анемической миокардиодистрофии. Имеют значение и сосудистые тромбозы в системе портальной вены и во внутрипеченочных (центральных, дольковых) и печеночных венах. Известны случаи развития портального цирроза печени, а также синдрома Хиари (на почве тромбоза печеночных вен). В некоторых случаях, реже, чем при других формах гемолитической анемии, болезнь осложняется холелитиазом.
В период гемолитических кризов у больных нередко наблюдаются абдоминальные боли, связанные, по-видимому, с тромбозами мелких сосудов брюшной полости и дающие картину «острого живота», что в некоторых случаях служило поводом к неоправданному оперативному вмешательству.
Реже, чем при других формах гемолитической анемии, наблюдаются трофические язвы нижних конечностей, развивающиеся вследствие тромбозов периферических сосудов.
Опасным осложнением болезни являются тромбозы мозговых сосудов, дающие картину инсульта, иногда с летальным исходом (Ю.И.Лорие, 1964).
Как факт, заслуживающий внимания, следует отметить относительно хорошую переносимость беременности и родов женщинами, больными ПНГ (И. Ф. Корчмару, 1966). Crosby (1953) наблюдал даже уменьшение симптомов гемолиза в последние месяцы беременности.
Картина крови. Имеется выраженная анемия: количество эритроцитов падает до 2 000 000 и ниже. Анемия носит нормохромный или слегка гиперхромный характер за счет макроцитарного сдвига эритроцитов. Средний объем эритроцитов увеличен, ретикулоцитоз в период гемолитических кризов повышен; напротив, в период арегенераторных кризов отмечается ретикулоцитопения.
Эритроциты при ПНГ на обычных препаратах крови, рассматриваемых в оптическом микроскопе, не представляют каких-либо существенных изменений; средний диаметр эритроцитов 7,5—8 мкм, т. е. соответствует нормомакроцитозу.
Осмотическая резистентность эритроцитов перед кризами слегка понижена, а после гемолитического криза, как и при других гемолитических анемиях, может стать повышенной, что свидетельствует о наличии при болезни Маркиафава двух популяций эритроцитов — «старой», менее стойкой, подвергающейся гемолизу, и «новой», более стойкой.
Белая кровь характеризуется лейкопенией, уменьшением количества сегментоядерных нейтрофилов; при инфекционных осложнениях развивается палочкоядерный сдвиг. Количество кровяных пластинок несколько понижено. Сравнительно редко наблюдается выраженная тромбоцитопения, сопровождающаяся кровотечениями.
Более частым осложнением болезни являются сосудистые тромбозы и эмболии, возникающие в связи с тромбированием мелких сосудов стромой гемолизированных эритроцитов. Известное значение имеют повышение свертываемости крови за счет выхода в кровь тромбопластического фактора из гемолизированных эритроцитов (а также тромбоцитов) и угнетение фибринолитической активности плазмы.
При тяжелом и длительном течении заболевания вследствие значительных потерь железа с мочой, достигающих в день 20 мг, что в 10 раз превышает пищевой рацион железа, наступает истощение тканевых запасов железа — развивается гипосидероз. При этом анемия приобретает железодефицитный характер: цветной показатель уменьшается до 0,5—0,6. Уровень железа плазмы вне криза снижается до 14 мг% и меньше (в период криза может наблюдаться временная гиперсидеремия — до 210 мг%). В редких случаях у больных наблюдаются даже pica chlorotica. Железосвязывающая способность плазмы (определяемая по уровню трансферрина) Снижена.
Таким образом, своеобразие обмена железа при ПНГ состоит в том, что, несмотря на постоянный, приобретающий временами характер «кризов» гемолиз, у больных в силу утечки железа из организма («железный диабет»), как правило, гемосидероза органов (за исключением почек) не наблюдается, притом даже в тех случаях, когда производятся многочисленные — до 200 (!) и больше — переливания крови.
Костномозговое кроветворение характеризуется выраженной эритронормобластической гиперплазией. В этом отношении кроветворение при болезни Маркиафава принципиально ничем не отличается от кроветворения при других гемолитических анемиях. Однако длительный хронический характер заболевания и частые пароксизмы гемоглобинурии, предъявляющие повышенные требования к костному мозгу, в конечном итоге приводят к выраженному истощению последнего, что проявляется в развитии панцитопении. Изредка возникают так называемые апластические, вернее арегенераторные, кризы. Костный мозг в этих случаях обнаруживает картину либо изолированной эритробластопении и даже эритробластофтиза (что соответствует понятию «парциальной» аплазии кроветворения), либо тотального миелопареза. При этом резко нарастает анемия, развивается лейкопения и тромбоцитопения; количество ретикулоцитов может снизиться до полного аретикулоцитоза. Нередко развиваются инфекционно-септические агранулоцитарные осложнения и кровоточивость. Острые арегенераторные кризы при ПНГ, как и при других гемолитических анемиях, обратимы. Нарастание числа лейкоцитов и тромбоцитов за несколько дней до появления ретикулоцитов свидетельствует об окончании арегенераторного криза и возобновлении гемопоэза. Костный мозг обычно регенерирует быстро — в этом принципиальное отличие арегенераторных кризов от истинно апластических состояний.
Патологоанатомическая картина. Патологоанатомические изменения характеризуются гемосидерозом почек, что свидетельствует о внутрисосудистой локализации гемолиза. Наиболее интенсивно выражено «ожелезение» эпителия извитых канальцев (табл. 28).
Признаков внепочечного гемосидероза, как правило, не наблюдается.
Известный интерес представляет гистологическое исследование селезенки. В отличие от других форм гемолитической анемии, с преимущественно внутриклеточным распадом эритроцитов, при болезни Маркиафава не отмечается гиперплазии эндотелия синусов и эритрофагоцитоза. Увеличение селезенки, достигающее изредка значительной степени (1000 г—наше наблюдение), происходит за счет множественных сосудистых тромбозов с развитием периваскулярного склероза.
Изменения в печени сводятся к дистрофическим и некробиотическим процессам, связанным с венозными тромбозами и с малокровием.
Этиология и патогенез. В течение ряда лет (с 1946 г.) патогенез болезни Маркиафава (ПНГ), как и большинства приобретенных гемолитических анемий, рассматривался с точки зрения возможной аутоиммунизации организма. Оказалось, однако, что пробы Кумбса при ПНГ, как правило, выпадают отрицательно. Наблюдающиеся в отдельных случаях ПНГ положительные тесты Кумбса (чаще непрямой), так же как обнаружение антилейкоцитарных антител, следует рассматривать как результат изоиммунизации, возникающей в связи с повторными гемотрансфузиями.
Отрицательные результаты иммунологических исследований наряду с неэффективностью кортикостероидной терапии (см. ниже) и спленэктомии позволяют отвергнуть аутоиммунный генез ПНГ.
Не подтвердилось и высказывавшееся некоторыми авторами мнение о возможной связи ПНГ с серологическими особенностями, в частности с резус-принадлежностью больных. Так, И. Ф. Корчмару (1966) среди 35 больных ПНГ обнаружил всего 7 резус-отрицательных, что составляет 20%, т.е. отношение, близкое к статистической величине (16%), полученной при исследовании контрольной группы в 9766 человек (по данным М. А. Умновой и Р. М. Уринсон).

Табл. 28. Болезнь Маркиафава. Значительные отложения гемосидерина в канальцевом аппарате почек. Виден неизмененный почечный клубочек.
Отсутствие семейных форм болезни Маркиафава, в частности отсутствие сочетанных заболеваний у однояйцевых близнецов[6], дало основание рассматривать эритроцитопатию при ПНГ в плане соматической мутации (Dacie), возникающей под влиянием еще неизвестных мутагенных факторов.
Согласно гипотезе Beutler и соавторов, пролиферация патологического клона клеток при ПНГ, подобно хроническому миелолейкозу, может быть обусловлена нарушением со стороны 21-й пары хромосом.
Предпосылкой для данной гипотезы послужили биохимические исследования, выявившие при ПНГ (как при хроническом миелолейкозе) пониженное содержание в лейкоцитах щелочной фосфатазы, продукция которой, как известно, регулируется 21-й парой хромосом. Отсюда родилась идея, что ПНГ представляет собой не первично гемолитическую болезнь, а системное заболевание костного мозга, при котором патологический клон клеток, вступая в «конкуренцию» с нормально функционирующей кроветворной тканью, постепенно ее замещает. На позиции признания первичного поражения кроветворной системы стоит ряд авторов, в том числе Dameshek, рассматривающий ПНГ в качестве панмиелопатии с появлением патологического клона эритроцитов, подвергающихся внутрисосудистому гемолизу.
В последние годы патогенез пароксизмальной ночной гемоглобинурии рассматривается в плане приобретенной эритроцитопатии, при которой патологические эритроциты оказываются повышенно чувствительными по отношению к физиологической гемолитической системе крови. В пользу данного предположения свидетельствуют опыты in vitro (Ham и др.), обнаружившие быструю разрушаемость эритроцитов больных ПНГ в крови здоровых реципиентов. При этом оказалось, что не все эритроциты донора, больного ПНГ, циркулируют в крови реципиента одинаковый срок. На этом основании авторами были выделены две популяции эритроцитов: одна с коротким сроком «жизни», другая — со сроком, приближающимся к нормальному. Наблюдения, проведенные рядом авторов, в частности И. Ф. Корчмару, с эритроцитами больных ПНГ, меченными Cr151, показали, что наряду с эритроцитами, T1/2, которых составляет 21—25 дней (т. е. близко к нормальному), обнаруживается группа («популяция») эритроцитов с чрезвычайно укороченным Т,, составляющим всего от 1—2 (!) до 7—8 дней. Аналогичные данные (Т1/2 = 2—3 дня) получены Brabec и соавторами.
С этими данными согласуются результаты определения осмотической и кислотной резистентности эритроцитов, дающие характерные «двугорбые» кривые с двумя пиками, соответствующими двум популяциям эритроцитов — с повышенной и пониженной стойкостью. Факт существования двух групп («популяций») эритроцитов при ПНГ подтверждается и структурными изменениями эритроцитов, обнаруживаемыми при электронной микроскопии.
Как ни подкупает «клоновая» теория патогенеза ПНГ своей квазиперспективностью — возможностью воздействовать на патологический клеточный клон антиметаболитами, факты свидетельствуют не в ее пользу.
На наш взгляд, существование двух популяций эритроцитов при хроническом, периодически обостряющемся гемолизе — болезни Маркиафава,. равно как при врожденном микросфероцитозе, не означает генетической обусловленности и самостоятельности двух клонов. Речь идет лишь о двух популяциях эритроцитов, возникающих по выходе из костного мозга вторично, в условиях сосудистой циркуляции.
В отличие от болезни Минковского, характеризующейся тем, что в крови циркулируют эритроциты в прегемолитическом состоянии — микросфероциты, — окончательное разрушение которых происходит внесосудисто в клетках ретикулогистиоцитарной системы селезенки, при болезни Маркиафава в крови циркулируют уже гемолизирующиеся эритроциты, находящиеся на последней стадии гемолиза, осуществляемого внутрисосудисто. Естественно, что при последней форме — ПНГ — особенно рельефно должны сказываться биологические различия между «популяцией», т. е. группой более молодых эритроцитов, еще сохранивших свои основные качества — стойкость по отношению к гипотоническим растворам и кислотам и способность удерживать радиоактивный хром (Cr51), и популяцией эритроцитов, уже находящихся в стадии распада.
Концепция Dacie о соматической мутации, ведущей к возникновению патологического клона эритроцитов, не подтверждается и данными изучения кариотипа: ни у одного из больных ПНГ не было обнаружено ни эуплоидии, ни каких-либо других ненормальностей в хромосомной структуре костномозговых клеток.
Ведущиеся на протяжении последних лет (с 1951 г.) исследования с помощью фазово-контрастной и электронной микроскопии, выявили в эритроцитах больных ПНГ изменения, рассматривавшиеся первоначально как специфические для данного заболевания.
Однако, как показали современные электронномикроскопические исследования, субмикроскопические изменения структуры эритроцитов не являются постоянными и строго специфическими для ПНГ и могут быть расценены как изменения, свойственные строме поврежденных эритроцитов. В этом аспекте структурные изменения эритроцитов при ПНГ следует рассматривать не как причину, а, напротив, как следствие внутрисосудистого гемолиза, с наличием в сосудистом русле гемолизированных (или гемолизирующихся) эритроцитов, чьи «тени» в силу своеобразных условий внутрисосудистого гемолиза отличаются от артефициально гемолизированных (дистиллированной водой) эритроцитов своей пятнистой, как бы «гранулированной» стромой.
Доказательством этого положения могут служить новейшие электронномикроскопические исследования Jean и соавторов (1965). Изучая ультраструктуру эритроцитов больных ПНГ и, в качестве контроля, эритроцитов здоровых лиц, авторы получили следующие результаты: ультраструктуры эритроцитов здоровых лиц и больных ПНГ вне гемолиза не обнаруживают каких-либо существенных отличий. Зато эритроциты больных ПНГ, подвергнутые инкубации в условиях кислотного теста Хэма (см. ниже), отличаются от эритроцитов, взятых у здоровых лиц и обработанных тем же способом, наличием грубой пятнистости в виде коагулированных хлопьев. Более того, оказалось, что совершенно идентичная пятнистость обнаруживается в эритроцитах больных пароксизмальной холодовой гемоглобинурией (ПХГ), предварительно подвергнутых воздействию двухфазных холодовых гемолизинов Доната—Ландштейнера.
Из этих исследований следует вывод, что грубая грануляция (пятнистость), обнаруживаемая в строме эритроцитов при ПНГ (равно как при ПХГ), неспецифична; она свидетельствует лишь об однотипных особенностях внутрисосудистого патологического гемолиза.
Многие авторы, начиная с Audkore и Hartmann, придают патогенетическое значение обнаруженному у больных ПНГ понижению ацетил-холинэстеразной активности (АХЭ) эритроцитов. Полагают, что этот энзим обеспечивает нормальную проницаемость мембраны эритроцитов. Со снижением активности АХЭ в эритроцитах нарушается их проницаемость.
Понижение активности АХЭ при болезни Маркиафава является почти постоянным симптомом, отмечаемым у подавляющего большинства больных, особенно в период обострения болезни. В период ремиссии активность АХЭ нормальная (по данным Г. Б. Берлинера).
Значение ацетил-холинэстеразной активности эритроцитов определяется ее отношением к возрасту эритроцитов: известно, что в обычных условиях с «постарением» эритроцитов (или их преждевременной «прогерией») активность АХЭ снижается.
По данным некоторых авторов (Auditore и Hartmann), содержание АХЭ при ПНГ понижено и в костномозговых эритробластах.
Как показали современные исследования, понижение ацетил-холинэстеразной активности эритроцитов не является строго специфическим признаком болезни Маркиафава — оно может быть и при других гемолитических процессах: при врожденной гемолитической анемии, гемолитической болезни новорожденных (связанной с изосенсибилизацией в системе АВО), аутоиммунном гемолизе и даже при пернициозной анемии в стадии обострения.
Исследования Metz и соавторов показали, что блокада АХЭ при помощи октаметилпирофосфамида не влияет на продолжительность «жизни» нормальных эритроцитов. Таким образом, между активностью АХЭ в эритроцитах и их устойчивостью не обнаруживается корреляции. На основании этих данных высказывается мнение, что повышенный гемолиз при ПНГ не стоит в каузальной связи со снижением активности АХЭ в эритроцитах.
Другие ферменты в эритроцитах не обнаруживают особых отклонений: кислая фосфатаза в нормальных пределах; уровень аденозинтрифосфата (АТФ), аденозиндифосфата (АДФ) в части случаев лишь слегка снижен. Содержание редуцированного глютатиона, по одним данным, слегка повышено, по другим данным, слегка понижено. Активность дегидрогеназы глюкозо-6-фосфата (ДГ6Ф) не понижена, а по некоторым наблюдениям даже повышена. Не обнаруживается каких-либо характерных изменений в содержании сульфгидрильных (SH) групп в эритробластах и эритроцитах.
Подытоживая все эти данные, следует прийти к выводу, что характер энзиматического дефекта при болезни Маркиафава до настоящего времени остается неясным. Полагают, что имеется повреждение не одного, а целого комплекса ферментов — протеинов стромы эритроцитов, а также системы поверхностных (мембранных) энзимов и липидов.
С 1955 г. внимание исследователей было привлечено тем фактом, что лизис патологически измененных эритроцитов при ПНГ усиливается в присутствии выделенного Pillemer и его группой из свежей плазмы человека пропердина — иммунного, противоинфекционного фактора, вступающего во взаимодействие с третьей фракцией (С3) комплемента, а также ионов магния (Mg2+). Показано, что с удалением пропердина или комплемента из плазмы, последняя теряет свои литические свойства, напротив, добавление очищенного пропердина полностью восстанавливает гемолитические свойства по отношению к эритроцитам больного ПНГ. Гемолиз неполноценных эритроцитов при ПНГ осуществляется третьим компонентом комплемента (С3) путем непосредственной адсорбции пропердина стромой патологически измененных эритроцитов. В аспекте этих данных получает объяснение провоцирующее ПНГ влияние интеркуррентной или присоединяющейся к заболеванию инфекции, при которой содержание в крови пропердина возрастает.
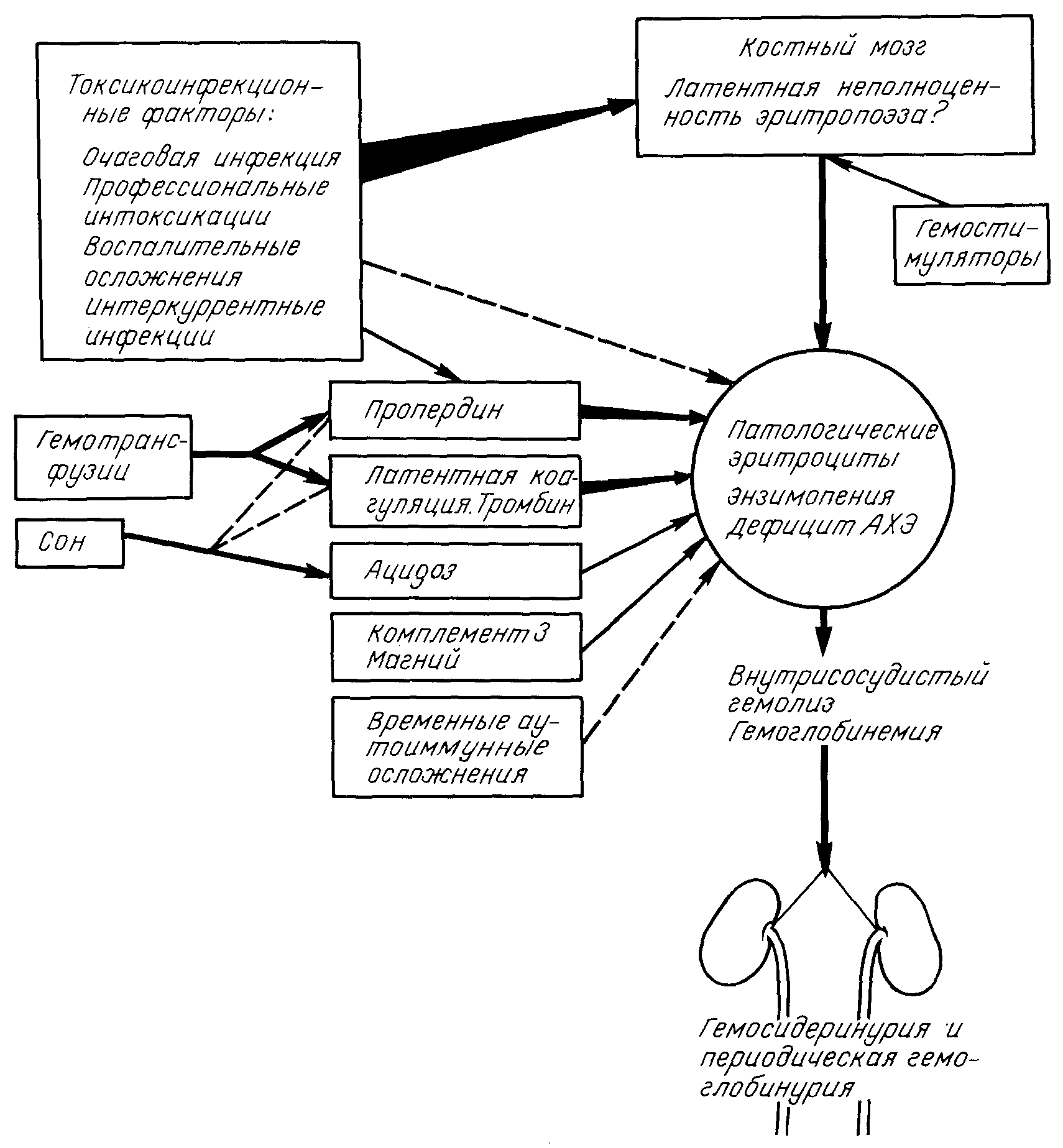
Рис. 55. Этиология и патогенез пароксизмальной ночной гемоглобинурии (ПНГ) (Г. А. Алексеев и Г. Б. Берлинер).
Crosby и Dameshek показали, что гемолитические свойства плазмы активируются при добавлении тромбина и инактивируются при добавлении гепарина, а также оксалата и цитрата, связывающих ионизированный кальций. На этом основании Crosby предложил тромбиновую пробу, т.е. использовать активирующее влияние тромбина на гемолитическую систему в качестве дифференциально-диагностического теста при ПНГ.
Интенсивность гемолиза повышается и под влиянием отдельных факторов свертывания крови — протромбина, проакцелерина, проконвертина, а также протамин-сульфата.
В свете наших современных знаний взаимоотношения между свертывающей и гемолитической системой при пароксизмальной ночной гемоглобинурии принимают характер цепной реакции: свертывающие факторы плазмы активируют гемолиз, в результате же распада эритроцитов из последних выделяется тромбопластический фактор — эритроцитин, который активирует свертывающую систему крови.
Современные представления о патогенезе болезни Маркиафава могут быть обобщены в виде следующей схемы (рис. 55).
Диагноз. В типичных случаях, протекающих с пароксизмами гемоглобинурии, диагноз болезни Маркиафава не представляет затруднений. О возможности ПНГ следует думать в каждом случае анемии или панцитопении, протекающей с признаками повышенного гемолиза, без увеличенной селезенки, рефрактерной к антианемической терапии (включая кортикостероидные гормоны) и дающей нередко ухудшение, вплоть до развития гемолитического — гемоглобинурийного — криза под влиянием препаратов железа, переливания крови и т. п. Наиболее постоянным (по нашим наблюдениям, встречающимся почти в 100% случаев) признаком болезни является гемосидеринурия, выявляемая в нативном виде при обычном микроскопировании осадка мочи и при реакции на железо с получением «берлинской лазури». Нам неоднократно приходилось убеждаться в ценности этого признака, являющегося в ряде случаев первым диагностическим симптомом, нацеливающим врача на диагноз ПНГ.
Бесспорное диагностическое значение имеет и кровяной детрит, обнаруживаемый в осадке мочи, обычно непосредственно после пароксизма гемоглобинурии. В распозновании заболевания известную роль в стадии ремиссии играет определение свободного гемоглобина плазмы, достигающее, по данным И. Ф. Корчмару, 6,25—18,75 мг% (у здоровых лиц содержание гемоглобина плазмы не превышает 1—4 мг%). Характерной особенностью, отличающей ПНГ от других состояний внутрисосудистого гемолиза, является повышение гемоглобинемии во время сна.
Раннюю диагностику ПНГ облегчает применение простых гемолитических тестов.
1. Кислотный тест Хэма. Исходя из известного факта повышенной чувствительности эритроцитов больных пароксизмальной ночной гемоглобинурией к кислой среде, Ham (1937) предложил диагностическую пробу, заключающуюся в том, что эритроциты больного ПНГ в свежей подкисленной человеческой сыворотке подвергаются гемолизу (нормальные эритроциты в этих условиях не гемолизируются).
2. Проба на спонтанный аутогемолиз Хегглина и Майера, основанная на ускоренном разрушении эритроцитов после инкубации при 37° в течение 6—24 часов, оказалась неспецифичной для болезни Маркиафава, так как она может давать положительные результаты и при других гемолитических процессах.
3. Тест Кросби основан на повышенной чувствительности эритроцитов больных ПНГ к тромбину.
4. Сахарная проба (Гартман и Дженкис) основана на повышенной чувствительности эритроцитов больного ПНГ к комплементу в присутствии сахарозы: при добавлении к ее раствору одногруппной донорской сыворотки эритроциты больного быстро подвергаются гемолизу.
По наблюдениям нашей клиники (Л. И. Идельсон) сахарозная проба является строго специфичной для болезни Маркиафава.
Дифференциально-диагностические затруднения возникают в тех случаях, когда наряду с гемолитическим синдромом (постоянная гемосидеринурия, пароксизмальная гемоглобинурия) наблюдается гипопластическое состояние кроветворения — панцитопения и тромбоцитопенические кровотечения.
Ю. И. Лорие и Л. А. Данилова склонны расценивать подобные случаи как терминальное завершение болезни Маркиафава гипоплазией костного мозга. Мы вместе с Ф. Э. Файнштейном, М. С. Дульциным, Г. Б. Берлинером допускаем и обратную возможность, т. е. вторично осложненной гемолитическим компонентом гипопластической анемии, причем, что очень существенно, анемия не адекватна степени гемолиза. Отличительным признаком гипопластической анемии от болезни Маркиафава является хорошая переносимость гемотрансфузий.
Существование вторичного синдрома внутрисосудистого гемолиза мы отмечали и при системной миелопролиферативной патологии, в частности при остеомиелосклерозе с эритробластической метаплазией селезенки (тип Воган).
Прогноз. Предсказание при болезни Маркиафава серьезно. Даже при относительно благоприятном течении заболевания могут наступать внезапные тяжелые обострения с летальным исходом за счет развития тромбозов или генерализации латентной инфекции; опасны арегенераторные кризы.
По статистическим данным, смерть в 50% случаев наступает в результате развития сосудистых осложнений: тромбозов, кровоизлияний, инфарктов — в любых областях, главным образом в системе мезентериальных и мозговых сосудов. В остальных 50% случаев смертельный исход развивается в результате инфекционных осложнений (уросепсиса) и анемической комы (при арегенераторных кризах), изредка почечной недостаточности — уремии.
Лечение. Терапия больных ПНГ представляет сложную задачу, если учесть, что больные ПНГ отличаются необыкновенно повышенной чувствительностью ко всевозможным медикаментозным и гемотерапевтическим средствам. Сложность заключается прежде всего в провоцирующем влиянии многих терапевтических средств. По выражению Crosby, «пароксизмальную ночную гемоглобинурию лучше всего лечит тот врач, который назначает меньше лекарств».
Заместительная гемотрансфузионная терапия продолжает оставаться наиболее эффективным средством лечения. Предложенные в свое время переливания плазмы, так же как переливания цельной крови, как правило, вызывают бурную реакцию с усилением признаков гемолиза и поэтому должны считаться противопоказанными.
Что касается переливаний эритроцитной массы, то, как показывает накопленный клиникой опыт, и они нередко дают обострения, обусловленные примесью плазмы.
Согласно клиническим наблюдениям «старая» эритроцитная масса переносится больными несколько лучше свежей. Исходя из этих данных, Ю. И. Лорие предложил переливать эритроцитную массу со сроком консервирования не менее 7 дней (срок инактивации пропердина).
С целью избегнуть гемотрансфузионных реакций Dacie предложил при болезни Маркиафава переливание эритроцитов, предварительно трижды отмытых от плазмы в физиологическом растворе и вводимых реципиенту немедленно или не позже 48 часов после хранения в леднике при 4°. Отмытые эритроциты хорошо переносятся больными даже при условии повторного — раз в 4—5 дней — введения в больших дозах (200— 400 мл) и являются по общему признанию лучшим средством лечения болезни Маркиафава.
Абсолютными, жизненно важными показаниями и трансфузии эритроцитной массы являются арегенераторные кризы.
Применение глюкокортикоидных гормонов в сочетании с переливаниями эритроцитной массы, по нашим наблюдениям, в отдельных случаях дает благоприятный эффект, снижая повышенную реактивность организма по отношению к перелитой крови.
Со времени введения в клиническую практику безреактивных переливаний отмытых эритроцитов отпала необходимость прибегать к гормональной «защите», тем более что, как показывает клинический опыт, некоторые больные болезнью Маркиафава дают реакции даже на введение кортикостероидных препаратов.
По мнению современных авторов, отрицательный эффект кортикостероидных гормонов обусловлен их активирующим влиянием на свертывающую систему крови и тормозящим влиянием на фибринолитическую систему, что может привести к усилению гемолиза и к тромбоэмболическим осложнениям. Неблагоприятное влияние кортикостероидных гормонов связывают также с обострением латентной инфекции и ее генерализацией.
На основании представления о существующей взаимосвязи процессов гемолиза и тромбообразования (см. выше) для купирования гемолиза предложены антикоагулянты.
Антигемолитическое действие антикоагулянтов, четко выраженное in vitro, оказалось весьма незначительным in vivo. Большинство авторов, занимавшихся антикоагулянтной терапией больных ПНГ, рекомендует ее в основном в период тяжелых гемоглобинурийных кризов для профилактики и лечения тромбозов, при этом предпочтение отдается антикоагулянтам непрямого действия (неодикумарин, пелентан, фенилин), так как терапия гепарином признается небезопасной (угроза кровотечения). Лечение антикоагулянтами, естественно, должно проводиться под контролем свертываемости крови и протромбинового времени.
Препараты железа ввиду их обычно плохой переносимости и возможного усиления гемолиза (описаны многократные случаи гемоглобинурии, спровоцированной приемом железа) многие авторы считают противопоказанными даже тем больным, у которых отмечаются явления гипосидероза (pica chlorotica).
Тем не менее следует согласиться с авторами, считающими, что в тех случаях болезни Маркиафава, когда дефицит железа является основным компонентом в патогенезе анемии, «не давать больным препаратов железа нельзя».
В известной мере реакции при введении препаратов железа можно избежать, применяя препараты железа вместе с анаболическими стероидными гормонами — андрогенами.
Назначение метиландростендиола, флюоксиместерона, неробола и других синтетических стеранаболов, назначаемых в день по 15—60 мг (в зависимости от выраженности анемии и интенсивности гемолиза) одновременно с препаратами железа, по нашим наблюдениям, уменьшает реакцию от введения железа и способствует улучшению показателей красной крови. Препараты витамина B12 даже в случае их хорошей переносимости не эффективны.
Хотя в литературе имеются указания на положительный эффект спленэктомии (урежение гемолитических кризов, уменьшение посттрансфузионных реакций, улучшение морфологических показателей крови) в отдельных случаях болезни Маркиафава, операцию удаления селезенки при данном заболевании в принципе следует считать непоказанной.
У наблюдавшегося нами больного с синдромом Маркиафава, развившимся на фоне метамалярийной спленомегалии, спленэктомия дала лишь временное улучшение — пароксизмы гемоглобинурии повторялись и после операции.
Не увенчались успехом и попытки (Beutler, Collins) применить при ПНГ цитостатики — иммунодепрессанты, в частности 6-меркаптопурин.
В период гемолитического криза с гемоглобинурией благоприятный эффект (в плане некоторого уменьшения и даже купирования гемолиза) достигается внутривенными вливаниями плазмозаменителей — декстрана или полиглюкина — в обычных дозах (500— 1000 мл). Полагают, что эти препараты связывают пропердиновую систему и тем предотвращают гемолиз.
При развитии острой почечной недостаточности в связи с массивной гемоглобинурией показаны новокаиновые околопочечные блокады, внутривенное введение новокаина, плазмозамещающих жидкостей (полиглюкин), в случае анурии — операция гемодиализа («искусственная почка»).
Исключительно важное значение приобретает применение антибиотиков в борьбе с очаговой инфекцией — хроническим пиелонефритом и др.
МАРШЕВАЯ ГЕМОГЛОБИНУРИЯ
Появление черной мочи в связи с напряженным маршем было впервые описано Fleischer (1881) у одного молодого солдата.
Feigl (1916) в период первой мировой войны, исследуя молодых солдат в походе, у 15 из 27 обнаружил следы гемоглобина (гематина) в сыворотке крови и кровяной пигмент в моче. Как правило, маршевая гемоглобинурия (не миоглобинурия!) обнаруживается у физически крепких, молодых лиц в связи с повышенной нагрузкой на мышцы нижних конечностей — после длительной ходьбы, марша, бега, лыжного перехода. Показательно, что другие мышечные нагрузки, в которых участвуют преимущественно мышцы туловища и верхних конечностей, к гемоглобинурии не приводят. Маршевая гемоглобинурия не провоцируется охлаждением.
Патогенез. Первоначально предполагали (Gilligan и Blumgart, 1941, и др.), что сущность маршевой гемоглобинурии заключается в усилении, под влиянием физической нагрузки в ортостатическом положении, процессов физиологического гемолиза, сопровождающихся повышением уровня, гемоглобина плазмы и в снижении почечного порога, вследствие чего в мочу проходит кровяной гемоглобин, освобождающийся при распаде эритроцитов. Согласно новейшим исследованиям Crosby и сотрудников (1966) гемоглобинсвязывающая способность плазмы (resp. содержание гаптоглобина) в период гемоглобинурийного криза, спровоцированного двухчасовым маршем, оказывается сниженной, вновь восстанавливаясь после отдыха на койке.
В последние годы внимание исследователей (Davidson, 1964) привлек тот факт, что повышение уровня гемоглобина плазмы и гемоглобинурия появляются после бега по-твердому (земляному, деревянному) грунту и не развивается у тех же бегунов после бега по мягкой траве. Этим же автором было показано, что гемоглобинемия и гемоглобинурия могут быть предотвращены в том случае, когда бег теми же лицами совершается в бутсах, снабженных эластическими стельками. Таким путем было показано, что внутрисосудистый гемолиз при маршевой («спортивной») гемотлобинемии-урии имеет место в сосудах нижних конечностей вследствие механической травмы эритроцитов при прохождении последних через эти сосуды при длительном беге по твердой поверхности.
Исследования Davidson, раскрывшие непосредственный механизм казавшейся загадочной на протяжении 80 лет маршевой гемоглобинурии, не снижают значения индивидуального предрасположения к появлению гемоглобинурии у некоторых лиц в связи с длительной нагрузкой на нижние конечности. Надо полагать, что это индивидуальное предрасположение обусловлено врожденными факторами, в первую очередь — гипогаптоглобинемией, снижающей порог проходимости гемоглобина плазмы через почечный фильтр. Роль лордоза, как фактора, предрасполагающего к стазу эритроцитов и гемолизу на уровне почечных клубочков, остается недоказанной.
Клиника. В отличие от других видов пароксизмальной гемоглобинурии приступ маршевой гемоглобинурии протекает без озноба и повышения температуры, сопровождаясь лишь умеренной слабостью. Выделение кровавой мочи в связи с маршем продолжается несколько часов или дней и прекращается после окончания ходьбы (или бега) так же внезапно, kqk начинается.
Со стороны крови отмечается нейтрофильный лейкоцитоз, повышенный ретикулоцитоз и умеренная нормохромная анемия, адекватная интенсивности и длительности гемоглобинурии. РОЭ несколько ускорена. ОРЭ не изменена. Во время криза отмечается умеренная гипербилирубинемия (за счет гемолитического, неконъюгированного билирубина) и уробилинурия.
Диагноз маршевой гемоглобинурии ставится на основании типичной клинической картины, связи заболевания с предшествующей длительной ходьбой (или бегом) и данных клинико-лабораторных исследований.
Дифференциальный диагноз с миоглобулинурией проводится как на основе клинической симптоматики (отсутствие при маршевой гемоглобинурии мышечных болей столь интенсивных при миоглобинурии, меньшая тяжесть общеклинических симптомов, наличие умеренной анемии в период гемолитического криза), так и на основе специальных лабораторных тестов: 1) определения гемоглобина плазмы — концентрация гемоглобина плазмы свыше 5 мг% характеризует гемоглобинемию и, следовательно, гемоглобинурию; 2) идентификации гемоглобина (или миоглобина) в моче: а) методом электрофореза на бумаге или крахмальном геле, б) методом высаливания с сернокислым аммонием (проба Блондгейма) и в) методом спектрофотометрии; 3) определения в сыворотке крови мышечных ферментов — глютамин-щавелево-уксусной трансаминазы, лактодегидрогеназы и креатинин-фосфокиназы, а в моче — повышенного выделения креатинина (до 5 и больше граммов в сутки), характеризующих мио- (но не гемо-!) глобинурию.
Болезнь носит доброкачественный характер. Прогноз благоприятен.
Дата добавления: 2019-11-25; просмотров: 159; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
