АНЕМИИ ВСЛЕДСТВИЕ ОПУСТОШЕНИЯ КОСТНОГО МОЗГА, ГИПО- И АПЛАСТИЧЕСКИЕ АНЕМИИ. МИЕЛО-АПЛАСТИЧЕСКИЙ СИНДРОМ
Несмотря на большое количество исследований, посвященных изучению гипо- и апластических анемий, до сих пор еще не представляется возможным создать рациональную классификацию этих состояний, поскольку не только вопросы патоморфогенеза, но даже определение самого понятия «гипо(а)пластическая анемия» является дискутабельным.
В соответствии с современными представлениями о генезе гипо- и апластических состояний кроветворения мы выделяем две основные группы гипо- и апластических анемий: 1) врожденные («генуинные») гипо-апластические анемии; 2) приобретенные гипо-апластические анемии различной этиологии.
По течению различают острые, подострые и хронические формы. Гипоапластическая анемия может осложняться гемолитическим, геморрагическим или агранулоцитарно-септическим синдромом.
При всем многообразии этиологических и клинических форм все гипо- и апластические состояния кроветворения объединяются единым патоморфологическим субстратом: это панмиелопатия, иначе говоря, тотальное подавление кроветворения, нарушение пролиферации (и в меньшей степени дифференциации) самых родоначальных элементов гемопоэза — гемогистио- и гемоцитобластов.
Отражением состояния панмиелопатии (пареза, фтиза) является панцитопения в периферической крови. Всякая гипо- и апластическая анемия протекает с сопутствующей лейко- и тромбоцитопенией. Говоря «анемия», мы лишь подчеркиваем основной синдром — анемический, обусловливающий своеобразие клинической картины болезни.
|
|
|
Этиология. Этиология гипо- и апластических анемий весьма разнообразна. В развитии миелофтиза играют роль как эндогенные, еще неизвестные причины, как и экзогенные факторы.
Заслуживает внимания то обстоятельство, что апластическое состояние кроветворения может возникнуть под влиянием таких факторов, как ионизирующая радиация, бензены, которые в условиях эксперимента ведут к развитию системного заболевания крови — лейкоза (см. ниже).
Этиологические факторы в развитии гипо-и апластических анемий
I. ЭНДОГЕННЫЕ
1. Эндокринные — гипотиреоз, гипопитуитаризм (болезнь Фанкони); доброкачественные опухоли (лимфоэпителиомы) вилочковой железы.
2. Генуинная — апластическая анемия Эрлиха.
3. Остеомиелосклероз, остеопетроз (мраморная болезнь Альберса—Шенберга).
II. ЭКЗОГЕННЫЕ
1. Физические лучевые поражения (рентгеновские лучи, радий, изотопы, атомная энергия).
2. Химические:
а) токсические — бензол (бензены);
б) цитостатические: хлорэтиламины (эмбихин, допан), трихлорэтиленмеламины (ТЭМ, ТЭФ, ТиоТЭФ), колхицин, тетрахлоруглерод, антагонисты фолиевой кислоты (аминоптерин), антипурины (6-меркаптопурин, хлоропурин), уретан, миелосан (милеран) и прочие химиотерапевтические средства.
|
|
|
3. Токсико-аллергические:
а) медикаментозные: пирамидон, атофан, метилтиоурацил, арсенобензены (сальварсан), барбитураты, сульфаниламиды, тибон, ПАСК, соли золота, антиэпилептические (гидантоин);
б) антибиотические: хлормицетин (хлорамфеникол).
4. Инфекционные (предположительно): генерализованные, с некротическими поражениями костного мозга, формы органного туберкулеза, сифилиса, бруцеллеза, брюшного тифа, сальмонеллеза, тяжелые септические заболевания.
Мы не причисляем к гипо- и апластическим состояниям кроветворения спленогенные панцитопении, связанные с функциональными моментами, т. е. с задержкой вызревания или задержкой вымывания, поскольку при этих состояниях костный мозг отнюдь не гипопластичен, а, напротив, гиперпластичен, имеется лишь нарушение вызревания и выхода в циркуляцию кровяных клеток, что доказывается «драматическим» эффектом спленэктомии.
Некоторые авторы относят к гипопластическим состояниям и анемии (панцитопении), связанные с процессами метаплазии при системных заболеваниях (ретикулозы — лейкозы) или метастазирования в костный мозг (карцинозьт). Мы полагаем, что методически правильнее отнести данные состояния к системным, т. е. гиперпластическим, заболеваниям, а анемию при этих состояниях обозначать как метапластическую, поскольку костный мозг по существу не аплазирован, он анаплазирован или метаплазирован, т. е. замещен атипической лейкозной или бластоматозной тканью.
|
|
|
Данному определению не противоречат известные случаи развития истинной аплазии костного мозга с картиной панмиелофтиза как терминального состояния при системных гиперпластических миелопролиферативных и лимфопролиферативных процессах. Даже такое сугубо пролиферативное заболевание, как эритремия, являющееся по существу панмиелозом, в процессе естественного развития и инволюции, особенно после лечения Р32, иногда заканчивается картиной гипо-апластического состояния кроветворения.
Признавая общность гипопластических и апластических анемий, наличие переходных стадий между ними, мы вместе с тем считаем необходимым подчеркнуть и различия как количественного, так и качественного характера, существующие между этими состояниями кроветворения. Эти различия, на наш взгляд, имеют не только теоретическое, но и практическое значение с точки зрения конечного прогноза и возможностей эффективного лечения больных.
|
|
|
При апластической анемии имеется более глубокое поражение исходных элементов кроветворения, быть может, на стадии ретикулярных клеток (гемогистиобластов), вследствие чего кроветворное древо иссякает в самой коре, еще до развития собственно кровяных клеток. Поэтому при апластических состояниях, как правило, не наблюдается признаков нарушенного вызревания кровяных клеток, связанного с дефицитом специфических факторов кроветворения (B12, фолиевой кислоты, железа). Даже если эти признаки и существуют, то не в качестве основных факторов, а как добавочные патогенетические факторы развития анемии. Иначе говоря, при апластических состояниях имеет место не столько качественное, сколько количественное нарушение кроветворения, проявляющееся в сокращении плацдарма кроветворения, причем это сокращение носит прогредиентный характер, доходя в выраженных случаях до полной аплазии, т. е. атрофии костного мозга как кроветворного органа.
Напротив, при гипопластических состояниях (включая и гипопластическую стадию апластической анемии), как правило, на определенном этапе эволютивного развития патологического процесса отмечаются явления качественного нарушения гемопоэза, связанные в основном с недостаточностью витаминов кроветворения — витамина B12 и фолиевой (фолиновой) кислоты. Эта качественная недостаточность гемопоэза сказывается в появлении соответствующих дистрофические, форм — «мегалобластоидных» эритроблзстов, полисегментоядерных нейтрофилов и т. п.
Подобная картина, описанная нами (1948) как арегенераторная диспластиче-с к а я анемия, по современным представлениям соответствует понятию В12-ахрестической анемии. При этом содержание витамина B12 в крови, по данным ряда авторов, повышено. Следовательно, речь идет не о недостаточном подвозе к костному мозгу витамина В12) (фолиновой кислоты), а о неиспользовании (ахрезии) костным мозгом витаминов, необходимых для нормального кроветворения.
В связи с качественными и количественными различиями в характере кроветворения при гипо- и апластических анемиях различно и состояние обмена крови.
Если при типичной апластической анемии кровяной обмен резко понижен, что доказывается рядом тестов (бледная сыворотка крови, пониженное содержание в ней билирубина, железа, отсутствие уробилирубина), то при гипопластических состояниях, протекающих с менее значительным сокращением плацдарма кроветворения, продукты кровяного распада, не используемые костным мозгом, нередко дают картину, имитирующую гемолитическую анемию и желтуху (желтушная сыворотка с повышенным содержанием билирубина и железа, уробилинурия, плейохромия желчи, гиперстеркобилинофекалия). Это — так называемая гипопластическая анемия с гемолитическим компонентом.
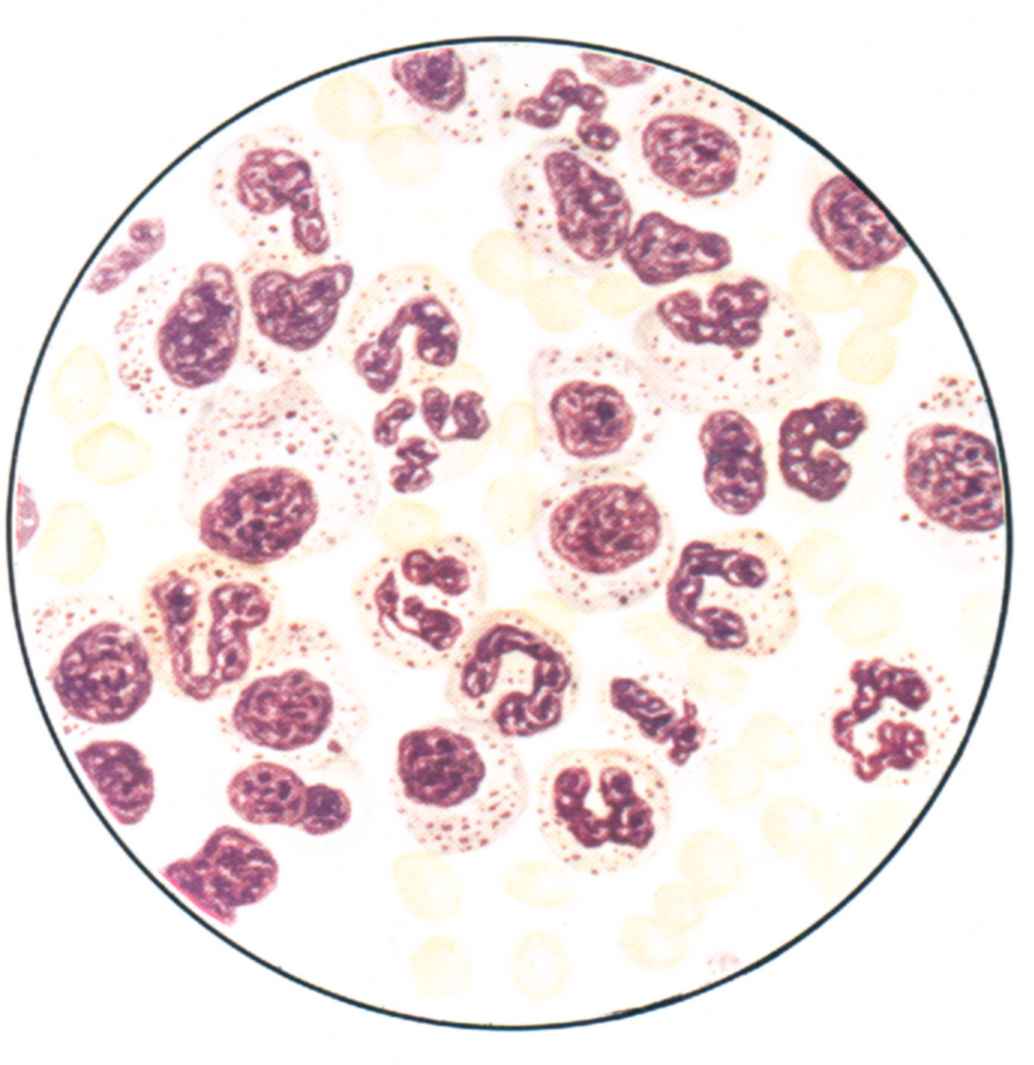
Табл. 25. Стернальный пунктат при гипопластической анемии с частично сохраненным лейко- и тромбоцитопоэзом. «Чисто белоклеточный» костный мозг.
Характерной особенностью данной формы является сочетание симптомов повышенного гемолиза с гипопластическим состоянием кроветворения, характеризующимся подавлением всех функций гемопоэза. В этом заключается основное отличие данной анемической формы от истинной гемолитической анемии. Периферическая кровь характеризуется панцитопенией при нормальном или слегка повышенном (не адекватном степени гемолиза!) ретикулоцитозе. В части случаев выпадает положительно прямая проба Кумбса.
Указанные различия между апластическими и гипопластическими анемиями в известной- мере условны. Существует множество переходных форм между гипо- и апластическими состояниями, так же как существует множество клинических вариантов этих состояний. Между тем вопрос, имеется ли у наблюдаемого конкретного больного на данном этапе апластическая или гипопластическая анемия, весьма существен. Вопрос этот нередко может быть разрешен лишь динамическим наблюдением при учете эффективности терапии.
Весьма существенное значение для определения масштабов сохранившегося кроветворения и возможного наличия экстрамедуллярных очагов гемопоэза представляют непосредственное изучение пунктатов и трепанатов кроветворных органов (костного мозга, печени, селезенки), а также радиометрические методы с применением радиол активных изотопов железа (Fe59) и хрома--51.
Радиоактивный хром (Сг51) применяется также для метки эритроцитов и определения средних сроков пребывания («жизни») эритроцитов в циркулирующей крови.
Дата добавления: 2019-11-25; просмотров: 228; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
