ГРАФИЧЕСКИЙ МЕТОД РАСЧЕТА ЧИСЛА ТЕОРЕТИЧЕСКИХ ТАРЕЛОК.



АБСОРБЦИЯ. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ АБСОРБЦИИ. ЗАКОН ГЕНРИ И ЗАКОН ДАЛЬТОНА, И ИХ ПРИМЕНЕНИЕ В РАСЧЕТАХ АБСОРБЦИОННЫХ ПРОЦЕССОВ. КОНСТАНТА ГЕНРИ, КОЭФФИЦИЕНТ РАСПРЕДЕЛЕНИЯ, ИХ ЗАВИСИМОСТЬ ОТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ.
Абсорбция — процесс избирательного поглощения компонентов газовой смеси жидким поглотителем (абсорбентом). Процесс абсорбции происходит в том случае, когда парциальное давление извлекаемого компонента в газовой смеси выше, чем в жидком абсорбенте, вступающем в контакт с этим газом, т.е. для протекания абсорбции необходимо, чтобы газ и абсорбент не находились в состоянии равновесия. Различие в парциальном давлении извлекаемого компонента в газе и жидкости является той движущей силой, под действием которой происходит поглощение (абсорбция) данного компонента жидкой фазой из газовой фазы. Чем больше эта движущая сила, тем интенсивнее переходит этот компонент из газовой фазы в жидкую.
По своей природе различают два вида абсорбции: физическую, при которой извлечение компонентов из газа происходит благодаря их растворимости в абсорбентах и химическую(хемосорбцию), основанную на химическом взаимодействии извлекаемых компонентов с активной частью абсорбента. Скорость физической абсорбции определяется диффузионными процессами, скорость хемосорбции зависит от скорости диффузии и химической реакции. Поглощение компонентов газовой смеси при абсорбции сопровождается выделением тепла, величина которого пропорциональна массе и теплоте растворения qAпоглощенных компонентов.
Процесс абсорбции обратимый, поэтому он используется не только для получения растворов газов в жидкостях, но и для разделения газовых смесей. Обратный процесс – выделение из абсорбента растворенных в нём газов носит название – десорбции.
При выборе абсорбента учитывают состав разделяемого газа, давление и температуру процесса, производительность установки. Выбор абсорбента определяется также его селективностью, поглотительной способностью, коррозионной активностью, стоимостью, токсичностью и другими факторами.
В нефтяной и газовой промышленности процесс абсорбции применяется для разделения, осушки и очистки углеводородных газов. Из природных и попутных нефтяных газов путем абсорбции извлекают этан, пропан, бутан и компоненты бензина.
В качестве абсорбентов при разделении углеводородных газов используют бензиновые или керосиновые фракции, а в последние годы и газовый конденсат, при осушке — диэтиленгликоль.
Поскольку процесс абсорбции осуществляется в двухфазной (газ — жидкость) и трехкомпонентной (один распределяемый и два распределяющих компонента) системе, число степеней свободы — три.
Таким образом, равновесие в системе газ (пар) — жидкость может характеризоваться тремя параметрами, например температурой, давлением и составом одной из фаз.
Равновесие в системе газ — жидкость определяется законом растворимости Генри, согласно которому при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
х=р/Е, (1) где р — парциальное давление газа над раствором, Па; х — мольная концентрация газа в растворе, моль/м3; Е — коэффициент пропорциональности (константа Генри).
Закон Генри распространяется в первую очередь на слаборастворимые газы, а также на растворы с низкими концентрациями хорошо растворимых газов при отсутствии химической реакции.
При повышенных давлениях (порядка десятков атмосфер и выше) равновесие между газом и жидкостью не следует закону Генри, так как изменение объема жидкости вследствие растворения в ней газа становится соизмеримым с изменением объема данного газа.
Коэффициент Е имеет размерность давления, совпадающую с размерностьюр, и зависит от природы растворяющегося вещества и температуры. Установлено, что с увеличением температуры растворимость газа в жидкости уменьшается. Когда в равновесии с жидкостью находится смесь газов, закону Генри может следовать каждый из компонентов смеси в отдельности.
Зависимость Е от температуры выражается уравнением 
гдеq— дифференциальная теплота растворения газа; R— газовая постоянная; С — постоянная, зависящая от природы газа и поглотителя.
Для идеальных растворов на диаграмме р — х (рисунок 1) зависимость равновесных концентраций от давления изображается прямой, имеющей наклон, равный Е — коэффициенту Генри. Из рисунка 1 следует, что с повышением температуры (при прочих равных условиях) увеличивается значение Е и соответственно уменьшается растворимость газа в жидкости..
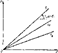

Рисунок 1 Рисунок 2
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть определено по закону Дальтона, согласно которому парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, т.е. р = Р·у или у = р/Р, (3)
гдеР — общее давление газовой смеси; у — мольная концентрация распределяемого в смеси газа.
Сопоставляя уравнения (1) и (3), найдем
у = Е·х/Р = Н·х (4) Н = Е/Р — коэффициент распределения (константа фазового равновесия), применяемый для областей действия законов Генри и Дальтона.
Уравнение (4) показывает, что зависимость между концентрацией данного компонента в газовой смеси и в равновесной с ней жидкости выражается прямой линией, проходящей через начало координат и имеющей угол наклона, тангенс которого равен m.
Численные значения m зависят от температуры и давления: уменьшаются с увеличением давления и понижением температуры. Таким образом, растворимость газа в жидкости увеличивается с повышением давления и снижением температуры.
Анализ факторов, влияющих на равновесие в системах газ (пар) — жидкость, позволил установить, что к параметрам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, — пониженное давление, повышенная температура и введение в абсорбент добавок, уменьшающих растворимость газов в жидкостях.
Дата добавления: 2019-11-25; просмотров: 261; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
