Технологическая схема, последовательность операций и их характеристика
Операции, состав электролита, содержание компонентов и параметры процессов описаны в таблице 1.1.
В ряду напряжений хром стоит выше железа в группе электроотрицательных металлов, но вследствие сильно выраженной способности к пассивированию он приобретает свойства благородных металлов. Поэтому электролитические осадки хрома хорошо и долго сохраняются на воздухе, не меняя своего цвета. Кроме того, хром стоек в растворе азотной кислоты, а также в среде органических кислот и сероводорода.
Хромовые покрытия жароустойчивы и начинают изменять свой цвет при 480–500°C. Хромовые осадки обладают большой твердостью (до 1000–1100 кгс/мм2 по Бринеллю) и износоустойчивостью. Потвердости они превышают высокоуглеродистую и закаленную стали, что объясняется некоторыми структурными особенностями электролитического хрома. Сопротивление механическому износу хромированных изделий увеличивается в 5–10 раз.
Хромирование получило широкое применение в промышленности для повышения твердости и сопротивления механическому износу таких изделий, как измерительный и режущий инструменты, валы, оси и цилиндры двигателей, лопатки водяных и паровых турбин и др. В полиграфии хромирование печатных форм позволяет увеличить их тиражеспособность.
Таблица 1.1 – Карта технологического процесса
| Операция | Состав электролита | Содержание компонента, г/ 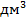
| Параметры | ||||
| Монтирование деталей на приспособление | |||||||
| Обезжиривание электрохимическое | Натрий едкий Сода кальцинированная Тринатрий фосфат Стекло натриевое | 5–10 20–40 20–40 3–5 | Т = 30–80˚С
τ = 0,5–10 мин
i = 2–10 А/ 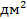 U = 6–12 В
U = 6–12 В
| ||||
| Промывка в теплой воде | Вода проточная | Т = 40–59˚С τ = 0,5–1 мин. | |||||
| Промывка в холодной воде | Вода проточная | τ = 0,5–1 мин | |||||
| Сушка естественная | Воздух | Т = 15–30˚С До высыхания | |||||
| Изоляция мест, не подлежащий покрытию | |||||||
| Установка анодов | |||||||
| Нагрев | Ангидрид хромовый технический Кислота серная аккумуляторная Хромин | 125–250 1,2–2,5 0,5–2 | Т = 45–60˚С τ = 5–10 мин | ||||
| Активация электрохимическая (анодная обработка) | Ангидрид хромовый технический Кислота серная аккумуляторная Хромин | 125–250 1,2–2,5 0,5–2 | Т = 45–60˚С
τ = 0,5–2,5 мин
i = 30–60 А/ 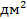 U = 6–12 В
U = 6–12 В
| ||||
| Хромирование | Ангидрид хромовый технический Кислота серная аккумуляторная Хромин | 125–250 1,2–2,5 0,5–2 | Т = 45–60˚С
i = 45–60 А/ 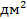 U = 6–12 В
U = 6–12 В
| ||||
| Промывка в холодной воде | Вода непроточная | τ = 0,5–1 мин | |||||
| Промывка в теплой воде | Вода проточная | Т = 40–59˚С τ = 0,5–1 мин | |||||
| Сушка естественная | Воздух | Т = 15–30˚С До высыхания | |||||
| Обдув сжатым воздухом | Сжатый воздух | ||||||
| Снятие деталей с приспособлений | |||||||
| Примечание: Время выдержки деталей в ванне хромирования зависит от толщины слоя хрома и скорости осаждения 0,3–0,7 мкм/мин.
| |||||||
Хромовые покрытия применяют в следующих случаях.
– Для защитно-декоративных целей. Хромовое покрытие с подслоем меди и никеля хорошо защищает сталь от коррозии, придавая изделиям красивый внешний вид.
– Для увеличения отражательной способности. Отражательная способность хромового покрытия уступает лишь отражательной способности серебра и алюминия, однако вследствие более высокой стойкости против окисления отражательная способность хрома более стабильна.
– Для увеличения износоустойчивости. Значительное повышение износостойкости трущихся поверхностей стенок цилиндров и поршневых колец двигателей внутреннего сгорания достигается при применении процессов пористого хромирования.
– Для восстановления изношенных размеров. Наращивание слоя хрома на изношенные поверхности термообработанных валов, втулок позволяет восстановить размеры деталей и этим увеличить срок эксплуатации изделий.
|
|
|
Толщина хромовых покрытий от 6 до 150 мкм.
В некоторых случаях пористость хромовых покрытий с успехомиспользуется для увеличения срока службы трущихся изделий требующих постоянной смазки. Пористое хромовое покрытие, пронизанное микротрещинами, впитывает смазочный материал, обеспечивая тем самым смазку без непрерывной подачи ее извне.
Электролитические осадки хрома можно получать из растворов как трех-, так и шестивалентных соединений хрома. В гальваностегии применяют пока только шестивалентные соединения хрома – раствор хромовых кислот, в которых металл находится в основном в виде комплексных анионов CrO42–, НCrО4–, Cr2O72–.
Электроосаждение хрома из раствора хромовой кислоты является одним из наиболее сложных процессов в гальваностегии. Он имеет ряд отличительных особенностей по сравнению с выделением многих металлов. Прежде всего, следует отметить особенности подготовки к хромированию. Хромовый электролит, являясь сильным окислителем, разрушающе действует на многие изоляционные материалы органического происхождения. Между тем при хромировании почти всегда имеется необходимость изоляции отдельных участков, не подлежащих покрытию.
|
|
|
При кратковременном декоративном хромировании с толщиной хрома в 1 мкм для изоляции могут быть использованы: целлулоид, эбонит, текстолит, цапонлак, каучук. При длительном хромировании рекомендуется применять следующие изоляционные материалы: полихлорвиниловое полотно, перхлорвиниловые лаки, стеклянное полотно, фарфор, керамику и эбонит. В качестве материала для подвесок следует пользоваться железом.
Сам процесс хромирования характеризуется четырьмя основными особенностями.
Первой особенностью является чрезвычайно низкий выход по току в хромовых электролитах, составляющий в среднем около 13%.
Электрический ток расходуется, в основном, на побочные реакции и процессы, главным образом на разложение воды на водород и кислород и на выделение джоулева тепла.
Выделяясь на катодных и анодных поверхностях, газы образуют ядовитый туман, состоящий из мельчайших пузырьков хромового электролита, для удаления которого требуется вентиляция.
Адсорбируясь поверхностью деталей, водород создает водородную хрупкость деталей – явление, с которым приходится бороться путем последующего прогревания деталей до 400–450°С.
Выделение джоулевой теплоты при электролизе обычно помогает поддержанию рабочей температуры электролита. Если же сила тока чрезмерно велика по отношению к емкости ванны, то электролит быстро перегревается: в этом случае электролит необходимо охлаждать путем подачи холодной воды в пароводяную рубашку ванны.
Второй особенностью процесса является применение при хромировании высоких катодных плотностей тока.
Поэтому, даже при сравнительно небольшой площади покрытия, общая сила тока на ванну может доходить до нескольких тысяч ампер, при напряжении 10–12 В. Это требует применения больших сечений шин и подвесок, способных пропускать эту силу тока в течение нескольких часов без нагревания.
Третьей особенностью процесса является весьма низкая рассеивающая способность электролита. Вследствие этого хромирование профилированных деталей следует производить с применением фигурных анодов, повторяющих профиль покрываемых деталей и создающих этим равномерное распределение тока не поверхности детали. При хромировании внутренних поверхностей также необходимо применять внутренние аноды, отвечающие форме полостей. Их сечение обычно составляет 0,4–0,6 от поперечника полости. Для уменьшения концентрации тока на острых гранях и выступах деталей их защищают посредством проволочных экранов.
Последняя, основная особенность хромирования заключается в применении нерастворимых свинцовых анодов.
При покрытии наружных поверхностей отношение площади анодов к площади покрываемых деталей следует поддерживать равным 2:1. Так как осаждение хрома происходит за счет обеднения электролита хромовым ангидридом, то корректировку электролита производят систематически, по данным анализа.
Перед хромированием следует выдерживать детали в ванне без тока в течение 5–10 мин, для того чтобы их поверхность приняла температуру электролита. Включение тока производят перекидным рубильником на щите ванны так, чтобы детали подверглись сначала (в течение 30–150 с) анодной обработке а затем переключают ток на процесс непосредственного хромирования.
На катоде могут протекать одновременно несколько сопряженных процессов: восстановление ионов шестивалентного хрома до ионов низшей валентности и до металлического хрома и восстановление ионов водорода. Хотя механизм восстановления ионов хрома явился предметом многих исследований, чрезвычайная сложность явлений, сопровождающих процесс хромирования, не позволяет пока считать решение этого вопроса окончательным.
Одна из первых распространенных теорий хромирования была высказана Либрейхом, который на основе поляризационных измерений пришел к выводу, что процесс электроосаждения хрома протекает стадийно по схеме: Сr6+→Cr3+→Cr2+→Сr0. Примерно такого же объяснения механизма процесса придерживался Сарджент, который в отличие от Либрейха считал, что образование на катоде металлического хрома происходит при разряде трехвалентных ионов хрома. Теория стадийного восстановления хрома получила дальнейшее развитие в работах, в которых значительная роль в восстановлении хромовой кислоты отводится атомарному водороду.
В последнее время большинство исследователей связывает восстановление хромовой кислоты до металла с образованием на катоде пассивирующей пленки, при наличии которой потенциал значительно смещается в сторону отрицательных значений, достигая потенциала восстановления ионов хрома до металла. При этом большое влияние оказывает присутствие в растворе посторонних анионов: SО42–, SiF42–, F– и Сl–. Однако, мнения различных исследователей о характере действия пассивной пленки и посторонних анионов расходятся.
Е. Мюллер, С. Каспер и др. высказывали предположение, что пленка препятствует проникновению хромат-ионов к электроду и затрудняет восстановление их до металла. Посторонние анионы, присутствующие в растворе, частично разрушают пленку, обеспечивая тем самым доступ хромат-иопов к поверхности катода, где они непосредственно восстанавливаются до металла без образования промежуточных соединений.
Позднее было показано, что образующаяся на катоде в процессе электролиза пленка, наоборот способствует восстановлению хромат-ионов до металла. По данным авторов, электроды из хрома, железа, никеля, кобальта и некоторых других металлов в чистом растворе хромовой кислоты покрываются прочнойокисной пленкой, которая препятствует восстановлению ионов хрома даже при поляризации катода до высокого отрицательного потенциала. В этих условиях выделяется только водород, причем при повышенном перенапряжении. Восстановление хромат-иона на этих электродах возможно только и присутствии небольшого количества указанных выше других анионов, которые служат как бы катализаторами процесса. При этом в зависимости от потенциала меняется как характер, так и скорость электрохимических реакций. Последнее иллюстрируется поляризационными кривыми, полученными потенциостатическим методом в растворе хромовой кислоты (250 г/л СrО3) без добавок и с добавкой 2,5 г/л H2SO4 при 18°С (рисунок 1.1).
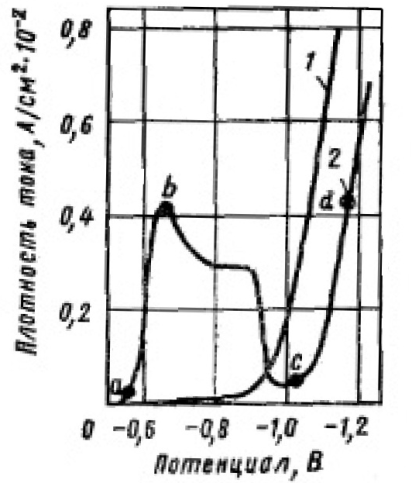
1– зависимость плотности тока от потенциала при электролизе 2,5 моль/дм3 раствора хромовой кислоты без добавок; 2 – зависимость плотности тока от потенциала при электролизе 2,5 моль/дм3 раствора хромовой кислоты с добавкой 0,025 моль/дм3 H2SO4.
Рисунок 1.1 – Зависимость плотности тока от потенциала при электролизе 2,5 моль/дм3 раствора хромовой кислоты без добавок и с добавкой на хромовом катоде при 18°С (потенциостатический метод)
Как видно из рисунка 1.1, характер и скорость процесса в электролитах без добавок и с добавками посторонних анионов отличны. В первом случае уже при незначительной плотности тока потенциал резко смещается в отрицательную сторону (кривая 1) и на катоде выделяется лишь один водород (поверхность катода пассивна). Во втором случае (кривая 2) скорость процесса вначале сильно возрастает (участок ab), что указывает на активное состояние поверхности, затем при дальнейшем повышении потенциала постепенно снижается (участок b c )и, достигнув минимума при ε = –1,0 ÷ –1,1 В, снова возрастает (участок cd).Предполагают, что при потенциалах, соответствующих отдельным ветвям поляризационной кривой 2, протекают следующие электрохимические реакции.
На участке ab – неполное восстановление Сr6+ до Сr3+ по уравнению:
Cr2O72– + 14Н+ + 6е → 2Cr3+ + 7H2О (1.1)
На участке bс, наряду с реакцией (1.1), скорость которой постепенно снижается, происходит выделение водорода:
2Н3О+ + 2е → Н2 + 2Н2О (1.2)
На этом участке в присутствии посторонних анионов возможно также химическое восстановление хромат-ионов атомарным водородом до ионов Сr3+.
На участке cd протекают одновременно три реакции: первые две и восстановление Сr6+ до Сr0
Сr2О72– + I4H+ + 12е → 2Сr + 7Н2О (1.3)
Роль анионов заключается в том, что адсорбируясь на поверхности катода, они препятствуют образованию на ней прочной окисной пленки и тем самым облегчают адсорбцию и восстановление хромат-ионов до трехвалентных (участок ab).
На некоторых металлах, например, на серебре и меди, которые не окисляются хромовой кислотой и остаются в ней активными, восстановление Сr6+ до Сr3+ возможно и в отсутствие посторонних анионов. Снижение скорости процесса при повышении потенциала в сторону отрицательных значений (b с) связано с образованием на катоде фазовой пленки из продуктов восстановления xромат-ионов. По данным анализов, она содержит Сr3+, Сr6+ и SO42–. Затрудняя более выгодные в энергетическом отношений реакции (1.1) и (1.2), пленка создает благоприятные условия протекания реакции (1.3).
По мере уплотнения пленки потенциал катода все более сдвигается в сторону отрицательных значений, достигая величины, при которой возможно непосредственное восстановление хромат-ионов до металла. При этом на участке е d поляризационной кривой процесс не облегчается (как указывалось другими исследователями), а, наоборот, затрудняется – катодные потенциалы на этом участке смещаются в сторону более отрицательных значений относительно поляризационной кривой для электролита без добавок. Сульфат-ионы и другие посторонние анноны должны рассматриваться как катализаторы, образующие с хромат-нонами и положительным золем гидроокиси хрома промежуточные химические соединения особого рода, восстановление которых на катоде облегчено из-за их адсорбированного состояния (катодная пленка).
Электрохимическое обезжиривание в щелочных растворах при постоянном токе осуществляется на аноде. В процессе электролиза на поверхности детали наблюдается интенсивное выделение пузырьков газа, облегчающих отрыв капелек масла от поверхности детали, чем значительно улучшается обезжиривание.
При электрохимическом обезжиривании с увеличением поляризации уменьшается прочность сцепления масла с поверхностью электрода. Параллельно с усилением поляризации увеличивается степень смачивания водой поверхности металла.
Скорость обезжиривания деталей на аноде меньше, чем на катоде. Это объясняется тем, что в прианодном пространстве не происходит защелачивания электролита, вследствие чего процесс омыления жиров у анода происходит медленнее. Кроме того, количество выделяющегося при электролизе кислорода меньше, чем количество водорода, а пузырьки кислорода больше пузырьков водорода и меньше задерживаются на поверхности капелек масла, а поэтому и удаление масла с поверхности происходит менее интенсивно. Однако процесс катодного обезжиривания сопровождается наводораживанием.
Скорость электрохимического обезжиривания значительно выше химического. Качество обезжиривание также лучше. Недостаток электрохимического обезжиривания – низкая рассеивающая способность применяемых растворов, вследствие чего очистка сложнопрофилированных деталей затруднительнее.
Анодную активацию проводит при плотности тока 30–60 А/  в обычной ванне, в которой затем после переключения полярности штанг ведется процесс хромирования. В первом случае температура декапирования должна быть 50°С; во втором случае – должна соответствовать той температуре, при которой после декапирования будет протекать процесс хромирования. Перед декапированием детали выдерживают в электролите без тока с целью их прогрева. Длительность прогрева зависит от массы отдельной детали и может колебаться от 5 до 10 мин.
в обычной ванне, в которой затем после переключения полярности штанг ведется процесс хромирования. В первом случае температура декапирования должна быть 50°С; во втором случае – должна соответствовать той температуре, при которой после декапирования будет протекать процесс хромирования. Перед декапированием детали выдерживают в электролите без тока с целью их прогрева. Длительность прогрева зависит от массы отдельной детали и может колебаться от 5 до 10 мин.
Длительность анодной активации зависит от типа покрываемого материала (марки стали) и толщины наносимого покрытия. В среднем составляет 0,5–2,5 мин.
После активации стальных деталей хромирование следует начинать с «толчка» тока, т. е. в течение первых 1–2 мин плотность тока должна в 2–3 раза превышать нормальную (рекомендуемую) величину плотности тока. Затем плотность тока снижается в течение 1–1,5 мин до нормальной величины. «Толчок» тока обязателен при хромировании высоколегированных и коррозионно-стойких сталей.
После каждой операции подготовки и нанесения гальванического покрытия детали следует тщательно промывать, причём особенное влияние уделять тому, чтобы в гальванические ванны не попадало даже следов обезжиривающих и травильных растворов. Загрязнения могут стать причиной ухудшения сцепления покрытия с основой, появления пятен и других нарушений нормальной работы электролита. Промывка проводится в течение 1–4 минут.
После обезжиривания детали промывают вначале горячей, затем в холодной воде. Хорошо обезжиренная поверхность должна равномерно покрываться водой.
Дата добавления: 2019-09-13; просмотров: 159; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
