Методы определения санитарно-показательных микроорганизмов воды, воздуха и почвы
Санитарно-бактериологическое исследование воды. Отбор проб воды. Методы санитарно-микробиологического контроля качества питьевой воды в отношении ее эпидемической безопасности по показателям СанПиН 2.1.4.559—96 “Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества” и ГОСТ 18963—73 «Вода питьевая. Методы санитарно-бактериологического анализа» проводятся в соответствии с методическими указаниями МУК 4.2.1018-01 (01.07.2001). Методические указания предназначены для лабораторий организаций, предприятий и иных хозяйственных субъектов, осуществляющих производственный контроль, а также органов санитарно-эпидемиологической службы, обеспечивающих государственный и ведомственный санитарно-эпидемиологической надзор за качеством питьевой воды централизованных систем питьевого водоснабжения.
Точность результатов исследования воды зависит от способов отбора, хранения и перевозки проб воды в лабораторию для исследования, а также качества питательных сред, используемых при исследовании. Отбор проб воды производится специально подготовленным лицом (выемщиком проб, лаборантом или помощником санитарного врача) в присутствии представителя организации или учреждения, в ведении которого находится исследуемый водоисточник или водопроводное сооружение.
О выемке составляется акт, в котором указывают местонахождение и наименование сооружения, точки забора и дают краткую характеристику источника или сооружения. Указывают, по чьему заданию производится исследование, цель последнего, время забора (дата и час), должность и фамилия выемщика проб. Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения, изготовленные из материалов, не влияющих на жизнедеятельность микроорганизмов. Отбор проб производит специалист после прохождения инструктажа по технике выполнения отбора проб для микробиологического анализа. Пробу отбирают в стерильные емкости. Емкость открывают непосредственно перед отбором, удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего-либо касаться. Ополаскивать посуду запрещается. При исследовании воды из распределительных сетей отбор проб из крана производят после предварительной его стерилизации обжиганием и последующего спуска воды не менее 10 мин при полностью открытом кране. При заполнении емкостей должно оставаться пространство между пробкой и поверхностью воды, чтобы пробка не смачивалась при транспортировании. После наполнения емкость закрывают стерильной пробкой и колпачком.
|
|
|
На сосуд наклеивают этикетку с указанием номера пробы или же надписывают номер карандашом по стеклу. Доставку проб питьевой воды осуществляют в контейнерах-холодильниках при температуре, 4-10°С. В холодный период года контейнеры должны быть снабжены термоизолирующими прокладками, обеспечивающими предохранение проб от промерзания. При соблюдении указанных условий срок начала исследований от момента отбора проб не должен превышать 6 ч. Если пробы нельзя охладить, их анализ следует провести в течение 2 ч после забора. Если не может быть соблюдено время доставки пробы и температура хранения, анализ пробы проводить не следует. Пробы питьевой воды должны доставляться в отдельных продезинфицированных контейнерах.
|
|
|
Определение общего микробного числа. Метод определяет в питьевой воде общее число мезофильных аэробных и факультативно анаэробных микроорганизмов (ОМЧ), способных образовывать колонии на питательном агаре при температуре 37°С в течение 24 ч, видимые с увеличением в 2 раза. Из каждой пробы делают посев не менее двух объемов по 1 мл. После тщательного перемешивания пробы воды вносят по 1 мл в стерильные чашки Петри, слегка приоткрывая крышки. После внесения воды в каждую чашку вливают 8—12 мл (на чашку диаметром 90—100 мм) расплавленного и остуженного до 45—49°С питательного агара после фламбирования края посуды, в которой он содержится. Затем быстро смешивают содержимое чашек, равномерно распределяя по всему дну, избегая образования пузырьков воздуха, попадания агара на края и крышку чашки. Эту процедуру производят на горизонтальной поверхности, где чашки оставляют до застывания агара. После застывания агара чашки с посевами помещают в термостат вверх дном и инкубируют при температуре 37°С в течение 24 ч. Для учета результатов подсчитывают все выросшие на чашке колонии, наблюдаемые при увеличении в 2 раза. Учитывают только те чашки, на которых выросло не более 300 изолированных колоний. Количество колоний на обеих чашках суммируют и делят на два. Результат выражают числом колониеобразующих единиц (КОЕ) в 1 мл исследуемой пробы воды. Если на одной из 2 чашек подсчет невозможен, результат выдают на основании учета колоний на одной чашке. Если на двух чашках имеет место рост расплывчатых колоний, не распространяющийся на всю поверхность чашки, или выросло более 300 колоний и анализ нельзя повторить, подсчитывают сектор чашки с последующим пересчетом на всю поверхность. В этих случаях в протоколе отмечают “число КОЕ/ мл - ориентировочно”. Если подсчет колоний на чашках невозможен, то в протоколе отмечают “сплошной рост”.
|
|
|
|
|
|
Метод фильтрации. Основным методом определения общих и термотолерантных колиформных бактерий является метод мембранной фильтрации.Общие колиформные бактерии (ОКБ) - грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре 37°С в течение 24—48 ч. Термотолерантные колиформные бактерии (ТКБ) входят в число общих колиформных бактерий, обладают всеми их признаками и, кроме того, способны ферментировать лактозу до кислоты, альдегида и газа при температуре 44°С в течение 24 ч.
Метод основан на фильтрации установленного объема воды через мембранные фильтры, выращивании посевов на дифференциальной питательной среде с лактозой и последующей идентификацией колоний по культуральным и биохимическим свойствам (рис.12). При исследовании питьевой воды анализируют 3 объема по 100 мл. При получении стабильных отрицательных результатов допустима фильтрация 300 мл воды через один фильтр. При фильтрации воды неизвестного качества целесообразно увеличение количества фильтруемых объемов для получения изолированных колоний на фильтре (например, 10, 40, 100, 150 мл воды). Фильтры помещают на среду Эндо и чашки с фильтрами ставят в термостат дном вверх, инкубируют посевы при температуре 37°С в течение 24 ч. Если на фильтрах нет роста или выросли колонии пленчатые, губчатые, плесневые, прозрачные, расплывчатые, выдают отрицательный ответ: отсутствие ОКБ и ТКБ в 100 мл исследуемой воды. Анализ заканчивают через 24 ч. Если на фильтрах обнаружен рост изолированных типичных лактозоположительных колоний: темно-красных, красных с металлическим блеском или без него или других подобного типа колоний с отпечатком на обратной стороне фильтра, подсчитывают число колоний каждого типа отдельно и приступают к подтверждению их принадлежности к ОКБ и ТКБ с использованием оксидазного теста, окраски по Граму, определение ферментации лактозы.
При отсутствии общих и термотолерантных колиформных бактерий на всех фильтрах результат записывают “не обнаружено КОЕ ОКБ в 100 мл” и “не обнаружено КОЕ ТКБ в 100 мл”.
В случае идентификации всех выросших подозрительных колоний число колониеобразующих единиц ОКБ и ТКБ подсчитывают на всех фильтрах и выражают результат анализа КОЕ в 100 мл воды. Вычисление проводят по формуле:
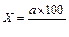 ,
,
Х - число колоний в 100 мл;
V - профильтрованный объем воды через фильтры, на которых велся учет;
а - число подсчитанных на этих фильтрах колоний в сумме.
Примеры:
1. При посеве 3 фильтров по 100 мл выросло две колонии в 100 мл, на остальных двух фильтрах нет роста. Число общих или термотолерантных колиформных бактерий будет:
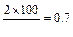 КОЕ ОКБ (ТКБ) в 100 мл
КОЕ ОКБ (ТКБ) в 100 мл
2. При посеве 10, 40, 100 и 150 мл на фильтрах с профильтрованным объемом 40 мл выросло 4 изолированные колонии, с профильтрованным объемом 100—3 ОКБ. Фильтры с объемами 10 мл и 150 мл заросли и учету не подлежат. Суммируют общее число колоний ОКБ (ТКБ) на тех фильтрах, где получены изолированные колонии, и пересчитывают на объем 100 мл.
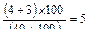 КОЕ в 100 мл
КОЕ в 100 мл
Окончательный результат выдают: количество КОЕ ОКБ в 100 мл, из них количество КОЕ ТКБ в 100 мл.

|
| |
| |
|
|
|
|
Титрационный метод. Определение общих и термотолерантных колиформных бактерий титрационным методом может быть использовано при отсутствии материалов и оборудования, необходимых для выполнения анализа методом мембранной фильтрации; при анализе воды с большим содержанием взвешенных веществ; в случае преобладания в воде посторонней микрофлоры, препятствующей получению на фильтрах изолированных колоний общих колиформных бактерий.
Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду, с последующим пересевом на дифференциальную плотную питательную среду с лактозой и идентификацией колоний по культуральным и биохимическим тестам.
При исследовании питьевой воды качественным методом (текущий санэпиднадзор, производственный контроль) засевают 3 объема по 100 мл. При исследованиях воды с целью количественного определения ОКБ и ТКБ при повторном анализе производят посев: 3 объемов по 100 мл, 3 объемов по 10 мл, 3 объемов по 1 мл. Каждый объем исследуемой воды засевают в лактозо-пептонную среду, состоящую из 1% пептонной воды, 0,5% NaCl, 0,5% лактозы, индикатор, поплавок. Посев 100 мл и 10 мл воды производят в 10 и 1 мл концентрированной лактозо-пептонной среды, посев 1 мл пробы проводят в 10 мл среды обычной концентрации. Посевы инкубируют при 37°С в течение 48 ч. Не ранее 24 час инкубации проводят предварительную оценку посевов. Из емкостей, где отмечено наличие роста (помутнение) и образование газа, производят высев бактериологической петлей на сектора среды Эндо для получения изолированных колоний. Емкости без наличия роста и образования газа оставляют в термостате и окончательно просматривают через 48 ч. Посевы без признаков роста считают отрицательными и дальнейшему исследованию они не подлежат. Из емкостей, где отмечено помутнение и образование газа или только помутнение делают высев на сектора среды Эндо. Посевы на среде Эндо инкубируют при температуре 37 °С в течение 18—20 ч. При образовании помутнения и газа в среде накопления и росте на среде Эндо колоний, типичных для лактозоположительных бактерий: темно-красных или красных, с металлическим блеском или без него, выпуклых с красным центром и отпечатком на питательной среде, дают положительный ответ на присутствие общих колиформных бактерий в данном объеме пробы.
Для определения термотолерантных колиформных бактерий работают с секторами среды Эндо, где выросли типичные лактозоположительные колонии. Делают посев 2—3 изолированных колоний каждого типа с каждого сектора в пробирки с любой из лактозных сред. Среду перед посевом нагревают на водяной бане или в термостате до 44 °С. Немедленно после посева пробирки помещают в термостат и инкубируют при температуре 44°С в течение 24 ч. Допускается просмотр посевов через 4—6 ч. При образовании газа в среде накопления, росте на среде Эндо лактозоположительных бактерий и выявлении способности этих бактерий ферментировать лактозу до кислоты и газа в течение 24 ч при температуре 44 °С дают положительный ответ на наличие в этом объеме пробы воды ТКБ. Во всех остальных случаях дают отрицательный ответ.
При исследовании 3 объемов по 100 мл результаты оцениваются качественно и при обнаружении ОКБ и ТКБ хотя бы в одном из 3 объемов, делается запись в протоколе “обнаружены в 100 мл”.
При исследовании количественным методом определяют наиболее вероятное число (НВЧ) ОКБ и ТКБ по специальной таблице. Результат сообщают без доверительного интервала.
При отрицательном ответе на наличие ОКБ и ТКБ во всех исследованных объемах выдают заключение в протоколе “не обнаружены в 100 мл”.
Дата добавления: 2019-09-13; просмотров: 1545; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!