СОВРЕМЕННЫЙ ВЗГЛЯД НА ПАТОГЕНЕЗ
ИЛЕЧЕНИЕ
А . В . Хватова , Л . Е . Теплинская , А . А . Яковлев , Е . В . Мазанова , А . О . Тарасенков
Врожденная глаукома встречается относительно редко: 1 случай на 10— 20 тыс. новорожденных [Хватова А.В., 1995]. В странах Ближнего Востока на 2500 новорожденных приходится 1 случай врожденной глаукомы, что в 4 раза больше, чем в странах Западной Европы [Elder M.J., 1993]. В некоторых странах частота этой патологии выше, возможно, вследствие большого коли-чества близкородственных браков [Foster A., Gilbert C, 1992]. Отмечено, что консультант-офтальмолог в Великобритани и выявляет новый случай
врожденной глаукомы каждые 5 лет [Khaw P.T., 1996]. По данным некоторых авторов [Foster A., Gilbert C, 1992], среди причин слепоты удельный вес врожденной глаукомы в странах Европы и Северной Америки состав-ляет по 2 %, в Западной Африке и Латинской Америке — 10 %, в Азии — 5 %, в Восточной Африке — 1 %. В нашей стране, по результатам обследова-ния учащихся специализированных школ-интернатов для слепых и слабо-видящих детей, врожденная глаукома среди причин слепоты составляет
319

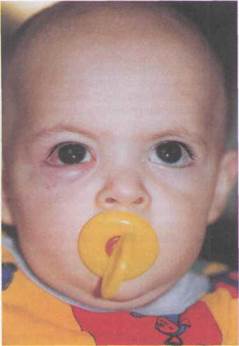
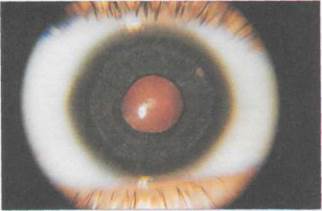
Рис. 2.1. Ребенок с простым гидрофталь-мом (I форма врожденной глаукомы).
4,2 %, слабовидения — 2,2 % [Хвато-ва А.В., 1995]. Среди веей глазной па-тологии у детей в школах для слепых и слабовидящих Европы на долю врожденной глаукомы приходится 18 %. В мире всего около 300 тыс. больных врожденной глаукомой, из них 75 % слепые [Khaw P.T., 1996]. Таким образом, несмотря на редкость этой пато-логии, в структуре слепоты врожденная глаукома занимает значительное место.
|
|
|
Разработка методов диагностики и лечения врожденной глаукомы являет-ся актуальной проблемой офтальмоло-гии. В литературе имеется значительное число работ, посвященных этио-логии, патогенезу, клиническим про-явлениям, диагностике и лечению этой патологии.
Врожденную глаукому рассматрива-ют как группу заболеваний, каждое из которых характеризуется своеобразием клинического и патогистологического
320
проявления. На протяжении многих лет разрабатывались различные классификации врожденной глаукомы [Литвинова М.П., 1956; Клячко М.Л., 1961; Черкасов И.С., 1968; Ковалев-ский Е.И., 1969; 1980; Ерошев-ский Т.И., Токарева Б.А., 1971; Хвато-ва А.В., 1971; Аветисов Э.С., 1975; La-grange Е., 1925; Gallenda R., Matteuc-ci F., 1952]. Классификации, основы-вающиеся на одном признаке, не дава-ли полного представления ни о характере, ни о динамике патологического процесса. Позже были сделаны попыт-ки разграничить течение врожденной глаукомы по стадиям. Разрабатывались критерии, которые в ходе клинических наблюдений уточнялись и тем самым способствовали улучшению ранней диагностики, выбора тактики и метода лечения и прогноза заболева-ния. Наибольшее распространение в нашей стране получила классифика-ция, предложенная в 1987 г. Э.С. Аве-тисовым, Е.И. Ковалевским и А.В. Хватовой, обобщающая вее пре-дыдущие классификации и наиболее полно отражающая характеристику процесса, более объективно определяющая тяжесть заболевания глаза, прогноз и, следовательно, способст-вующая совершенствованию хирургической тактики и улучшению результатов лечения. Различают 3 формы врожденной глаукомы: простая врожденная глаукома — собственно гидро-фтальм (рис. 2.1), глаукома в сочета-нии с аномалиями развития глаза и глаукома в сочетании с системной врожденной патологией. В классификации учитываются происхождение (наследственная и внутриутробная форма), характер изменения угла передней камеры (УПК) (наличне мезодермаль-ной ткани, переднее прикрепление ра-дужки, отсутствие дифференцировки УПК), динамика процесса (стабильная, прогрессирующая). В основу классификации по стадиям положены структурно-анатомические изменения глаза при врожденной глаукоме.
|
|
|
Начальная стадия — глазное яблоко имеет нормальный размер или слегка
 увеличено, длина сагиттальнои оси гла-за и диаметр роговицы превышает возрастную норму не более чем на 2 мм. Имеется легкий отек роговицы; лимб нормальной ширины или расширен до 1 мм. Передняя камера нормальной глубины или слегка глубже, чем в норме. Зрачковые реакции сохранены.
увеличено, длина сагиттальнои оси гла-за и диаметр роговицы превышает возрастную норму не более чем на 2 мм. Имеется легкий отек роговицы; лимб нормальной ширины или расширен до 1 мм. Передняя камера нормальной глубины или слегка глубже, чем в норме. Зрачковые реакции сохранены.
|
|
|
Развитая стадия — длина сагиттальнои оси глаза превышает возрастную норму на 3—4 мм, диаметр роговицы — на 3 мм. На роговице складки и разрывы задней пограничной пластин-ки, расширение лимба до 2 мм, передняя камера углублена, радужка атро-фична, зрачок несколько расширен, реакция на свет ослаблена.
Далеко зашедшая стадия — длина сагиттальнои оси глаза превышает возрастную норму на 5 мм и более, диаметр роговицы — на 4 мм и более. Разрывы и складки задней пограничной пластинки, расширение лимба более 3 мм, истончение и растяжение склеры. Передняя камера глубокая, радужка атрофичная, зрачок чаще расширен, реакция его на свет вялая.
Почти абсолютная стадия — глаз-г ное яблоко резко увеличено (бу-фтальм), склера растянута, истончена, роговица растянута, с дистрофическими изменениями; имеются стафиломы склеры в области лимба. Передняя камера глубокая, радужка атрофичная, зрачок широкий.
Абсолютная стадия — те же анатомические изменения, что и при почти абсо-лютной стадии, но зрение отсутствует.
|
|
|
Каждая стадия в свою очередь поде-лена на группы в соответствии с внутриглазным давлением (ВГД): глаукома с компенсированным и некомпенси-рованным ВГД. Компенсированной считается глаукома, при которой ВГД не превышает 23 мм рт.ст. в начальной
|
|
стадии заболевания и 21 мм рт.ст. в более поздних стадиях, некомпенсиро-ванной — при ВГД соответственно более 23 мм рт.ст. и более 21 мм рт.ст. [Аветисов Э.С., Ковалевский Е.И., Хватова А.В., 1987; Сидоров Э.Г., Мирзаянц М.Г., 1991]. Общепринятым считается, что сим-
21-972
птомы врожденной глаукомы второй и третьей форм появляются чаще на вто-ром десятилетии жизни ребенка. Од-нако, по нашим данным, у довольно большого числа детей (55,6 %) первые признаки глаукомы возникают в более раннем возрасте (до 6 лет).
Этиология. Известно, что врожденная глаукома может быть наследственной или возникает в результате воздей-ствия на плод различных неблагопри-ятных факторов [Хватова А.В., 1995; Ковалевский Е.И. и др., 1996; Russel-Eggitt I., Lightman S., 1992]. Определен-ное значение в этиологи и врожденных изменений глаза имеют инфекционные заболевания матери во время беременности (грипп, паротит, полиомиелит, токсоплазмоз) [Клячко М.Л., 1961; Аветисов Э.С. и др., 1987; Shilds B.M., 1992]. Подтверждена роль вируса краснухи и цитомегаловируса в развитии врожденной глаукомы. Воздействие вирусов вызывает мальформации перед-него отрезка глаза, что в дальнейшем приводит к развитию глаукоматозного процесса [Russel-Eggitt I., Lightman S., 1992]. Помимо инфекционных агентов, большое значение придают алиментар-ным факторам (гипо- и авитаминозы), эндокринным нарушениям, интокси-кациям, внешним физическим и химическим факторам [Клячко М.Л., 1961; Аветисов Э.С. и др., 1987; Kwitko M.L., 1973]. Высказано предположение о взаимосвязи метаболических наруше-ний и глаукомы. Имеются сообщения о случае сочетания гидрофтальма с арги-нинемией — редком врожденном забо-левании, вызываемом дефицитом аргиназы, и о налични врожденной глаукомы у больного с гомоцистинурией [Sac-са S. et al., 1995].
Идентификация и характеристика соответствующих генов обусловливают новый взгляд на патогенез глаукомы в целом. Ряд работ посвящен генетическим исследованиям при врожденной глаукоме в частности при ювенильной глаукоме. Выявлена зависимость меж-ду наследуемой по аутосомно-рецес-сивному типу врожденной глаукомой у цыган и тяжелым злокачественным ти-
321

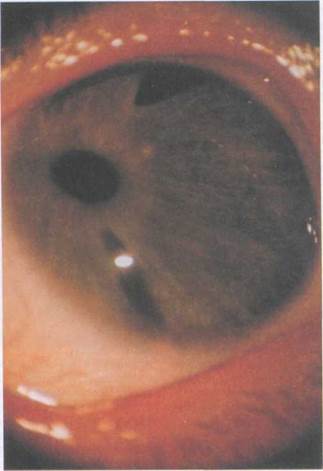
Рис. 2.2. Синдром Ригера: мезодермальныи дисгенез радужки и роговицы, врожденная глаукома (II форма).
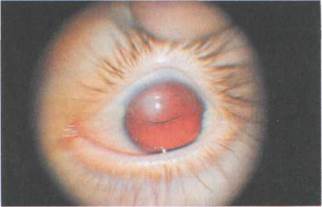
Рис. 2.3. Синдром Аксенфельда: аниридия, эктопия хрусталика, врожденная глаукома (II форма).
322
|
|
Рис. 2.4. Синдром Франка—Каменецкого, врожденная глаукома (II форма).
пом ее течения [Gerinec A., 1995]. Описана врожденная глаукома с высоким прикреплением радужки с аутосомно-до-минантным типом насле-дования, проявляющаяся в возрасте от 11 до 20 лет [Cernea P., Preotecisa D., 1995]. Подтверждено, что ген, ответственный за развитие ювенильной глаукомы с аутосомно-доминантным типом наследования, локализуется на определенном участке длинного плеча хромосомы 1 [Gerinec A., 1995; Morissette J. et al., 1995].
Одним из направлений научных ис-следований явилось изучение клинических и генетических особенностей разных форм врожденной глаукомы.
Известно, что при наследственных формах заболевания часто наблюдают-ся различные аномалии глаза в сочета-нии с изменениями других органов и систем [Megarbane A. et al., 1997]. В литературе последних лет имеются опи-сания случаев сочетания врожденной глаукомы с другими аномалиями глаза — при синдромах Ригера (рис. 2.2), Аксенфельда (рис. 2.3), Франка—Каменецкого (рис. 2.4), аномалии Петер-са (рис. 2.5), склерокорнеа. Среди представленных теорий патогенеза этих состояний особое внимание уде-лено аномалии клеток нервного гребешка в процессе эмбриогенеза [HolmstromG.H.etal., 1991; Ginter M., Krawczynski M., 1994]. Высказано предположение о том, что аномалия Петерса, синдромы Ригера, Аксенфельда могут быть фенотипическими проявлениями одного гена [Do-ran R.M.L., 1991; Ginter M, Krawczynski М., 1994]. Врожденный эктропион радужки является редкой непрогресси-рующей аномалией, характеризую-щейся наличнем листка пигментного
эпителия радужки на передней ее поверхности, передним прикреплением радужки, дисгенезом дренажной зоны угла передней камеры. Это одностороннее патологическое изменение редко передается по наследству. Пред-ставлены случаи сочетания этой аномалии с врожденной глаукомой [Stefanikowa E., 1994; Dietlein T.S. etal., 1998]. Описано сочетание эктропиона радужки с глаукомой и витреорети-нальной дегенерацией [Dietlein T.S. et al., 1998]. Аномальная миграция кле-
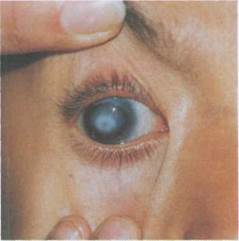
Рис. 2.5. Аномалия Петерса: центральное помутнение роговицы, иридокорнеаль-ные сращения, врожденная глаукома (II форма).
21'
323
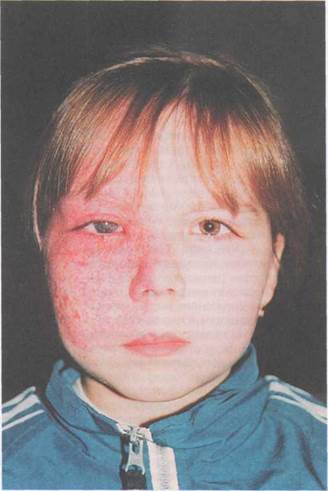
 ток нервного гребешка предположи-тельно приводит к недоразвитию структур переднего отрезка глаза, в том числе структур угла передней камеры, а также, возможно, и заднего сегмента глаза. Реже встречается сочетание врожденной микрокории с ми-опией и глаукомой. На основе выявле-ния статистически достоверной зависимости между микрокорией, миопией и глаукомой высказано предположение об отсутствии случайности в этом сочетании [Toulemont P. et al., 1995]. Глаукома может сочетаться с некото-рыми факоматозами; чаще это наблю-дается при синдроме Стерджа—Вебе-ра—Краббе (рис. 2.6) и болезни Рек-лингхаузена [Koraszewska-Matuszew-ska В. et al., 1994]. Проведено тщательное исследование таких проявлений синдрома Стерджа—Вебера—Краббе, как гемангиома, глаукома и неврологические нарушения. Частота случаев глаукомы при этом синдроме состави-ла 60 %. Первые признаки глаукомы проявлялись в возрастном диапазоне от рождения до 41 года [Sujansky E., Conradi S., 1995]. В работе A. Foster и С. Gilbert (1992) описани случаи двустороннего глаукоматозного процесса у больных с синдромом Стерджа—Вебера—Краббе с односторонней капил-лярной гемангиомой лица. В связи с этим рекомендовали динамическое наблюдение и тщательное обследование обоих глаз. Учитывая редкость этих форм глаукомы, описание их пред-ставляет значительный интерес с точ-ки зрения диагностики и выбора тактики лечения.
ток нервного гребешка предположи-тельно приводит к недоразвитию структур переднего отрезка глаза, в том числе структур угла передней камеры, а также, возможно, и заднего сегмента глаза. Реже встречается сочетание врожденной микрокории с ми-опией и глаукомой. На основе выявле-ния статистически достоверной зависимости между микрокорией, миопией и глаукомой высказано предположение об отсутствии случайности в этом сочетании [Toulemont P. et al., 1995]. Глаукома может сочетаться с некото-рыми факоматозами; чаще это наблю-дается при синдроме Стерджа—Вебе-ра—Краббе (рис. 2.6) и болезни Рек-лингхаузена [Koraszewska-Matuszew-ska В. et al., 1994]. Проведено тщательное исследование таких проявлений синдрома Стерджа—Вебера—Краббе, как гемангиома, глаукома и неврологические нарушения. Частота случаев глаукомы при этом синдроме состави-ла 60 %. Первые признаки глаукомы проявлялись в возрастном диапазоне от рождения до 41 года [Sujansky E., Conradi S., 1995]. В работе A. Foster и С. Gilbert (1992) описани случаи двустороннего глаукоматозного процесса у больных с синдромом Стерджа—Вебера—Краббе с односторонней капил-лярной гемангиомой лица. В связи с этим рекомендовали динамическое наблюдение и тщательное обследование обоих глаз. Учитывая редкость этих форм глаукомы, описание их пред-ставляет значительный интерес с точ-ки зрения диагностики и выбора тактики лечения.
Врожденная глаукома как проявление синдромных заболеваний других органов и систем выявлена при синдроме Ротмунда—Томсона, характери-зующемся инфантильной пойкилодер-мией, гипогонадизмом, поражением скелета, а также при синдроме Ларсена в сочетании с множественным поражением суставов и низким ростом [Kwit-ko M.L., 1973; Bane M.C., Birch E.E., 1992]. При синдроме «ЗС» (краниоце-беллокардиальная дисплазия) с ауто-сомно-рецессивным типом наследова-
324
ния глаукома описана впервые [Sarai-va J.M. et al., 1995]. Впервые врожденная глаукома была диагностирована при синдроме Стиклера, проявляю-щемся прогрессирующеи артропатиеи, дефектами развития лицевого черепа и неба, нейросенсорной тугоухостью, прогрессирующеи миопией, витреоре-тинальной дегенерацией, отслойкой сетчатки [Ziakas N.G. et al., 1998]. Опи-саны редко встречающиеся случаи со-четания врожденной глаукомы и синдрома Рубинштейна—Таейби, прояв-лениями которого являются эпикан-тус, патология слезных путей, птоз, страбизм, макрокорнеа, микрофтальм, колобомы радужки и диска зрительно-го нерва, катаракта. При этом гонио-скопически выявлено частично высокое прикрепление радужки [Quaran-ta L., QuarantaC, 1998].
Патогенез. В настоящее время боль-шинство авторов считают, что патогенез врожденной глаукомы неоднозначей [Шикунова Р.П. и др., 1979; Еро-шевский Т.И., Шикунова Р.П., 1985; Ковалевский Е.И., Хватова А.В., 1987; Сидоров Э.Г., Мирзаянц М.Г., 1991; Хватова А.В., 1995; Hoskins H.D. et al., 1984; Khaw P.T. et al., 1999]. В основе этого заболевания лежат врожденные аномалии УПК и дренажной системы глаза, возникающие в результате за-держки в развитии и дифференциации этих структур и создающие препятст-вия оттоку внутриглазной жидкости или в значительной степени затруд-няющие его, что приводит к повыше-нию ВГД [Ерошевский Т.И., Токарева Б.А., 1971; Сидоров Э.Г., Мирзаянц М.Г., 1991; Хватова А.В., 1995; Нестеров А.П., 1995; Hoskins H.D. et al., 1984]. При исследовани и структур глаза выявлены различные аномалии и изменения, на основании которых предлагались теории механизма развития повышения ВГД при врожденной глаукоме. Наиболее известны следую-щие теории:
Теория мезодермалъных Осташков, или мембранная теория [Barkan 0., 1955], основанная на гониоскопиче-ском обнаружении у больных с гидр-
|
|
Рис. 2.6. Ребенок с синдромом Стерджа—Вебера— Краббе и врожденной глаукомой ( III форма).
офтальмом полупрозрач-ной мембраны (аномально дифференцированной трабекулы), непрони-цаемой для водянистой влаги.
Теория расщепления [Allen L. et al., 1955, 1962; Burian H., 1964], авторы которой видели причину нарушения оттока в не-полном расщеплении УПК и персистирующим спаянии радужки и рес-ничного тела с трабеку-лярным переплетом, a также с неправильной дифференцировкой тка-ней последнего.
Компрессионная теория [MaumeneeA., 1959, 1963, 1964], объясняющая причину ретенции оттока сдавлением склеральной шпоры и трабекулярного переплета прикреплен-ной к последнему рес-ничной мышцей при ее сокращении.
Модифицированиам теория мезодер-малъных остатков [Worst J., 1968], со-гласно которой причиной нарушения оттока водянистой влаги является закрытие УПК персистирующей гребен-чатой связкой, покрытой со стороны передней камеры ультратонкой мембраной.
Обнаруженные аномалии, препятст-вующие оттоку влаги, разнообразны и встречаются в разных сочетаниях: сохранение остатков и эмбриональной ткани в бухте УПК, переднее прикрепление корня радужки, чрезмерное раз-витие гребенчатой связки, заднее положение венозного синуса склеры, его сужение и атрезия, патологическое включение волокон цилиарной мыш-
цы в трабекулу, недоразвитие трабекулы, снижение трабекулярной прони-цаемости [Сидоров Э.Г., Мирза-янц М.Г., 1991; Хватова А.В., 1995]. За-держка в развитии и дифференцировке УПК получила название гониодисге-неза.
Э.Г. Сидоров и М.Г. Мирзаянц (1991) при морфологическом исследо-вании блоков тканей, удаленных при трабекулэктомии, выявили основные аномалии развития УПК и на основа-ний этого разработали классификацию врожденной глаукомы с выделением 3 степеней гониодисгенеза. Существенными признаками гониодисгенеза I степени являлись широкое прикрепление пучков ресничной мышцы к ги-
325
попластичному трабекулярному переплету, относительная сохранность склерального синуса. Гониодисгенез II степени характеризовался выражен-ным трабекулодисгенезом, сочетаю-щимся с передним прикреплением ра-дужки, нарушением топографии синуса и частым его сужением. При гонио-дисгенезе III степени отмечена тяже-лая врожденная патология всех элементов дренажной зоны: переднее прикрепление радужки к измененной трабекуле, резкое сужение склерального синуса.
В последние годы продолжаются гистологические исследования глаза с целью изучения механизмов развития врожденной глаукомы. Для изучения патоморфологии дренажной зоны глаза при глаукоме применяли сканирую-щую электронную микроскопию (световую и трансмиссионную). С помо-щью этой методики изучали трабеку-лярные блоки, полученные во время трабекулэктомии, и описали выявлен-ные аномалии, включающие недораз-витие трабекулярной сети, избыток коллагеновых фибрилл в трабекуляр-ном матриксе, мезенхимальную ткань в УПК [Lin J. et al., 1994]. Интересны-ми представля ются исследования М.Р. Clarke и соавт. (1991) с использованием зеркальной микроскопни рого-вицы, в результате которых выявили уменьшение количества клеток и их полиморфизм в глазах с врожденной глаукомой, чем объяснили развитие декомпенсации роговицы в ответ на подъемы ВГД.
К более раннему периоду относятся работы, посвященные патоморфоло-гическим и биохимическим исследова-ниям у молодых людей с глаукомой [Лукова Н.Б., Святковская Г.Я., 1978; Затулина Н.И., Лукова Н.Б., 1986; Сидоров Э.Г., Перчикова О.И., 1993]. Ав-торы выделяют глаукому молодого возраста как собирательное понятие, включающее ряд нозологических форм, манифестирующих обычно во втором и третьем десятилетиях жизни, и подразделяют ее на открыто- и за-крытоугольную. При световой и элек-
326
тройной микроскопни биоптатов дренажной зоны у молодых пациентов с открытоугольной глаукомой в области наружной стенки венозного синуса склеры выявлен пласт компактной ткани, представленной клетками с тонкими отростками и внеклеточным веществом с аномальным накоплением в ней основных веществ. Возмож-но, эта компактная ткань свидетельствуёт о недоразвитии трабекулы у таких пациентов, что в дальнейшем и вызы-вает повышение ВГД при рано развив-шейся глаукоме [Сидоров Э.Г., Перчикова О.И., 1993].
Некоторые авторы [Лукова Н.Б., Святковская Г.Я., 1978; Затулина Н.И., Лукова Н.Б., 1986] отмечают, что выявленные наряду с врожденной незрелостью дистрофические измене-ния в дренажной зоне аналогичны та-ковым у пожилых людей и характери-зуются дезорганизацией соединитель-ной ткани, включающей вее виды дис-протеинозов. Сделай вывод о том, что при юношеской глаукоме имеют место аномальное развитие трабекулярной системы в виде незрелости коллагеновых структур и гониодисгенеза и явле-ния дистрофии и дезорганизаци и коллагена [Лукова Н.Б., Святковская Г.Я., 1978; Брошевский Т.И., Шикуно-ва Р.П., 1985; Сидоров ЭТ., Перчикова О.И., 1993]. Возможность отклоне-ний в системе соединительной ткани у таких больных находит подтверждение в частом сочетании глаукомы молодого возраста с миопией [Винец-кая М.И., Абдулкадырова М.И., 1984]. Ряд исследователей отмечают, что биохимические сдвиги являются ранними проявлениями дезорганизации соединительной ткани и чаще всего предшествуют изменениям морфологических структур [Лукова Н.Б., Святковская Г.Я., 1978; Шикунова Р.П. и др., 1979; Винецкая М.И., Абдулкады-рова М.И., 1984; Брошевский Т.И., Шикунова Р.П., 1985]. Обнаружено резкое нарушение метаболизма соединительной ткани у молодых больных: содержание оксипролина в крови и моче, а также серомукоида и гексоз-
аминов в сыворотке крови достоверно выше аналогичных показателей у здо-ровых людей. Авторы расценивают па-тологию соединительной ткани как одно из звеньев патогенеза глаукома-тозного процесса. Биохимическим ис-следованиям при гидрофтальме посвя-щены единичные работы.
При исследовании антипротеолити-ческой активности водянистой влаги у больных с врожденной глаукомой ус-тановлена повышенная антитриптиче-ская активность, что может свидетельствовать о роли протеолиза и ингибиторов протеаз в развитии патологического процесса в глазу [Чесноко-ваН.Б. идр., 1988].
Работ, посвященных иммунологическим исследованиям при врожденной глаукоме, в доступной нам отечественной и зарубежной литературе за последние 20 лет не встретилось. Учи-тывая, что во многих работах, касаю-щихся первичной глаукомы, обсужда-ются иммунологические аспекты этой проблемы [Лебедев О.И., 1993; Балашова Л.М., 1997], проведение иммунологических исследовании при врожденной глаукоме явилось интересным и перспективным.
В рамках этой проблемы проведена работа по изучению иммунного статуса у детей, анализа взаимосвязей меж-ду клиническими параметрами глаукомы (форма, стадия, степень компенса-ции), исходом хирургических вмеша-тельств, послеоперационными ослож-нениями и иммунологическими пока-зателями [Теплинская Л.Е. и др., 2000; Теплинская Л.Е. и др., 2002].
Обследовано 97 детей в возрасте от 1 мес до 14 лет с разными формами, стадиями, степенью компенсации и результатами оперативного лечения врожденной глаукомы. Иммунологическое обследование детей включало определение уровня иммуноглобулинов (Ig) классов G, А и М в сыворотке крови и слезной жидкости методов ра-I диальной иммунодиффузии Манчини, ; выявление аутоантител к ДНК (натив-1 ной и денатурированной) и общему | белку миелина (ОБМ) в сыворотке
крови и слезной жидкости с помощью метода иммуноферментного анализа (ИФА). При изучении иммунного статуса у детей с врожденной глаукомой выявлены следующие особенности. Клинические признаки иммуннои не-достаточности выявлены у 62,9 % детей в основном в виде инфекционного синдрома, изолированного или в соче-тании с аллергическим и аутоиммун-ным синдромами (у 60,6 %).
У 36 % обследованных выявлен гу-моральный иммунодефицит, обуслов-ленный преимущественно дефицитом IgA, из них у 30 % селективным или сочетанным. Для оценки клинической значимости гаммапатий в патогенезе, течении врожденной глаукомы и развитии послеоперационных осложне-ний проведен анализ соотношения клинических параметров и показателей гуморального иммунитета.
Установлено, что некомпенсиро-ванная глаукома чаще (49 %) встреча-лась у детей с дефицитом IgA; ранние и поздние послеоперационные ослож-нения (гифема, отслойка сосудистой оболочки, гемофтальм в ранние сроки и рецидив подъема ВГД в отдаленные сроки после операции) также значительно чаще (48 %) выявлялись у детей с селективным или сочетанным дефицитом IgA. При изучении локального иммунного ответа низкое содержание IgA выявлено в 73,7 % глаз, дефицит IgA в обоих глазах — у 50,9 % детей. При оценке клинической значимости выявленнои местной иммуннои недос-таточности определяли взаимосвязь между дефицитом IgA и некомпенси-рованностью глаукомы, исходом оперативного лечения. Отмечено, что полное отсутствие IgA достоверно чаще встречалось у детей с некомпенси-рованным ВГД (61 %), послеоперационными осложнениями (79 %) и неэф-фективностью хирургического вмеша-тельства, обусловившей повторные операции (87 %). Динамические на-блюдения показали, что благоприят-ное течение послеоперационного периода сопровождалось повышением концентраций IgA в слезной жидкости
327
 у 100 % детей; снижение этого показа-теля отмечалось у детей с осложнения-ми (83,3 %).
у 100 % детей; снижение этого показа-теля отмечалось у детей с осложнения-ми (83,3 %).
Анализ полученных данных позво-ляет расценивать гуморальный иммунодефицит как фактор, отягощающий течение глаукомы. Иммунодефицит-ное состояние предрасполагает к более тяжелому течению патологических процессов: в частности, антиглаукома-тозная операция, произведенная на фоне общего дефицита IgA, сопряжена с риском развития послеоперацион-ных осложнений как в ранние сроки, так и в отдаленном периоде. У детей с врожденной глаукомой выявлены иммунопатологические реакции в виде наличня аутоантител (ААТ) к ДНК и ОБМ в сыворотке крови и слезной жидкости.
Наличне ААТ к ДНК в сыворотке крови и слезной жидкости обнаружено у 26 (29,9 %) детей, только в слезной жидкости — у 20 (23 %) детей в 25 (16,6 %) глаз.
Установлени статистически досто-верные корреляционные связи между наличнем ААТ к ДНК и тяжестью те-чения глаукомы, электрофизиологическими изменениями, офтальмоскопической картиной диска зрительного нерва (серый/белый цвет диска, субто-тальная, тотальная экскавация). Уста-новлено также, что среди детей с наличнем ААТ к ДНК достоверно чаще (44,4 %) встречались дети с повторны-ми операциями в анамнезе (3 опера-ции и более). Послеоперационние ос-ложнения в виде отслойки сосудистой оболочки, гифемы, гемофтальма, ири-докорнеальных спаек, рубцевания зоны фистулы и фильтрационной по-душечки чаще (33,3 %) наблюдались у детей с наличнем ААТ к ДНК.
В связи с тем что при глаукоме в значительной степени страдает зри-тельный нерв, изучены аутоиммунные реакции с выработкой ААТ к ОБМ в сопоставлении с отдельными клини-ко-функциональными показателями. Состояние зрительного нерва оцени-вали по остроте зрения, офтальмоскопической картине, данным электро-
328
физиологического исследования,
включающего общую электроретино-графию, ритмическую электроретино-графию и регистрацию зрительных вы-званных потенциалов (ЗВП) в ответ на вспышку (вЗВП) и на паттерны (пЗВП).
Результаты исследования показали наличне ААТ к ОБМ в сыворотке крови и слезной жидкости у 22 (31,8 %) детей. Очень важно, что ААТ к ОБМ обнаруживались у детей без какой-либо общей неврологической симпто-матики. Сопоставление отдельных клинико-функциональных показателей с наличнем ААТ к ОБМ выявило определенные зависимости. Анализ показал, что среди детей с обнаружен-ными ААТ к ОБМ слепота и слабови-дение (острота зрения от 0 до 0,05) от-мечались достоверно чаще, чем у детей с отсутствием ААТ к ОБМ (соответственно 81,8 и 23,7 %). У детей с наличнем ААТ к ОБМ также чаще наблюда-лась выраженная глаукоматозная экскавация: тотальная (рис. 2.7), субто-тальная + серый/белый цвет диска зрительного нерва (соответственно 81,8 и 42,1 % глаз). Выполнение элек-троретинографии по стандартной методике позволило установить патологические изменения у детей с выяв-ленными ААТ к ОБМ достоверно чаще, чем у детей, не имевших ААТ к ОБМ (соответственно 78,9 и 27,6 % глаз).
Таким образом, получениые данные свидетельствуют о том, что у детей с врожденной глаукомой развиваются аутоиммунные реакции с выработкой ААТ к ОБМ даже при отсутствии клинических проявлений какой-либо неврологической симптоматики, что по-зволяет считать наличне ААТ к ОБМ проявлением местного иммунного конфликта с элементами системности в отдельных случаях. При обследова-нии 87 матерей детей с врожденной глаукомой у 59,8 % обнаружены клинические признаки иммунной недос-таточности в виде хронических и ост-рых заболеваний верхних дыхательных путей (15 %), патологии почек
(11,5 %), заболеваний сердца (7 %), бронхолегочной патологии (7 %).
При исследовании гуморального статуса матерей у 32,6 % обследован-ных выявлены изменения в виде дефицита IgA изолированного или сочетан-ного (15,2 %) и повышение уровня IgM (17,4 %). При этом иммунологическая картина у матерей совпадала с показа-телями Ig у детей. Отмечено, что у матерей с пиелонефритом и анемиями дети достоверно чаще имели ААТ к ДНК.
Таким образом, патология у матерей в виде нарушения гуморального иммунитета, хронических и острых заболеваний является фактором риска разви-тия иммунопатологических реакций у детей с врожденной глаукомой.
В результате проведенных исследовании мы можем говорить о том, что дети с врожденной глаукомой иммуно-компрометированы. Плавным образом врожденная глаукома определяется у детей с нарушениями в иммунной системе, которые выражаются общесома-тической и клинической симптоматикой, гуморальным иммунодефицитом, развитием аутоиммунных реакций с выработкой ААТ к ДНК и ОБМ. Опре-делены корреляционные взаимосвязи между клиническими и иммунологическими показателями. Отмечено, что у детей с нарушениями иммунного статуса глаукома проте каёт тяжел ее: достоверно чаще с осложнениями раннего и позднего послеоперационного периода, неэффективностью хирургических вмешательств (3 и более по-вторных операций за 3—5 лет). Иммунопатологические реакций более вы-ражены в глазу с худшим состоянием зрительного нерва и сетчатки. У таких детей глаукома чаще приводит к сле-поте. Мы не можем судить с полной определенностью о причинно-следственной связи между ААТ, в частности к ОБМ, и изменениями зрительного нерва при глаукоме. Вместе с тем вы-явленные нами взаимосвязи между наличнем ААТ и низкой остротой (фак-тически потерей) зрения, выраженной глаукоматозной экскавацией (признак
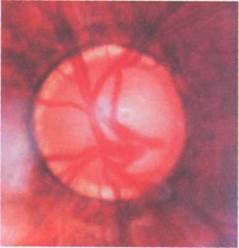
Рис. 2.7. Тотальная глубокая экскавация диска зрительного нерва при далеко за-шедшей врожденной глаукоме.
потенциальной дистрофии волокон зрительного нерва), а также вовлечение в глаукоматозный процесс сетчатки позволяют рассматривать ААТ к ОБМ как фактор, отягощающий течение и прогноз врожденной глаукомы.
Наличне у матерей хронических заболеваний, осложняющих беремен-ность, и иммунологической картины, идентичной иммунологическим пока-зателям у ребенка, подтверждает суще-ствующий взгляд на врожденную глаукому как генетически обусловленную патологию. Выявленные нарушения иммунного статуса требуют внесения корректив в схемы лечения детей с врожденной глаукомой, в частности в тактику предоперационной подготов-ки и ведения послеоперационного периода.
Клиническое течение и диагностика. Врожденная глаукома характеризуется своеобразными клиническими прояв-лениями, обусловленными возрастными особенностями глаз у детей [Еро-шевский Т.И., Токарева Б.А., 1971; Ковалевский Е.И., Хватова А.В., 1987; Сидоров Э.Г., Мирзаянц М.Г., 1991; Хватова А.В., 1995]. При повышении ВГД у детей в связи с эластичностью
329
|
|
 ределить патогенетически ориентированную тактику лечения. Известные работы Т.И. Брошевского, А.В. Хвато-вой, М.М. Краснова, Д.А. Магарамова, В.И. Лакомкина, О. Barkan, J. Worst, посвященные этим исследованиям [цит. по: Аветисов Э.С. и др., 1987], от-носятся к более раннему периоду. Ав-торы выя вил и аномальное развитие или недоразвитие всех структур дре-нажной зоны, характеризующееся пе-редним прикреплением радужхи, отсутствием дифференцировки трабеку-лы, наличнем эмбриональной мезодер-мальной ткани, которые препятствуют оттоку внутриглазной жидкости и за-трудняют его. Исследуя с помощью го-ниоскопии глаза с врожденной глаукомой, Н.С. Agarval и соавт. (1994) под-твердили наличне при этой патологии высокого прикрепления радужки, тра-бекулодисгенеза и эмбриональной ткани в УПК.
ределить патогенетически ориентированную тактику лечения. Известные работы Т.И. Брошевского, А.В. Хвато-вой, М.М. Краснова, Д.А. Магарамова, В.И. Лакомкина, О. Barkan, J. Worst, посвященные этим исследованиям [цит. по: Аветисов Э.С. и др., 1987], от-носятся к более раннему периоду. Ав-торы выя вил и аномальное развитие или недоразвитие всех структур дре-нажной зоны, характеризующееся пе-редним прикреплением радужхи, отсутствием дифференцировки трабеку-лы, наличнем эмбриональной мезодер-мальной ткани, которые препятствуют оттоку внутриглазной жидкости и за-трудняют его. Исследуя с помощью го-ниоскопии глаза с врожденной глаукомой, Н.С. Agarval и соавт. (1994) под-твердили наличне при этой патологии высокого прикрепления радужки, тра-бекулодисгенеза и эмбриональной ткани в УПК.
Особое значение для диагностики имеет адекватная оценка функцио-нального состояния органа зрения, ко-торая затруднена у маленьких детей. Именно поэтому предложенные клас-сификации врожденной глаукомы у детей основаны на показателях струк-турно-анатомических изменений глаза, характерных для этого заболевания (сдвиг возрастных биометрических норм, происходящих под влиянием повышенного ВГД на разных стадиях заболевания). В каждой из групп, сформированных по структурно-анатомическим признакам, отмечена значительная вариабельность функцио-нальных показателей, которые меня-ются по мере развития и роста ребенка. Применение большинства методов исследования зрительных функций в детской практике, особенно у детей раннего и младшего возраста, затруднительно, а часто и невозможно, по-скольку требуёт словесного ответа. В связи с этим при исследовании органа зрения у детей особое значение приобретают объективные электрофизиологические методы. Электрофизиологические исследования позволяют ! на каждой стадии болезни более тонко
охарактеризовать степень поражения сетчатки и зрительного нерва, а также могут служить критерием для оценки компенсации и прогнозирования глау-коматозного процесса. Выявлено по-градиентное снижение биоэлектрической активности наружных и внутренних слоев сетчатки [Хватова А.В. и др., 1975] по мере прогрессирования глау-коматозного процесса у детей, что от-ражается на снижении частотных и ам-плитудных характеристик общей элек-троретинограммы — ЭРГ [Хватова А.В. и др., 1975; Яковлев А.А., Хватова А.В., 1993; Khvatova A.V. et al., 1979]. Л.И. Фильчикова и соавт. (1988, 1992) изучили характер изменения амплитуды пЗВП при разных стадиях болезни и показали, что в ранние сроки вначале страдают толстые аксоны ганглиозных клеток, что выражается в снижении кортикальнего ответа на крупные стимулы, а затем при вовле-чении в патологический процесс X-ганглиозных клеток уменьшается амплитуда пЗВП и в ответ на меньшие стимулы [Фильчикова Л.И. и др., 1992; Фильчикова Л.И., Мосин И.М., 2001]. Особое значение это имеет для оценки функционального состояния органа зрения у детей после антиглаукоматоз-ной операции.
Для объективной оценки функционального состояния сетчатки и зрительного пути у детей с врожденной глаукомой используют электрофизиологические методики (рис. 2.9): общую электроретинографию, ритмическую электроретинографию, вЗВП и пЗВП. При этом применяют компьютерную систему, позволяющую выделять из шума потенциалы малой величины, использовать усреднение и нивелиро-вать различные артефакты.
В качестве активных электродов при регистрации ЭРГ используют серебря-ные электроды в виде крючков, которые фиксируют на нижнем веке паци-ента. Электроды накладывают на фоне местной анестезии (двукратная ин-стилляция проксилитакаина или 1 % раствора дикаина), поверхность рого-вицы защищают ионопроводящим
331
 |

0,5 % раствором метилцеллюлозы. Ре-ферентный электрод крепят на сосце-видном отростке или на мочке уха, за-земляющий — на лбу или на противо-положной мочке уха. При наложении электрода кожу предварительно очи-щают и наносят электропроводящую пасту; при этом электрическое сопротивление не должно превышать 10 кОм. Длина волны стимулирующего света должна быть в пределах видимо-го спектра. Фотостимулятор распола-гают на расстоянии 30 см от глаза; энергия лампы должна составлять 0,3 Дж, длительность вспышки — 50 мкс с частотой от 0,2 до 2,0 Гц. Для регистрации палочкового ответа при-меняют темноватую адаптацию в течение не мёнее 20 мин. Для подавления функции палочковой системы и выде-ления колбочковой используется фо-новое освещение 27—34 кд/м2. Элек-тронная регистрирующая система должна состоять из усилителя и пред-усилителя с фильтрами 0,3—300 Гц; для усреднения используют не мёнее 20—50 реакций.
Рис. 2.9. Электрофизиологическое обследование детей в состоянии бодрство-вания и медикаментозного сна с использованием компьютерного электрофизиологического комплекса «Нейро-МВП-2» (Россия).
Для записи ритмической ЭРГ, как при общей ЭРГ, используют метод наложения отводящих электродов. Ритмический ответ на вспышку (белого или красного света, частота 30 Гц) ре-гистрируется при фоно-вом освещении, подав-ляющем палочковую ак-тивность (27—34 кд/м2); для усреднения используют не мёнее 64—100 реакций.
При анализе ЭРГ оце-нивают негативную а-волну и пози-тивную b-волну. Амплитуду а-волны измеряют от изолинии до ее пика, амплитуду b-волны — от пика а-волны до пика b-волны. Латентность а-волны вычисляют от начала светового стимула до пика а-волны, латентность b-волны — от начала светового импульса до пика Ь-волны.
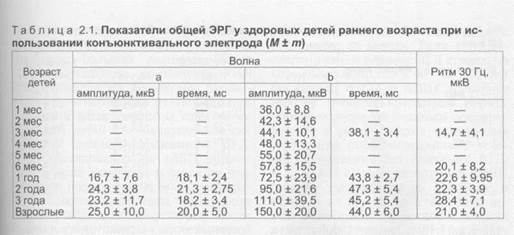
Оценивая результаты исследования, необходимо учитывать возрастные нормы ЭРГ [Шубина Н.Ю., 1998; Яковлев А.А. и др., 1998]. В табл. 2.1 приведены результаты обследования на компьютерном электрофизиологическом комплексе «Нейро-МВП-2» (Россия) на базе IBM PC с монитором VGA с использованием оригинальной программы, написанной в среде DOS и Windows на языке Паскаль (регист-рационный номер 98/219-1998).
Исследование проводят как во вре-мя бодрствования ребенка, так и в состоянии медикаментозного сна. Ребенок должен быть спокоен и фиксиро-вать взгляд на предъявляемых стимулах. Контроль за фиксацией взгляда
332
|
|
осуществляет лаборант. При регистра-ции ЗВП активный электрод (карбо-новые чашечки) помещают на 1,5— 2 см выше затылочнего бугра по сред-ней линии над областью проекции зрительной зоны. Для лучшего контакта используют электропроводный гель с предварительной обработкой кожи абразивной пастой. Индифферентный электрод помещают на мочке уха, за-земляющий электрод — на противопо-ложной мочке уха или на фронтальной части скальпа. В качестве стимулов для регистрации вЗВП используют оди-ночные ве пышки белого света частотой 0,5 Гц с расстояния 30 см; энергия лампы должна составлять 0,3 Дж. Для записи пЗВП используют шахматные реверсивные паттерны, предъявляе-мые с экрана монитора, находящегося на расстоянии 1 м от глаз обследуемо-го. Размер ячеек 7', 12', 20', 40', 60' и 100', освещенность 90 лк, уровень контраста 80 %. Стимулы предъявляют монокулярно, усреднение составляет 64—100 ответных реакций. Анализ ЗВП начинают с идентификации компонентов: наиболее вариабельного N75 при регистрации пЗВП или N1 при регистрации вЗВП и наиболее ус-тойчивого компонента Р100 (пЗВП) | или Р2 (вЗВП). При анализе ЗВП учи-| тывают конфигурацию компонентов, их амплитуду в микровольтах, которую вычисляют от изолинии или от преды-| душего пика противоположной полярности (от пика до пика) и пиковую ла-
тентность — время в миллисекундах от момента предъявления стимула до пика Р100.
При интерпретации данных, полу-ченных при регистрации ЗВП, также необходимо учитывать возрастной фактор [Шамшинова A.M., Волков В.В., 1998; Яковлев А.А. и др., 1998; Bane М.С., Birch E.E., 1992; Kriss A., Russell-Eggitt J., 1992]. B nep-вые месяцы жизни ребенка параметрические характеристики вЗВП быстро меняют свои характеристики, достигая к 6 мес показателей у взрослых.
При обследовании на компьютер-ном электрофизиологическом комплексе «Нейро-МВП-2» (Россия) ла-тентность компонента Р1 при регистрации вЗВП у здоровых детей в возрасте 1 мес составляла 194,9 ±11,3 ме,
2 мес — 171,3 + 29,3 ме, 3 мес —
129,6 ±35,8 ме, 4 мес - 103,7 +
±12,0 ме, 5 мес - 93,2 ±4,1 ме,
6 мес — 90,4 ± 8,3 ме.
Чувствительность к структурированным элементам при регистрации пЗВП меняется следующим образом: в первые 1—2 мес регистрируется ответ только на шахматные паттерны с большим размером ячеек (100—60'), к 6 мес постепенно появляется ответ на ячейки размером от 40 до 12'. При этом ла-тентность компонента Р100 пЗВП (размер ячейки 100') у здоровых детей в возрасте 1 мес составляла 229,1 ± ±22,6 ме, 2 мес - 203,8 ± 44,7 ме,
3 мес — 145,2 ±31,8 ме, 4 мес —
333
|
|
138,7 ± 21,4 ме, 5 мес - 109,4 ± 5,8 ме, 6 мес — 105,7 ±4,4 ме.
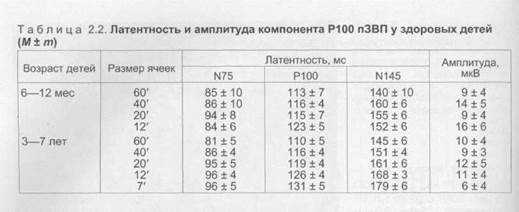
Показатели для более старших детей приведени в табл. 2.2.
Электроретинография. Во всех ста-диях врожденной глаукомы, кроме аб-солютной, у больных, обследованных в сроки не более 2 мес в ранних и не бо-лее 1 мес в поздних стадиях болезни, регистрируется увеличение амплитуды b-волны по сравнению с возрастной нормой. Значение b-волны в началь-ной стадии заболевания превышают норму на 30—40 %, в развитой — на 40—60 %, в далеко зашедшей — на 50—70 %, в почти абсолютной — на 60—80 %. Амплитуда ритмической ЭРГ в начальной стадии болезни пре-вышает верхнюю границу возрастной нормы на 10—20 %, в почти абсолютной стадии — на 40—50 %. Если имеет-ся длительный период повышения ВГД, то показатели ЭРГ и ритмической ЭРГ уменылаются, поскольку период повышенного электрогенеза сет-чатки заканчивается и наступает фаза процесса, при которой биоэлектрическая активность нейрональных струк-тур сетчатки снижается.
После хирургической нормализации ВГД в 1-ю неделю после операции амплитуда b-волны резко уменьшается: на 10—30 % ниже возрастной нормы в начальной стадии и на 70—90 % в почти абсолютной. При стабильно ком-пенсированном ВГД амплитудные характеристики ЭРГ и ритмической ЭРГ в начальной стадии болезни восста-навливаются в течение 1 года до воз-
растных норм; в развитой стадии амплитуда в-волны ЭРГ остается ниже возрастной нормы на 10—40 %, в далеко зашедшей — на 20—50 %. Восстановление показателей в этих стадиях болезни протекает более длительно, особенно у детей, оперированных в поздние сроки.
Амплитуда ритмической ЭРГ имеет корреляцию с показателями ЭРГ и уменьшается от 10 % в развитой до 50 % в почти абсолютной стадии.
В почти абсолютной стадии величина позитивного компонента Ь-волны только частичне восстанавливается, оставаясь на 30—50 % ниже возрастной нормы.
В абсолютной стадии врожденной глаукомы амплитуда b-волны ЭРГ не превышает 10 мкВ ритм, а РЭРГ — 5 мкВ независимо от офтальмотонуса. В этой группе детей не выявлено уве-личения амплитудных характеристик ЭРГ и ритмической ЭРГ, видимо, из-за скоротечности процесса и обсле-дования в поздние сроки заболевания.
Анализ результатов, получениых после обследования детей с разными ста-диями заболевания в динамике, пока-зал, что под воздействием повышенного ВГД сетчатка проходит несколько стадии нейрональной активности.
Зрительные вызванные потенциалы. У детей с начальной стадней врожденной глаукомы имеются изменения как амплитуды, так и латентности позитивного компонента Р100 пЗВП и вЗВП.
В начальной стадии заболевания
334
выявляются более выраженные изме-нения пЗВП, в частности в ответ на паттерны больших размеров (60 и 100'); латентность компонента Р100 увеличивается на 10—30 ме. Максимальные отклонения от нормальных значений регистрируются при обсле-довании детей со значительным периодом некомпенсированнего ВГД. При обследовании на вЗВП латентность чаще находится в пределах возрастной нормы или на ее верхней границе. Экскавация диска зрительного нерва у этих детей отсутствует. После оперативного лечения и стабильной компенсации ВГД показатели ЗВП в течение 1 года восстанавливаются до нормальных значений.
При обследовании детей с развитой стадней болезни выявлены более выраженные изменения латентности компонента Р100. Экскавация диска зрительного нерва в этой группе со-ставляет Э/Д = 0,2—0,5. Увеличение латентности Р100 в этой стадии болезни на паттерны 100' составляет 15— 40 ме, 20' — 10—30 ме. При регистра-ции вЗВП отмечают мёнее выраженные отклонения от нормы, и увеличение латентности не превышает 10— 30 ме. После стабильной нормализаци и ВГД глаукоматозная экскавация уплощается и в ряде случаев исчезает. На этом фоне происходит восстановление показателей ЗВП, и латентность в ряде случаев достигает нижней гра-ницы нормы.
Далеко зашедшая стадия врожденной глаукомы характеризуется значительным разбросом показателей; опре-деленное значение имеют сроки выявлен ия заболевания и разный уровень ВГД. Экскавация диска зрительного нерва в этой стадии заболевания составляет Э/Д = 0,5—0,9. Увеличение латентности компонента Р100 в этой группе больных в ответ на шахматные паттерны 100' и 60' составляет 30— 70 ме, на 20' — 20—70 ме. Латентность вЗВП возрастает с 20 до 70 ме. Эти показатели коррелируют со сроками вы-явления заболевания, и при повышенном в течение длительного времени
ВГД латентность имеет максимальное отклонение от нормы. Если в послеоперационнем периоде ВГД стабильно компенсировано, то у 40—46 % детей показатели пЗВП и вЗВП достигают нижней границы возрастной нормы. Это характерно для больных, опериро-ванных в ранние сроки и имеющих стабильное послеоперационное течение заболевания без подъемов ВГД. В 30—34 % случаев латентность пЗВП остается увеличенной на 20—50 ме, a вЗВП - на 13-42 ме. У 20-30 % детей, имеющих повышенное в течение длительного времени ВГД, в послеоперационнем периоде латентность остается значительно увеличенной.
В почти абсолютной и абсолютной стадиях болезни экскавация диска зрительного нерва у детей с врожденной глаукомой тотальная или субто-тальная. Биоэлектрического ответа на стимуляцию реверсивными шахмат-ными паттернами у этой группы больных не регистрируется. Стимуляция вспышками света в ряде случаев выяв-ляет появление позитивного компонента сниженной амплитуды при латентности 170—180 ме, что значительно превышает норму и свидетельствуёт о нарушении проведения по зритель-ному пути. В послеоперационном периоде при нормализации ВГД ампли-тудно-временные показатели вЗВП у этих больных не восстанавливаются.
Таким образом, у детей с врожденной глаукомой в период повышения ВГД и растяжения оболочек глаза вна-чале происходит повышение биоэлектрической активности ретинальных нейронов, которое потом сменяется снижением их активности. Субнор-мальные значения показателей ЭРГ при врожденной глаукоме свидетель-ствуют о наступлении фазы угасания электрогенеза сетчатки, что является неблагоприятным прогностическим признаком. Отсутствие повышения биоэлектрической активности сетчатки в послеоперационном периоде, особенно на ранних стадиях заболевания, может свидетельствовать о непол-ной компенсации ВГД, требующей ме-
335
дикаментозной или повторной опера-тивной коррекции. С каждой последующей стадней болезни электрогенез сетчатки снижается, и в каждой стадии разброс значений прямо пропорционалей срокам выявления и своевре-менности стабилизации глаукоматоз-ного процесса. Уровень увеличения латентности пЗВП и вЗВП коррелирует со стадией заболевания и продолжи-тельностью периода некомпенсиро-ванного ВГД. Наиболее чувствительным методом на ранних стадиях болезни является регистрация ЗВП в ответ на крупные структурированные стимулы, которые преимущественно отра-жают состояние толстых аксонов ганг-лиозных клеток сетчатки. В развитой и далеко зашедшей стадиях наравне со структурированными стимулами диаг-ностически значимыми становятся показатели вЗВП. Стабилизация и восстановление показателей ЗВП в послеоперационнем периоде свидетельству-ют о стойкой компенсации глаукома-тозного процесса.
Комплексная оценка органа зрения у ребенка с применением электрофизиологических методов исследования позволяет с большей точностью диаг-ностировать врожденную глаукому в ранние сроки, прогнозировать функ-циональные результаты, использовать данные электрофизиологических исследовани й для контроля компенсации глаукоматозного процесса и мониторинга течения заболевания у детей в послеоперационном периоде.
Лечение. Известно, что лечение при врожденной глаукоме в основном опе-ративное. Только хирургическими методами возможно устранить препятст-вия оттоку внутриглазной жидкости, создаваемые различными структурны-ми аномалиями дренажной зоны. В течение многих лет, начиная с 1938 г., широко применяли гониотомию — па-тогенетически ориентированную опе-рацию, направленную на устранение эмбриональной мезенхимальной ткани в углу передней камеры. Однако в связи с тем, что в глазах с врожденной глаукомой, кроме эмбриональной тка-
336
ни, выявляли недоразвитие всех струк-тур дренажной зоны, показания к го-ниотомии сузились, круг операций значительно расширился. В последние годы активно обсуждаются различные методики оперативного лечения при врожденных глаукомах, основными из которых являются трабекулотомия, трабекулэктомия, комбинированная методика (трабекулотомия + трабекулэктомия), гониотомия [Аветисов Э.С. и др., 1987; Хватова А.В., 1995; Лаком-кин В.И., Рузметова Н.Х., 1996; Хватова А.В., Арестова Н.Н., 1997]. В неко-торых случаях гониотомия оказывает-ся эффективной и даёт хорошие результаты. По данным отдела патологии глаз у детей Московского НИЙ глазных болезней им. Гельмгольца, в отдаленные сроки после гониотомии с го-ниопунктурой компенсация ВГД была достигнута у 89,9 % оперированных [Лакомкин В.И., Рузметова Н.Х., 1996]. В ряде клиник эта операция широко используется [Shaffer R.N., 1992; Russel-Eggitt I., 1995], однако выполнение гониотомии осложняет наличне помутнения роговицы при врожденной глаукоме. Трабекулотомия ab externo не требуёт прозрачности роговицы [Gloor B.R., 1998], поэтому неко-торые авторы высказываются в под-держку этого вмешательства [Sun X.H. et al., 1994]. По их данным, процент эффективности трабекулотомии за пе-риод наблюдения 15 мес составил от 73,9 до 86,4. Получены разные результаты, высказываются разные мнения относительно комбинированной операций. Отдельные авторы [Mandal A.K. et al., 1995] достигли положительных результатов в 86,2 % случаев при периоде наблюдения от 6 мес до 2 лет и считают эту методику операцией выбора. Некоторые исследователи [Elder M.J., 1994] отмечают, что результаты комбинированной операций и обычной трабекулэктомии примерно одинаковы: 93,5 % при периоде наблюдения 2 года. Замечено, что результаты, полученные в специализированных центрах детской офтальмохи-рургии, лучше, чем в клиниках общего
 профиля. При анализе результатов оперативного лечения врожденных глауком в арабских регионах за 5 лет выявлены невысокие результаты в клиниках общего профиля: положи-тельный эффект гониотомии состав-лял 20 %, трабекулотомии — 35 %, тра-бе кул эктомии — 55 % [Elder M.J., 1993]. В настоящее время наиболее предпочитаемой операцией является трабекулэктомия [Хватова А.В., Бутке-вич CO., 1994; Хватова А.В., Аресто-ва Н.Н., 1997; Нурмамедов Н.Н., 1998; FulcherN.etal., 1996; Khaw P.T., 1996], предложенная в 1968 г. Cairns и в даль-нейшем модифицированная рядом ав-торов. М.Е. Turach и соавт. (1995) от-метили положительный эффект трабе-кулэктомии в короткие сроки наблю-дения у 84 % оперированных, в отдаленные сроки — у 76 %. Гипотензив-ный эффект операции, по данным А.В. Хватовой и CO. Буткевич (1994), в раннем послеоперационном периоде составил 97,5 %, в отдаленные сроки — 83,3 %. Некоторые авторы [Fulcher N. et al., 1996], считающие трабекулэкто-мию операцией выбора, представляют иные данные: за 5-летний период на-блюдения процент успеха у больных с гидрофтальмом составил 92,3, у больных с сочетанной с глаукомой патоло-гией органа зрения и других органов и систем — 85,7. Разработаны различные модификации операции трабекулэкто-мии и трабекулотомии [Качан Н.А., 1997; Тойкулиев Т.К., Качан Н.А., 1997]. Единичные работы посвящены использованию дренажей, способст-вующих повышению эффективности оперативного лечения при глаукоме [Канюков В.Н. и др., 1997; Zacha-ria P.T. et al., 1998]. Применение дренажа из гидрофильного гидрогеля по-зволило достигнуть стабильной норма-лизации давления у 70 % детей [Кады-мова Ф.Э., 1997]. Представлены работы по использованию клапанных дренажей Ahmed, Molteno у детей с раз-ными формами глаукомы, в том числе с гидрофтальмом и врожденной глаукомой при аномалии Петерса в возрасте от 1 нед до 10 лет, с одновременным
профиля. При анализе результатов оперативного лечения врожденных глауком в арабских регионах за 5 лет выявлены невысокие результаты в клиниках общего профиля: положи-тельный эффект гониотомии состав-лял 20 %, трабекулотомии — 35 %, тра-бе кул эктомии — 55 % [Elder M.J., 1993]. В настоящее время наиболее предпочитаемой операцией является трабекулэктомия [Хватова А.В., Бутке-вич CO., 1994; Хватова А.В., Аресто-ва Н.Н., 1997; Нурмамедов Н.Н., 1998; FulcherN.etal., 1996; Khaw P.T., 1996], предложенная в 1968 г. Cairns и в даль-нейшем модифицированная рядом ав-торов. М.Е. Turach и соавт. (1995) от-метили положительный эффект трабе-кулэктомии в короткие сроки наблю-дения у 84 % оперированных, в отдаленные сроки — у 76 %. Гипотензив-ный эффект операции, по данным А.В. Хватовой и CO. Буткевич (1994), в раннем послеоперационном периоде составил 97,5 %, в отдаленные сроки — 83,3 %. Некоторые авторы [Fulcher N. et al., 1996], считающие трабекулэкто-мию операцией выбора, представляют иные данные: за 5-летний период на-блюдения процент успеха у больных с гидрофтальмом составил 92,3, у больных с сочетанной с глаукомой патоло-гией органа зрения и других органов и систем — 85,7. Разработаны различные модификации операции трабекулэкто-мии и трабекулотомии [Качан Н.А., 1997; Тойкулиев Т.К., Качан Н.А., 1997]. Единичные работы посвящены использованию дренажей, способст-вующих повышению эффективности оперативного лечения при глаукоме [Канюков В.Н. и др., 1997; Zacha-ria P.T. et al., 1998]. Применение дренажа из гидрофильного гидрогеля по-зволило достигнуть стабильной норма-лизации давления у 70 % детей [Кады-мова Ф.Э., 1997]. Представлены работы по использованию клапанных дренажей Ahmed, Molteno у детей с раз-ными формами глаукомы, в том числе с гидрофтальмом и врожденной глаукомой при аномалии Петерса в возрасте от 1 нед до 10 лет, с одновременным
22-972
проведением кератопластики. В бли-жайшем послеоперационном периоде положительный эффект наблюдался у 75 % детей [Zacharia P.T. et al., 1998].
8 настоящее время с целью повыше-
ния эффективности операции предло-
жены операции с использованием
ультразвука. Отмечены преимущества
использования низкочастотного ульт
развука: меньшая травматичность,
торможение регенеративного процесса
[Хватова А.В., 1995; Фридман Ф.Е. и
др., 1997]. Применению лазеров посвя
щены единичные работы [Schlote T. et
al., 1997]. Обсуждается эффективность
трансплантации помутневшей рогови-
цы у детей с врожденной глаукомой.
Ретроспективный анализ результатов
9 сквозных кератопластик с одновре
менным проведением антиглаукома-
тозных операции показал, что из
9 трансплантатов 6 сохранялись про-
зрачными в течение 24 мес, повыше
ние остроты зрения наблюдалось в
75 % случаев [Ariyasu R.G. et al., 1994].
Практически вее авторы отмечают снижение гипотензивного эффекта операции в отдаленные сроки наблю-дения.
Неблагоприятными факторами, ос-ложняющими послеоперационное течение при первичной глаукоме, счита-ют избыточное рубцевание и активную регенерацию, обусловленные проли-ферацией фибробластов теноновой капсулы и эписклеры в области операции [Джалиашвили О.А. и др., 1992; Лебедев О.И., 1993; Сидоров Э.Г., Перчикова О.И., 1993; Кобзева В.И., Короткевич Е.А., 1996; Балашова Л.М., 1997]. Некоторые авторы счи-тают, что у детей процессы пролифе-рации в зоне вмешательства в раннем послеоперационном периоде более ак-тивны, чем объясняют более низкую, чем у взрослых, эффективность фисту-лизирующих операции [Сидоров Э.Г. и др., 1992; Хватова А.В., Буткевич CO., 1994; Хватова А.В., 1995]. Причиной плохого прогноза у больных с врожденной глаукомой является выполнение фильтрующих операции у лиц, ранее уже оперированных по по-
337
воду глаукомы [Fulcher N. et al., 1996]. Высказано предположение о том, что ранний возраст пациента — неблагоприяти ый фактор для сохранения функционирования фистулы и нормальной фильтрации [Fulcher N. et al., 1996]. Неблагоприятное течение забо-левания отмечено у тех больных, у ко-торых диагноз поставлен в возрасте до 2 мес или после 2 лет.
Рубцеванию в зоне хирургического воздействия при первичной глаукоме способствуют недостаточный обьем иссекаемой части трабекулы, закрытие зоны операции гониосинехиями, кото-рые являются последствиями после-операционных иритов и кровоизлия-ний в переднюю камеру [Бессмерт-ный A.M. и др., 1998; Turach M.E. et al., 1992].
Воспалительные осложнения в виде иритов и иридоциклитов в послеопе-рационном периоде при врожденной глаукоме отмечены в единичных слу-чаях [Качан Н.А., Тойкулиев Т.К., 2000; Turach M.E. et al., 1992]. Кроме избыточного рубцевания, уменьшение эффекта антиглаукоматозных опера-ций обусловливают такие осложнения, как развитие синдрома мелкой перед-ней камеры, цилиохороидальная от-слойка, гифема, макулярный отек [Fi-lous A., Brunova B., 1998; Filous A., Burdova M., 1998]. В качестве редко встречающегося осложнения трабекул-эктомии у детей описана геморрагическая ретинопатия, напоминающая картину окклюзии центральной вены сетчатки [Ziel C.J., Smith T.J., 1991]. Самым частым среди всех послеопера-ционных осложнений при синдроме Стерджа— Вебера—Краббе была цилиохороидальная отслойка [Filous A., Brunova В., 1998]. Перепад ВГД, воз-никающий во время операции, являет-ся пусковым механизмом возникнове-ния клинических проявлений сосуди-стой патологии (операционные и по-слеоперационные геморрагии), высокой частоте отслойки сосудистой обо-лочки [Нурмамедов Н.Н., 1998].
Современные средства, препятст-вующие процессам пролиферации,
338
включают уменьшение травматичности операции, иссечение субконъюнктивы и эписклеры, применение кортикосте-роидов, протеолитических ферментов и цитостатиков из группы антиметаболи-тов. Предложения использовать анти-пролиферативные средства при избы-точном рубцевании тканей глаза поя-вились в начале 80-х годов XX в. При-меняли препараты из группы антимета-болитов: 5-фторурацил, позже — мито-мицин, блеомицин, что значительно улучшало исход антиглаукоматозных фильтрующих операции [Егоров Е.А. и др., 1996; Нестеров А.П. и др., 1996].
Представляется перспективным использование этих препаратов при врожденной глаукоме [Сидоров Э.Г. и др., 1992; Хватова А.В., 1995; Demaily R., Kretz G., 1991; Schuman J.S., 1995]. Применение 5-фторурацила способст-вовало снижению ВГД на 41,6 % у детей с плохо поддающимися лечению формами глаукомы, в том числе врожденной [Filous A., Burdova M., 1998]. Использование митомицина повышало эффективность трабекулэктомии у молодых пациентов на 10—15 % [Whi-teside-Michel J. et al., 1992; Dietlein T.S. et al., 1996; Agarwal H.C. et al., 1997]. K сожалению, митомицин в обычных дозах оказывает повреждающее цито-токсическое действие на фибробласты, что ассоциируется с такими осложне-ниями, как мелкая передняя камера, отслойка сосудистой оболочки, эн-дофтальмиты, поэтому многие авторы рекомендуют применение 5-фторурацила [Khaw P.T. et al., 1991; Wheeler D.T. et al., 1992; Khaw P.T., 1996]. Обсуждаются методики, дозы приме-нения этих препаратов, их токсич-ность, возможность развития побоч-ных эффектов и послеоперационних осложнений. Применяли также р-из-лучение, воздействие которого тормо-зит процесс рубцевания после фильтрующих операции [Khaw P.T., 1996]. Исследователи считают перспективным применение антиметаболитов в виде липосом и заключение препарата в полимеры или коллаген.
Медикаментознее лечение. Медика-
ментозная терапия не является основной при врожденной глаукоме, однако играёт важную роль в комплексном ле-чении заболевания. Выделяют основные направления медикаментозного лечения, включающие:
• снижение ВГД с применением ком
плекса гипотензивных препаратов;
• профилактику послеоперационного
рубцевания;
• использование нейротрофических
препаратов для сохранения и повы-
шения зрительных функций;
• десенсибилизирующую и общеукре
пляющую терапию.
Возможности медикаментозного лечения значительно расширились в связи с появлением комплекса современ-ных гипотензивных препаратов. Использование этих препаратов показано детям с различными формами врожденной глаукомы; их назначают сразу после выявления повышенного ВГД у ребенка, включают в схему предопера-ционной подготовки с целью максимального снижения ВГД перед опера-цией, применяют для коррекции ВГД в послеоперационном периоде, а так-же для попытки его нормализации у оперированных детей в случае невоз-можности повторного оперативного вмешательства.
Основными гипотензивными препаратами, применяемыми у детей с врожденной глаукомой, являются:
• М-холиномиметик (1 % раствор пи
локарпина);
• неселективные р-1,2-адреноблока-
торы, включающие 0,25—0,5 % рас
твор арутимола и 0,25—0,5 % рас
твор тимоптика;
• селективный р-1,2-адреноблокатор
(0,5 % раствор бетоптика);
• а-1,р-адреноблокатор (1 % раствор
проксодолола);
• ингибиторы карбоангидразы для
местного применения (2 % раствор
трусопта, 1 % раствор азопта);
• синтетический аналог простаглан-
дина Fa2 (0,005 % раствор латано-
проста — ксалатана).
Препараты применяют изолирован-
но или, при недостаточном эффекте, в различных комбинациях. Чаще всего 1 % раствор пилокарпина комбиниру-ют с каким-либо адреноблокатором и/или ингибитором карбоангидразы.
Целесообразным является назначение комбинированных препаратов: фотила (0,5 % раствор тимолола малеа-та и 2 % раствор пилокарпина), косо-пта (2 % раствор трусопта и 0,5 % раствор тимолола малеата) и ксалакома (0,005 % раствор ксалатана и 0,5 % раствор тимолола малеата), которые по-зволяют уменьшить количество ин-стилляций в день и повысить «качест-во жизни» пациента.
Помимо использования местных гипотензивных препаратов, для снижения ВГД перед операцией применяют диакарб (в таблетках по 0,25 г). К подбору гипотензивного режима необхо-димо подходить индивидуально и диф-ференцированно.
Побочные эффекты при назначении данных препаратов возникают редко, в виде местных токсико-аллергических реакций. С осторожностью следует на-значать неселективные р-адренобло-каторы детям с бронхиальной астмой, брадикардией, пониженным артери-альным давлением. Назначение ингибиторов карбоангидразы и 0,005 % раствора ксалатана также требуёт осто-рожности: эти препараты должны при-меняться под наблюдением врача.
С целью сохранения и стимуляции зрительных функций детям с врожденной глаукомой показана нейротрофи-ческая терапия, которую следует про-водить регулярно (1—2 раза в год), так как при этом заболевании происходят дистрофические и атрофические изме-нения волокон зрительнего нерва и сетчатки. В комплекс нейротрофиче-ского лечения включают препараты, влияющие на периферическое кровообращение и улучшающие микроцир-куляцию (сермион в таблетках по 0,01 г, кавинтон в таблетках по 0,005 г и в виде 0,05 % раствора для инъекций, ксантинола никотинат в таблетках по 0,15 г, трентал по 0,1 г в таблетках и в виде 2 % раствора для инъекций), ан-
339
22*
гиопротекторы (доксиум в таблетках по 0,25, аскорутин в таблетках), а так-же средства, регулирующие метаболические процессы (церебролизин для инъекций), нейротропные (0,05 % раствор прозерина для инъекций), витамины группы В. При назначении препаратов следует исходить из возрастных дозировок.
При стойкой компенсации ВГД в комплекс лечения включают физиотерапевтические методы: электрофорез и магнитофорез с нейротрофическими и сосудорасширяющими препаратами (2 % раствор но-шпы, 0,05 % раствор прозерина), чрескожную электрости-муляцию зрительного нерва.
Функциональное лечение. Важным является функциональное лечение, направленное на борьбу с амблиопией путем коррекции аметропии и плеоп-тики. У детей с врожденной глаукомой чаще выявляется миопия (у многих миопия средней и высокой степени), обязательно требующая коррекции.
Диспансерное наблюдение является необходимым для детей и подростков с врожденной глаукомой. Очень важно регулярно наблюдать за ВГД, размерами глаза, остротой зрения. Детей с подозрением на врожденную глаукому или с установленным диагнозом ставят на диспансерный учет в поликлинике по месту жительства с обязательным обследованием 1 раз в месяц: измерение ВГД, диаметра роговицы, ширины лимба и определение зрительных функций (по возможности).
Таким образом, несмотря на значительное освещение в литературе вопросов клиники, этиопатогенеза, диагностики и лечения врожденной глаукомы, проблема остается актуальной и требуёт дальнейших исследований.
СПИСОК ЛИТЕРАТУРЫ
Аветисов Э.С., Ковалевский Е.И., Хвато-ва А.В. Руководство по детской офталь-мологии. — М., 1987.
Балашова Л.М. Иммуногемостатические механизмы первичной открытоугольной глаукомы // Вестн. офтальмол. — 1997. - № 2. - С. 42-44.
Бессмертный A . M ., Еричев В.П., Ловпа- че В.П. Новая модификация синустрабе-кулэктомии // Глаукома. — М., 1998. — С. 251-256.
Винецкая М.И., Абдулкадырова М.И. Показатели обмена гликозаминогликанов у больных первичной глаукомой молодого возраста // Глаукома: Сборник науч. трудов. — М., 1984. — С. 18—21.
Джалиашвили О.А., Игнатьев А.Н., Жоржос X . Возможные причины повышения внутриглазного давления после трабеку-лэктомии и пути их устранения // Вестн. офтальмол. — 1992. — № 3. — С. 3—5.
Егоров Е.А., Нестеров А.П., Шабан Н. Анти-метаболиты в лечении рецидивов повышения офтальмотонуса после антиглау-коматозной операции // Глаукома: Сборник научных трудов. — М., 1996. — С. 200-202.
Брошевский Т.И., Токарева Б.А. Врожденная детская глаукома и ее лечение. — М.: Медицина, 1971. — 152 с.
Брошевский Т.И., Шику нова Р.П. Теория патогенетической связи гидрофтальма с открытоугольной глаукомой // Вестн. офтальмол. - 1985. - № 3. - С. 3-6.
Затулина Н.И., Лукова Н.Б. О механизме ретенции внутриглазной жидкости при глаукоме у лиц молодого возраста // Экспериментальные исследования в оф-тальмологии. - М, 1986. — С. 91-94.
Кадымова Ф.Э. Дренаж из гидрогеля в лечении детей с врожденной глаукомой // Актуальные вопросы детской офтальмо-логии: Материалы научно-практической конференции. — М., 1997. — С. 70—71.
Канюков В.Н., Полякова О.М., Ефимов С.Г., Канюков И.В. Непроникающая глубокая склерэктомия с туннельным аутодрени-рованием при глаукоме детского возраста // Актуальные вопросы детской оф-тальмологии: Материалы научно-практической конференции. — М., 1997. — С. 64-66.
Качан Н.А. Трабекулотомия ab externo в лечении врожденной глаукомы //Актуальные вопросы детской офтальмологии: Материалы научно-практической конференции. — М., 1997. — С. 71—73.
Качан Н.А., Тойкулиев Т.К. Хирургическое лечение врожденной глаукомы в раннем младенческом возрасте // 7-й съезд оф-тальмологов России: Тезисы докладов. - М., 2000. - С. 355.
Клячко М.Л. Глаукома детского, юношеского и молодого возраста. — М.: Медгиз, 1961.
Кобзева В.И., Короткевич Е.А. Экспульсив-ная геморрагия в детском возрасте на
340
глазах с глаукомой // Глаукома: Сборник научных трудов. — М., 1996. — С. 230-234.
Ковалевский Е.И., Смирнова Т.С., Медведева Н.И. Критерии клинической диагностики врожденных детских глауком // Профилактика слепоты и слабовидения у детей: Материалы Всероссийской научно-практической конференции детских офтальмологов. — М., 1996. — С. 84-86.
Лакомкин В.И., Рузмешова Н.Х. Отдаленные результаты патогенетически ориентированных операций при врожденной глаукоме и послеоперационная реабилита-ция // Материалы Всероссийской научно-практической конференции детских офтальмологов. — М., 1996. — С. 87—91.
Лебедев О.И. Концепция избыточного руб-цевания тканей глаза после антиглауко-матозной операций // Вестн. офталfa-мол. - 1993. - № 1. - С. 36-39.
Лукова Н.Б., Свяпгковская Г.Я. Клинико-биохимические параллели в изучении дистрофических процессов у больных глаукомой молодого возраста //Вестн. офтальмол. — 1978. — № 5. — С. 21—24.
Нестеров А.П. Глаукома. — М.: Медицина, 1995.
Нестеров А.П., Егоров Е.А., Евграфов В.Ю., Шабан Н. Применение фторурацила после антиглаукоматозных реопераций // Глаукома: Сборник научных трудов. — М., 1996. - С. 203-205.
Нурмамедов Н.Н. Хирургическое лечение глаукомы детского возраста // Глаукома: Сборник научных трудов. — М., 1998. — С. 293-300.
Сапоровский С.С., Январева O . K ., Попо ва Н.А. Интрасклеральное микродренирование при лечении посттравматиче-ской глаукомы у детей // Глаукома: Сборник научных трудов. — М., 1996. — С. 251-254.
Сидоров Э.Г., Мирзаянц М.Г. Врожденная глаукома и ее лечение. — М., 1991. — 208 с. Сидоров Э.Г., Перчикова О.И., Шмыре- ва В.Ф., Полуторнов А.Л. Применение цитостатиков в качестве противорубцо-вых средств после антиглаукоматозных операций в детском и молодом возрасте // Вестн. офтальмол. — 1992. — № 3. - С. 5-7.
Сидоров Э.Г., Перчикова О.И. Клиника, не-которые вопросы патогенеза и лечения глауком в молодом возрасте // Вестн. офтальмол. — 1993. — 4. - С. 32—34. Тарасенков А.О., Шувашова Е.Л. Особенности электроретинограммы у детей с вро-
жденной глаукомой // Актуальные вопросы детской офтальмологии: Материалы научно-практической конференции. - М., 1997. - С. 22-26.
Теплинская Л.Е., Балашова Л.М., Мазано- ва Е.В. и др. Медицинская иммунология: Материалы 6-й Всероссийской научной конференции «Дни иммунологии в Санкт-Петербурге». — 2002. — Т. 4, №4. - С. 213-214.
Теплинская Л.Е., Xeamoea A . B ., Мазано- ва Е.В. Взаимосвязь гуморальных факторов иммунитета с прогрессирующим течением врожденной глаукомы // 7-й съезд офтальмологов России: Тезисы докладов. Ч. I. — М., 2000. - С. 399.
Тойкулиев Т.К., Качан Н.А. Системный подход в хирургическом лечении врожденной глаукомы // Актуальные вопросы детской офтальмологии: Материалы научно-практической конференции. — М., 1997. - С. 73-75.
Фильчикова Л.И., Мосин И.М. Опыт приме-нения вызванных потенциалов в клинической практике // Сборник научных трудов. — М.: АОЗТ «Антидор», 2001. — С. 372-298.
Фильчикова Л.И., Дубовская Л.А., Сидорен- ко Е.И. Зрительные вызванные потенциалы у детей с врожденной глаукомой // Вестн. офтальмол. — 1992. — № 1. -С. 15-18.
Фильчикова Л.И., Новикова Л.А., Юносо- ва Ф.В. Вызванные потенциалы на про-странственно-структурированные стимулы в раннем онтогенезе // Физиоло-гия человека. — 1988. — Т. 14, № 1. -С. 58-64.
Фридман Ф.Е., Кодзов М.Б., Xeamoea A . B ., Арестов Д.О. Ультразвуковая склерого-ниотомия в лечении глаукомы у детей // Актуальные вопросы детской офтальмологии: Материалы научно-практической конференции. - М., 1997. - С. 67-70.
Xeamoea A . B ., Ковальчук Н.А., Богословский A . M . Клинико-электрофизиологи-ческая характеристика врожденной детской глаукомы // Вестн. офтальмол. — 1975. — № 5. - С. 20-24.
Xeamoea A . B . Итоги научных исследований отдела патологи и глаз у детей по актуальным проблемам детской офтальмологии // Сборник статей, посвященный 100-летию МНИИ глазных болезней им. Гельмгольца. — М.: МНИИГБ им. Гельмгольца. — М., 2000. — Т. 1. — С. 11-17.
Xeamoea A . B ., Буткевич С.О. Результаты трабекулэктомии при врожденной глау-
341
коме // Глаукома: Сборник научных трудов. - М., 1994. - С. 105-109.
ХватоваЛ.В. Итоги и перспективы научных исследований по актуальным проблемам детской офтальмологии // Актуальные вопросы офтальмологии. — М., 1995. — С. 83-101.
Xeamoea A . B ., Лрестова Н.Н. Двадцатилетний опытлечения врожденной глаукомы у детей // Актуальные вопросы детской офтальмологии: Материалы научно-практической конференции. — М., 1997. -С. 61-64.
Чеснокова Н.Б., Сосулина Н.Е., Кругло- ва Т.Б. Активность ингибиторов пропи-азных ферментов в водяной влаге больных при катаракте и врожденной глаукоме // Актуальные вопросы офтальмологии: Сборник научных трудов. — Уфа, 1988. - С. 140-142.
Шамшинова A . M ., Волков В.В. Функцио-нальные методы исследования в офтальмологии. — М.: Медицина, 1998. — 416 с.
Шубина Н.Ю. Методика исследования, возрастные нормы и диагностика наруше-ний зрительных вызванных потенциалов мозга у детей // Метод. рекоменда-ции. - Иваново: МИГАА, 1998. - 19 с.
Шикунова Р.П., Свяшковская Т.Я., Сниса-ревский Д.А. Некоторые клинико-биоло-гические показатели предрасположенное™ к глаукоме // Вестн. офтальмол. — 1979. - № 3. - С. 6-10.
Яковлев А.А., Xeamoea A . B . Значение электрофизиологических методов исследования в детской офтальмологии. Клиническая физиология зрения // Сборник научных трудов. — М.: Русомед, 1993. — С. 115-129.
Яковлев А.А., Xeamoea A . B ., Мосин И.М. Электрофизиологические методы исследования в диагностике заболеваний сет-чатки и зрительного нерва у детей раннего возраста // Пособие для врачей. — М.: МНИИГБ им. Гельмгольца, 1998. — 20 с.
Agarwal Н . С ., Honavar S.G., Sood N.N. Gonioanomalies in congenital glaucoma — a clinico-ultrastructural study // Exp. Eye Res. - 1994. - Vol. 59, N 1. - P. 76.
Agarwal H.C., Sood N.N., Siota R. et al. Mitomycin-C in congenital glaucoma // Ophthalm. Surg. Laser. — 1997. — Vol. 28, N 12. - P. 979-985.
Ariyasu R.G., Silverman J., Irvine J.A. Penetrating keratoplasty in infants with congenital glaucoma // Cornea. — 1994. — Vol. 13, N 6. - P. 521-526.
Aznara-Blanco A., Azanjo S.V., Wilson K.P. et al. Ultracound biomicroscopy in infantile glaucoma // Ophthalmology. — 1994. — Vol. 102, N 9a, Suppl. - P. 89.
Bane M.C., Birch E.E. VEP acuity, FPL acuity, and visual behavior of visual bexavior of visually impaired children // Pediatr. Oph-thalmol. Strabismus. — 1992. — Vol. 29, N 4. - P. 202-209.
Bitoun P. Glaucoma with Larsen-licke syndrome // Ophthalm. Genet. — 1994. — Vol. 15, N 3-4. - P. 133-140.
Cernea P., Preotecisa D. Dominant heredity in tardive congenital glaucoma with high insertion of the iris // Oftalmologia. —
1995. - Vol. 39, N 1. - P. 37-43.
Clarke M.P., Sullivan T.J., Rootman D., Mo-
rin I.D. The corneal endothelium in primary congenital glaucoma // Ophthalmology. — 1991. - Vol. 98, N 8, Suppl. - P. 119.
Demailly R., Kretz G. 5-Fluorouracil versus Daunorubicin filtering surgery in the treatment of multi-operated congenital glaucoma // International Glaucoma Symposium. — Jerusalem, 1991. — P. 132.
Dietlein T.S., Jacobi P.C., Krieglstein G.K. Outcome of arteria-segment surgery in Rieger's anomaly // Ger. J. Ophthalm. —
1996. - Vol. 5, N 6. - P. 439-442.
Dietlein T.S., Jacobi P.C., Krieglstein G.K. Pri
mary congenital ectropion uveae associated
with vitreoretinal degeneration // Ophthal-
mologica. - 1998. - Vol. 212, N 1. -
P. 63-65.
Doran R.M.L. Anterior segment malformations: aetiology and genetic implications // Brit. J. Ophthalm. - Vol. 75, N 10. -P. 579.
Elder M.J. Congenital glaucoma in the West Bank and Gaza strip // Brit. J. Ophthalm. — 1993. - Vol. 77, N 6. - P. 413-416.
Elder M.J. Combinated trabeculotomy-trabe-culectomy conpared with primary trabecul-ectomy for congenital glaucoma // Brit. J. Ophthalm. - 1994. - Vol. 78, N 8. -p. 745-748.
Filous A., Brunova B. Peroperative administra-tivon of 5-fluorouracil during trabeculec-tomy in complicated glaucoma in children // Cse. Slov. Oftalmol. — 1998. - Vol. 54, N 2. - P. 76-81.
Filous A., Burdova M. Personal experience in treatment of glaucoma in children with the Sturge-Weber syndrome // Cse. Slov. Oftalmol. - P. 86-90.
Foster A., Gilbert C. Epidemiology of childhood blundness // Eye. - 1992. - Vol. 6, N 2. -P. 173-176.
Fulcher N., Chan J., Lanigan B. et al. Long-
342
term follow up of primary trabeculectomy for infantile glaucoma // Brit. J. Oph-thalm. - 1996. - Vol. 80, N 6. - P. 499-502.
Gerinec A. New nosological and etiological aspects on primary congenital glaucoma // Europ. J. Ophthalm. — 1995. — Vol. 5, N 2A, Suppl. - P. 52.
Ginter M., Krawczynski M. Rieger's Syndrome in a 12 year old girl // Klin. Oczna. — 1994. - Vol. 96, N 10. - P. 347-350.
Gloor B.R. Risks of 360 degree suture trabe-culotomy // Ophthalmology. — 1998. — Vol. 95, N 2. - P. 100-103.
Holmstrom G. H., Reardon W. P., Baraiser M. et al. Heterogeneity in dominant anterior segment malformations // Brit. J. Ophthalm. - 1991. - Vol. 75, N 10. - P. 591 — 597.
Hoskins H.D., Shaffer R.N., Hetherington J. Anatomical classification of the developmental glaucomas // Arch. Ophthalmol. — 1984. - Vol. 102, N 9. - P. 1331-1336.
Khaw P.T., Grierson I., Rice N.S.C. 5-Fluo-rouracil and beyond // Brit. J. Ophthalm. — 1991. - Vol. 75, N 10. - P. 577-578.
Khaw P.T. What is the best primary surgical treatment for infantile glaucoma // Brit. J. Ophthalm. - 1996. — Vol. 80, N 6. — P. 495-496.
Khaw P.T., Freedman S.F., Gandolfi S. Management of congenital glaucoma (clinical conference) // J. Hlaucoma. — 1999. — Vol. 8, N 1. - P. 81-85.
Khvatova A. V., Kovakhuk N.A., Bogoslov- ski A.I. Infantile glaucoma: electrophyzio-logy // Acta Ophthalmol. - 1979. — Vol. 57. - P. 637-641.
Koraszewska-Matuszewska B., Samockowiec- Donocic E., Pieczara E., Papiez M. Occurrence of glaucoma in phakomatosis // Klin. Oczna. - 1994. - Vol. 96, N 6. - P. 228— 232.
Kranemann C.F., Pavlin G.J., Trope G.E. Ultrasound biomicroscopy in Sterge-Weber associated glaucoma // Amer. J. Ophthalm. — 1998. - Vol. 125, N 1. - P. 119-121.
KrissA., Russell-Eggitt. Electrophysiological assessment of visual pathway function in infants // J. Eye. — 1992. — N 6. -P. 145-153.
Kwitko M.L. Glaucoma in infants and children. - New York, 1973.
Lin C, Lueder G.T., Kass M.A. Ocular abnormalities in a patient with Rothmund-Thompson syndrome//J. Pediatr. Ophthalmol. Strabismus. - 1995. — Vol. 32, N 2. — P. 132-134. Lin J., Sun W., Zi E. et al. Ultrastructural ob-
servation of the anterior chamber angle tissues in congenital glaucoma // Yen. Ko. Hsueh. Pao. - 1994. - Vol. 10, N 1. -P. 50-56.
MandalA.K., Walton D.S., John T.N. Bilateral primary combined trabeculotomy-trabecul-ectomy for congenital glaucoma // Ophthalmology. - 1995. - Vol. 102, N 9a, Suppl. - P. 89.
Megarbane A., Tomey K., Wakim G. Congenital glaucoma, limb deformities, skeletal dys-plasia, and facial anomalities: report of another family // Amer. J. Med. Genet. —
1997. - Vol. 73, N 1. - P. 67-71.
Morissette J., Cote G., Anetil J.L. et al. A
common gene for juvenile and adultonset glaucomas confined in chromasome Ig // Amer. J. Hum. Genet. — 1995. — Vol. 56, N 6. - P. 1431-1432.
Quaranta L., Quaranta C.A. Congenital glaucoma associated with Rubinstein-Taybi syndrome // Acta. Ophthalm. Scand. —
1998. - Vol. 76, N 1. - P. 112-113.
Roy M.S., Barsoum-Homsy M., Hanna N. et al.
Pattern electroretinogram and spatial contrast sensitivity in primary congenital glaucoma // Ophthalmolology. — 1997. — Vol. 104, N 12. - P. 213,6-2142.
Russel- Eggitt I., Lightman S. Intrauterine infection and the eye // Eye. - 1992. — Vol. 6, N 2. - P. 205-210.
Russel-Eggitt I. In defence of goniotomy (Letter) // Brit. J. Ophthalm. - 1995. -Vol. 79, N 8. - P. 709.
Sacca S., Buono C, Grosso S. et al. Could argi-ninemia be the cause congenital glaucoma // Europ. J. Ophthalm. - 1995. — Vol. 5, N 2a, Suppl. - P. 234.
Saraiva J.M., Gama E., Pires M.M., Stquei-ra J.E. First report of glaucoma as a feature of the 3C syndrome // Clin. Dysmorphol. — 1995. - Vol. 4, N 2. - P. 156-160.
Schlote T., Kreutzer B., Kriegerowski M. et al. Diode Laser cyclophotocoagulation in treatment of therapy refractory glaucoma // Klin. Mbl. Augenheilk. — 1997. — Bd 211, N 4. - S. 250-256.
Schuman J.S. Antimetabolites in glaucoma syrgery // Eurp. J. Ophthalm. — 1995. — Vol. 5, N 2a, Suppl. - P. 151.
Shaffer R.N. Prognosis of goniotomy in primary infantile glaucoma // Trans. Amer. Ophthalmol. Soc. - 1992. - Vol. 80. -P. 321-325.
Shilds B.M. Textbook of glaucoma. — 3rd ed. — Baltimore: Williams and Wilkins, 1992.
Stefanikowa E. Congenital uveal ectropion with glaucoma // Klin. Oczna. — 1994. — Vol. 96, N 6-7. - P. 244-245.
343
Sujansky E., Conradi S. Outcome of Sturge-Weber syndrome in 52 adult // Amer. J. Med. Genet. - 1995. - Vol. 57, N 1. -P. 35-45.
Sun X.H., Zheng Y.Z., ЛХ . С . External trabecu-lotomy in the treatment of developmental glaucoma: a clinical report on 140 eyes of 88 cases // Chung. Hua. Yen. Ko. Tsa. Chih. - 1994. - Vol. 30, N 4. - P. 253— 257.
Susann R. Jr., Oltragge E.W., Carani J.C.E., Nicolela M.T. Mitomycin as adjunct chemotherapy with Trabeculectomy in congenital and developmental glaucomas // J. Glaucoma. - 1995. - Vol. 4. - P. 151 — 157.
Той lemont P., Urvoy M., Coscas G. et al. Association of congenital microcoria with myopia and glaucoma. A study of 23 patients with congenital microcoria // Ophthalmology. - 1995. - Vol. 102, N 2. - P. 193-198.
Turach M.E., Aktan S.G., Mil A. Medical and surgical aspects of congenital glaucoma // Acta. Ophthalm. Scand. — 1995. — Vol. 73, N 3. - P. 261-263.
Turach M.E., Aktan S.G., Sayli B.S., Akarsu N.
Therapeutical and genetical aspects of congenital glaucoma // Intern. Ophthal-molology. - 1992. - Vol. 16, N 4/5. -P. 359-362.
Wheeler D.T., Stager D.R., Weakley D.R. Endophthalmitis following pediatric intraocular surgery for congenital glaucoma // J. Pediatr. Ophthalmol. Strabismus. — 1992. - Vol. 29, N 3. - P. 139-141.
Whiteside-Michel J., Liebman J.M., Ritch R. Initial 5-Fluorouracil trabeculectome in young patients // Ophthalmolology. — 1992. - Vol. 99. - P. 7-13.
Zacharia P.T., Harrison D.A., Wheeler D.T. Penetrating keratoplasty with a valved glaucoma drainage imlant for congenital glaucoma and corneal scarring secondary to hudrops // Ophthalm. Surg. Laser. — 1998. - Vol. 29, N 4. - P. 318-322.
Ziakas N.G., Ramsay A.S., Lynch S.A., Clarke M.P. Sticker's syndrome assosiated with congenital glaucoma // Ophthalm. Genet. - 1998. - Vol. 19, N 1. - P. 55—58.
Ziel C.J., Smith T.J. Hemorrhagic retinopathy following trabecuectomy in young patients // Ophthalmology. — 1991. — Vol. 98, N 8, Suppl. - P. 110.
Глава 3
 КЛИНИЧЕСКИЕ ОСОБЕННОСТИ
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ
И ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ
НАРУШЕНИЯ ЗРИТЕЛЬНЫХ ФУНКЦИЙ
ПРИ ВРОЖДЕННЫХ КАТАРАКТАХ
Дата добавления: 2019-08-30; просмотров: 152; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!