Лабораторные работы с применением потенциометрического метода.
Метод потенциометрии основан на определении электродных потенциалов измерением ЭДС различных электрохимических цепей.
План коллоквиума.
1. Образование двойного электрического слоя на границе металл-раствор; возникновение скачка потенциала;
2. Электродный потенциал, нормальный потенциал. Ряд напряжения.
3. Типы и виды электродов; зависимость потенциалов электродов, от концентрации образующихся ионов;
4. Гальванические элементы. ЭДС гальванических элементов;
5. Химические и концентрационные гальванические элементы. Выражение для ЭДС гальванических элементов;
6. Термодинамика гальванических элементов;
7. Применение метода ЭДС для определения коэффициента активности раствора, констант равновесия, рН растворов.
Литература.
1.А.Г. Стромберг, Д.П. Семченко. Физическая химия. М.: Высшая школа. 1899. Гл. VII. С.248-282.
2. Курс лекций.
Работа 1. Измерение ЭДС элемента Якоби-Даниэля.
Целью работы является освоение методики измерения ЭДС гальванического элемента.
Гальванический элемент Якоби-Даниэля состоит из медного и цинкового электродов. Гальваническая цепь элемента записывается следующим образом:
(+)Си|Си,CuSO  ||ZnSO
||ZnSO  |Zn(-)
|Zn(-)
При работе гальванического элемента его разность потенциалов не остается постоянной вследствие изменений, происходящих на электродах. Поэтому для измерения ЭДС применяется метод компенсации, который основан на измерении ЭДС элемента по разности потенциалов в условиях обратимости. Для измерения ЭДС можно использовать высокоомный потенциометр постоянного тока Р306 или рН-метр. Необходимо сначала изучить схему измерительной установки и последовательность проводимых измерений на приборе. После этого собирают гальванический элемент.
|
|
|
Выполнение работы. Медную и цинковую пластинки перед погружением в раствор зачищают наждачной бумагой, промывают водой, обезжиривают с помощью ацетона или спирта и вновь тщательно промывают.
В разные сосуды(стаканчики на 100 мл) наливают растворы Си SO  и ZnSO
и ZnSO  , заданной концентрации(варианты концентраций указаны в табл.1) с таким расчетом, чтобы 3/4 поверхности электродов были погружены в растворы. Верхние концы электродов с помощью проволочек присоединяют к потенциометру. В растворы в стаканчики вставляют электролитический ключ, предварительно заполненный насыщенным раствором хлорида калия.
, заданной концентрации(варианты концентраций указаны в табл.1) с таким расчетом, чтобы 3/4 поверхности электродов были погружены в растворы. Верхние концы электродов с помощью проволочек присоединяют к потенциометру. В растворы в стаканчики вставляют электролитический ключ, предварительно заполненный насыщенным раствором хлорида калия.
ЭДС гальванического элемента измеряют при различных концентрациях растворов. Перед каждым измерением необходимо выдерживать электроды в растворах 10-15 мин. Полученные данные записываются в табл. 1.
Экспериментально измеренные величины ЭДС необходимо сопоставить с теоретически рассчитанными по уравнению (1.26). Необходимые для теоретического расчета величин ЭДС значения стандартных электродных потенциалов медного и цинкового электродов и средние коэффициенты активности растворов электролитов взять в справочнике.
|
|
|
Таблица 1. Результаты измерения ЭДС элемента Якоби-Даниэля
| Концентрация растворов, м
| Еизм.В
| Ерассч, В
| Ошибка измерен.
| |
| Си80, | 2п80, | |||
| 1 1 0,1 1 0, 01 | 1 0,1 1 0,01 1 | |||
По работе оформляется отчет.
Литература к лабораторной работе.
1. Практикум по физической химии. Под ред. С.В. Горбачева. М.:
Высшая школа. 1974.
2. А.Я, Шаталов, И.К. Маршаков. Практикум по физической химии. М.: Высшая школа. 1975.
Работа 2. Определение константы диссоциации слабой кислоты.
Целью работы является освоение методики определения константы диссоциации потенциометрическим методом.
Потенциометрический метод измерения рН раствора слабой кислоты дает возможность рассчитать константу ее диссоциации. Если степень диссоциации одно-одновалентной слабой кислоты очень мала, то
K 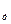 = cα2 (3.1)
= cα2 (3.1)
|
|
|
откуда следует соотношение:
 (3.2)
(3.2)
где  -концентрация ионов водорода;
-концентрация ионов водорода;
α- степень диссоциации;
с - концентрация раствора кислоты.
Логарифмируя последнее равенство и изменив знак на обратный, будем иметь для рН раствора:
 (3.3)
(3.3)
Согласно уравнению (3.3) экспериментальные точки должны укладываться в координатах рН - lgc на прямую. Наклон прямой должен быть равен 1/2. Отрезок, отсекаемый этой прямой на оси
ординат при tgс=0, соответствует значению  отсюда
отсюда
рассчитывается 
Изменение рН растворов солей слабых кислот используется для определения констант диссоциации.
Выполнение работы. Можно определять константу диссоциации одной из слабых кислот (уксусная, муравьиная, бензойная).
Следует определять рН растворов слабой кислоты различной концентрации. В качестве исходного раствора берется 0,1н растор одной из кислот. Из него готовятся растворы со следующими концентрациями: 5•10-2;1•10-2;5•10-3;1•10-3М. Для каждого из этих растворов с помощью рН-метра трижды измеряют рН. В качестве искомой величины рН берется средняя величина из трех измерений. По средним значениям рН растворов строится график рН =  (рис.3.1)
(рис.3.1)
рН Рис.3.1.
|
|
|
 | |||||
 | |||||
 | |||||
-1/2 lgK 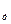

-lgc
Прямую линию продолжают до пересечения оси рН. Отрезок, отсекаемый этой прямой на оси ординат, равен -1/2 lgK  .
.
Измеряют этот отрезок и рассчитывают величину К 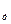 .
.
Правила работы на рН-метре описаны в приложении. По работе оформляется отчет.
Литература к лабораторной работе.
1. Практикум по физической химии. Под ред. С.В. Горбачева. М.:
Высшая школа. 1974.
2. А.Я. Шаталов, И.К. Маршаков. Практикум по физической химии. М.: Высшая школа. 1975.
Работа 3. Определение константы гидролиза соли.
Целью работы является освоение методики определения константы гидролиза соли потенциометрическим методом.
Соли, образованные сильной кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и слабой кислотой подвергаются гидролизу.
Измерение рН растворов этих солей позволяет определить константы гидролиза. Рассмотрим некоторые случаи.
Случай 1. Гидролиз соли сильной кислоты и слабого основания (например, NН  ). Гидролиз протекает по уравнению:
). Гидролиз протекает по уравнению:
Me  +H
+H  O↔Me(OH)+H
O↔Me(OH)+H  ,
,
где Me 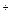 -катион соли.
-катион соли.
Концентрация ионов H  (C
(C  )в растворе соли выражается зависимостью:
)в растворе соли выражается зависимостью:
C  =
=  (3.4)
(3.4)
где  - константа гидролиза соли;
- константа гидролиза соли;
с - концентрация соли.
Логарифмируя (3.4) и изменяя знак на обратный, получается:
 (3.5)
(3.5)
Имея в виду, что  = рН , получается:
= рН , получается:
 (3.6)
(3.6)
28
Константа гидролиза (  ) определяется графически, для чего экспериментальные данные представляются в виде графика рН =
) определяется графически, для чего экспериментальные данные представляются в виде графика рН =  (рис.3.2)
(рис.3.2)
рН
 | |||||
 | |||||
 | |||||
-1/2 lgK 

-lgc
Рис.3.2.
Продолжение экспериментальной прямой до lgс=0 отсекает на оси
ординат отрезок, равный -1/2 lgK  .Замеряется этот отрезок и рассчитывается величина К,.
.Замеряется этот отрезок и рассчитывается величина К,.
Случай 2. Гидролиз слабой кислоты и сильного основания
(например, NаСН,СОО). Гидролиз соли в этом случае протекает по уравнению:
А  +Н
+Н  О↔НА+ОН
О↔НА+ОН  ,
,
где А  -анион соли.
-анион соли.
Концентрация ионов ОН  в растворе выражается уравнением:
в растворе выражается уравнением:
C  =
= 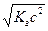 (3.7)
(3.7)
Рассуждая по аналогии с предыдущим получим:
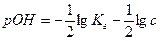 (3.8)
(3.8)
Имея в виду, что рОН = рК  - рН , получается:
- рН , получается:
рК 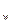 -рН=
-рН=  , (3.9)
, (3.9)
где К  -ионное произведение воды при данной температуре. Оно находится в справочнике. Величина рН определяется экспериментальным путем. Для нахождения величины К
-ионное произведение воды при данной температуре. Оно находится в справочнике. Величина рН определяется экспериментальным путем. Для нахождения величины К  строится график в координатах рК
строится график в координатах рК 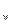 — рН = f(с). Продолжение графика до lgc=0 отсекает на оси ординат отрезок, равный -1/2 lgK
— рН = f(с). Продолжение графика до lgc=0 отсекает на оси ординат отрезок, равный -1/2 lgK 
Из отрезка рассчитывается, как и в предыдущем случае, величина К,.
Случай 3. Соль слабой кислоты и слабого основания (например, СН  СОО NН
СОО NН  ).
).
Гидролиз такой соли протекает по уравнению:
Me  +A
+A  +H
+H  O<-> МеОН + НА
O<-> МеОН + НА
Концентрация ионов Н  такого раствора независимо от его концентрации равна:
такого раствора независимо от его концентрации равна:
 (3.10)
(3.10)
Логарифмируя (3.10) и меняя знак на обратный получается:
 (3.11)
(3.11)
Отсюда:
 (3.12)
(3.12) 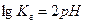 (3.13)
(3.13)
Выполнение работы. Для определения константы гидролиза любого типа соли готовятся растворы этой соли с концентрациями 0,01; 0,02;
0,03; 0,04; 0,05 и измеряется рН этих растворов. Затем, в зависимости от типа соли, рассчитывается константа гидролиза соли по одной из описанных методик.
По работе оформляется отчет.
Литература к лабораторной работе.
1. Практикум по физической химии. Под ред. С.В. Воробьева. М.:
Высшая школа. 1974.
2. А.Я. Шаталов, И.К. Маршаков. Практикум по физической химии.
М.: Высшая школа. 1975.
Приложение 1.
Порядок работы на рН-метре. I. Настройка рН-метра по буферным растворам.
1. Настройка рН-метра для измерения рН растворов с постоянной температурой;
2. При ручной термокомпенсации вращая ручку "ручн.темп" установить на индикаторе значение температуры буферных растворов (комнатную), измеренную стеклянным термометром;
3. Нажимая кнопку "режим" на лицевой панели, установить единицы измерения "рН" и вращая резистор "рН", расположенный на боковой стенке, установить его примерно в среднее положение;
4. Погрузить электроды в первый буферный раствор с рН=4 и, вращая ось резистора "буфер", уставить на индикаторе значение, равное значению рН буферного раствора;
5. Промыть электроды дистиллированной водой, осушить их фильтровальной бумагой и погрузить во второй буферный раствор с рН=9,18;
6. Вращая ось резистора "3" на боковой стенке преобразователя, установить на индикаторе значение, равное значению рН буферного раствора (9,18). II. Проведение измерений.
1. При измерении электроды промыть дистиллированной водой и погрузить их в измерительный раствор. Отсчет показаний производится по индикатору;
2. По окончании работы электроды промываются дистиллированной водой и погружаются в стаканчик с дистиллированной водой или с 0,1н раствором НС1.
Приложение!.
Требование к оформлению отчетов.
1. Указывается название работы;
2. Указывается цель работы;
3. Кратко излагаются теоретические основы работы, записываются расчетные формулы, описываются методики расчетов;
4. Приводятся результаты измерений и расчетов в виде таблиц и графиков;
5. Приводятся выводы по работе.
| Объем_2 п.л.. Заказ /0- /'«?<Г Бесплатно |
Подписано к печати Ле7^ й^г Формат 60х84/16 Тираж 125' Печать плоская
Ротапринт ТюмГНГУ, 625036, Тюмень, Володарского, 38
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЕГАЗОВЫЙ УНИВЕРСИТЕТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к лабораторным работам по курсу: "Физическая химия", раздел "Электродвижущие силы и электродные потенциалы" для студентов специальностей:
2501 - "Химическая технология органических веществ";
2504-"Химическая технология природных энергоносителей и углеродных материалов".
очной формы обучения
Тюмень 2000 г.
Дата добавления: 2019-07-17; просмотров: 598; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
