Основные типы гальванических цепей.
Утверждено редакционно-издательским советом .Тюменского Государственного Нефтегазового Университета
Составители: Захаров М.С. - заведующий кафедрой физической и аналитическойхимии, доктор химических наук, профессор;
Захарова О.М. - ассистент;
Туровинина О.И. - ведущийинженер
© Тюменский Государственный Нефтегазовый Университет, 2000 г.
Термодинамика электрохимических процессов. Электродвижущие силы. Электродные потенциалы.
Термодинамика электрохимического элемента.
Рассмотрим, что такое электрохимический элемент. Превращение химической энергии в электрохимическую возможно в гальваническом элементе. Гальванический элемент - это устройство, позволяющее получать электрический ток за счет протекания химической реакции.
За некоторым исключением реакцию можно провести обычным химическим путем или в гальваническом элементе. Например, реакцию взаимодействия:
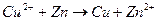
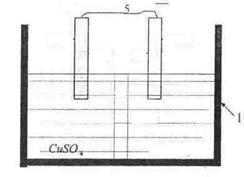
можно реализовать опустив цинковую пластинку в раствор сульфата меди. При этом, эта реакция будет протекать химическим путем. Эту же реакцию можно реализовать в гальваническом элементе, изображенном на рис. 1.1.
|
Рис. 1.1. Медноцинковый гальванический элемент. 1 - сосуд; 2 - цинковый электрод; 3 - медный электрод; 4 - полупроницаемая перегородка; 5 - соединительный провод. |
|
|
На электродах и в гальваническом элементебудут протекатьследующие процессы:
|
|
|
 на положительном полюсе (+) ,
на положительном полюсе (+) ,
на отрицательном полюсе (-)
суммарная реакция в элементе
Путь реакции, реализуемой в гальваническом элементе, называется электрохимическим. При реализации реакции химическим путем электроны непосредственно передаются от металлического цинка иону меди. При реализации реакции электрохимическим путем электроны от металлического цинка передаются иону меди по проводнику. В основе всякой гальванической цепи лежит окислительно-восстановительная
реакция, которая протекает таким образом, что окисление происходит на одном полюсе(отрицательном), а восстановление на другом полюсе(положительном).
Растворы сульфата меди и сульфата цинка воизбежание ихперемешивания разделены полупроницаемой перегородкой.
Изображенный на рис. 1.1. гальванический элемент записывается следующим образом:

(+) (-)
aq aq
Если электроды соединить металлическим проводником,то происходит растворение цинкового электрода. Катионы цинка переходят в раствор, а электрод при этом заряжается отрицательно; катионы меди разряжаются на медном электроде. По внешнему металлическому проводнику поток электронов переходит с цинкового электрода на медный, давая электрический ток. Медный электрод служит положительным полюсом элемента, а цинковый- отрицательным. Между отрицательным и положительным полюсами возникает разность потенциалов. Если гальванический элемент работает в термодинамически обратимых условиях, то эта разность потенциалов будет максимальной ионаназывается электродвижущей силой элемента (ЭДС).
|
|
|
Если активности веществ, участвующих в электродных процессах, равны единице, то возникающая при этом ЭДС называется стандартной ЭДС (Еº).
Для обратимо работающего гальванического элемента (приР=соп st и Т'=соп st) будем иметь:
Ат '=zFE, (1.1)
a Ат '=-ΔG (1.2). Из (1.1) и (1.2) получим
Ат'=-Δ G= zFE, (1.3)
где А т' -максимально полезная работа гальванического элемента; ΔG -изменение энергии Гиббса для реакции, протекающей в гальваническом элементе; Е -электродвижущая сила элемента.
Из (1.3) получаем:
ΔG=- zFE (1.4)
Изменение энтропии для любого процесса определяется уравнением:
|
|
|
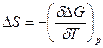 (1.5)
(1.5)
Берем дифференциал от уравнения (1.4) по температуре:
 (1.6)
(1.6)
|
|
Подставляя уравнение (1.6)в уравнение (1.5) получим:
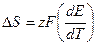 (1.7)
(1.7)
Теперь найдем значение ΔН реакции, протекающей в гальваническом элементе. Из термодинамики известно уравнение:
ΔG=ΔH-TΔS (1.8)
Подставляем уравнения (1.4) и (1.7) в уравнение (1.8) и получаем:
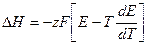 (1.9).
(1.9).
Связь между стандартной ЭДС и константой равновесия (К,) реакции, протекающей в гальваническом элементе, можно найти воспользовавшись уравнением изотермы химической реакции:
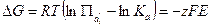 (1.10)
(1.10)
Из уравнения (1.10) следует:
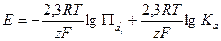 (1.11)
(1.11)
|
|
Если 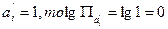 и E=Eº
и E=Eº
Из уравнения (1.11) в этом случае получаем:
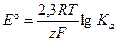 (1.12)
(1.12)
|
|
|
Электродные потенциалы.
Для рассмотрения понятия электродного потенциала рассмотрим два примера.
1-ый пример. Пусть имеется насыщенный раствор сахара:
сахар(раствор) ↔ сахар(твердый)
Химический потенциал сахара в растворе 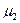 , а химический потенциал
, а химический потенциал
твердого сахара 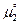 .В момент равновесия
.В момент равновесия 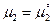 , т.е.
, т.е. 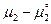 =0. Если
=0. Если 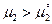 , то сахар кристаллизуется из раствора, если
, то сахар кристаллизуется из раствора, если 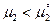 , то сахар растворяется.
, то сахар растворяется.
2-ой пример. Медная пластинка опущена в раствор сульфата меди. На ней протекает процесс  .Химический потенциал меди в медной пластине
.Химический потенциал меди в медной пластине 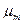 , а химический потенциал ионов меди в растворе
, а химический потенциал ионов меди в растворе 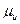 .Если
.Если 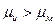 , то равновесие этого процесса сдвигается вправо. С медной пластинки электроны переходят на ионы меди и медная пластинка заряжается положительно. Поскольку часть ионов меди разряжается, то у поверхности пластинки со стороны раствора возникает избыток
, то равновесие этого процесса сдвигается вправо. С медной пластинки электроны переходят на ионы меди и медная пластинка заряжается положительно. Поскольку часть ионов меди разряжается, то у поверхности пластинки со стороны раствора возникает избыток
отрицательно заряженных ионов 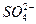 .Эта картина схематически представлена на рис. 1.2.
.Эта картина схематически представлена на рис. 1.2.
 + -
+ -
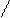 + -
+ -
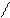 металл + раствор
металл + раствор
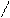
 + -
+ -
Рис. 1.2 Схема образования двойного
электрического слоя.
Таким образом, в системе образуется двойной электрический слой. Этот слой подобен конденсатору и в нем возникает скачок потенциала, который и называется электродным потенциалом.
Ионы меди при выделении должны преодолеть двойной электрический слой, т.е. они должны совершить работу против электрических сил двойного электрического слоя. Условием равновесия в системе будет:
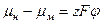 , (1.13)
, (1.13)
где (р -равновесный электродный потенциал. Таким образом, равновесие между раствором электролита и электродом устанавливается тогда, когда работа перенесения одного грамм-ионаизраствора в металл, равная разности химических потенциалов ионов в растворе и атомов в металле, станет равной работе против электрических сил в двойном электрическом слое.
Равновесный электродный потенциал зависит от активностиреагентов, участвующих в электродном процессе. Для нахожденияэтой зависимости воспользуемся уравнением для химического потенциала:
 , (1.14)
, (1.14)
где μ-стандартный химический потенциал; а - активность реагента. Запишем уравнение (1.14) для иона (окисленная форма) и металла (восстановленная форма вещества):
 , (1.15)
, (1.15)
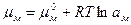 , (1.16)
, (1.16)
где 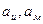 - активности окисленной и восстановленной форм вещества. Подставляя уравнения (1.15 , 1.16) в уравнение (1.13) получим уравнение, устанавливающее зависимость равновесного электродного потенциала от активностей:
- активности окисленной и восстановленной форм вещества. Подставляя уравнения (1.15 , 1.16) в уравнение (1.13) получим уравнение, устанавливающее зависимость равновесного электродного потенциала от активностей:
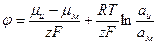 (1.17)
(1.17)
Если 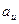 и
и  , то
, то 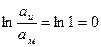 . В этом случае уравнение (1.17)
. В этом случае уравнение (1.17)
приведется к виду:
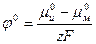 , (1.18)
, (1.18)
где φº-стандартный электродный потенциал.
Между ЭДС гальванического элемента и электродным потенциалом существует связь: .
 , (1.19)
, (1.19)
где 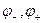 - равновесные потенциалы положительного и отрицательного полюсов гальванического элемента.
- равновесные потенциалы положительного и отрицательного полюсов гальванического элемента.
Опытным путем нельзя определить абсолютную величину электродного потенциала; можно определить только величину ЭДС. Поэтому условились считать равной нулю величину стандартного водородного электрода, т.е. величину потенциала водородного электрода при 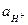 = 1 и
= 1 и  (
(  - давление водорода в электроде). Например, для измерения потенциала медного электрода собирают гальваническую цепь:
- давление водорода в электроде). Например, для измерения потенциала медного электрода собирают гальваническую цепь:
(+) 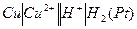 (-)
(-)
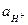 = 1
= 1 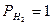
ЭДС этой гальванической цепи равна:
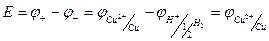
Таким образом, численное значение электродного потенциала равно ЭДС гальванического элемента, составленного из данного электрода и стандартного водородного электрода.
Электродному потенциалу электрода приписывают знак, одинаковый со знаком полюса элемента, составленного из этого электрода и стандартного водородного электрода.
Величины стандартных равновесных электродных потенциалов были определены опытным путем для большинства металлов. Если расположить величины стандартных равновесных электродных потенциалов в порядке возрастания их алгебраических величин, то получится ряд напряжений:
Электрод: 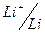 ;
; 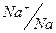 ;
;  ;
;  ;
;

φº , B: -3.045; -2.714; -0.763; -0.126
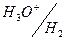 ;
; 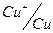 ;
; 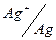
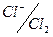
0,00; +0,521; +0,729; +1,360
Отрицательный стандартный потенциал имеют электроды, которые по отношению к стандартному водородному электроду заряжаются отрицательно, т.е. на этом электроде при работе соответствующего гальванического элемента атомы переходят в раствор. Переход же ионов из раствора в металл осуществляется только путем электролиза. Положительный стандартный потенциал имеют электроды, которые по отношению к стандартному водородному электроду заряжаются
положительно, т.е. при работе соответствующего гальванического элемента ионы металла переходят из раствора в металл.
Знак заряда электрода, входящего в ту или иную гальваническую цепь, по отношению к другому электроду этой цепи может и не совпадать со знаком заряда в ряду напряжений, т.к. этот знак зависит от вида другого электрода в элементе. Например, в гальваническом элементе, составленном из свинцового и медного электродов, свинцовый электрод будет электроотрицательным полюсом, а в гальваническом элементе, составленном из цинкового и свинцового электродов, свинцовый электрод будет электроположительным полюсом.
1.3. Типы и виды электродов.
Электроды, изготовленные из металла, погруженного в раствор его ионов,' работают на основе обмена катионами между электродом и раствором. Такие электроды называются электродами обратимыми относительно катиона. На них протекает электродная реакция:
Ме-2е↔ 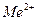
На таком электроде реакция протекает слева направо, если электрод более отрицателен, чем второй электрод, соединенный с ним, и справа налево, если его потенциал более положителен, чем потенциал второго электрода. Для такого электрода уравнение для потенциала имеет вид:
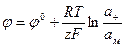 (1.20)
(1.20)
где  - активность катиона в растворе.
- активность катиона в растворе.
Для металла  = 1. Отсюдаиз (1.20) следует:
= 1. Отсюдаиз (1.20) следует:
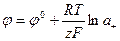 (1.21)
(1.21)
Существуют также электроды обратимо обменивающиеся с раствором анионами. Также электроды называются обратимыми относительно аниона. Примером такого электрода может служить йодный электрод, изготовленный из платины, покрытой йодом, и погруженный в раствор, содержащий 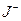 .На этом электроде протекает реакция:
.На этом электроде протекает реакция:
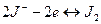
Она протекает слева направо, если электрод отрицателен относительно второго электрода, и справа налево, если он положителен относительно второго электрода. Для таких электродов
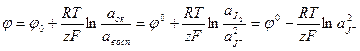 (1.22)
(1.22)
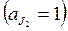
Различают электроды 1-го и 2-го рода. Электродами 1-го рода называются системы, в которых концентрация ионов в растворе, относительно которых обратим электрод, может быть различной, а электродами 2-го рода называются системы, в которых эта концентрация постоянна, так как в электродах применяются насыщенные растворы. Электроды 2-го рода построены из металла, покрытого малорастворимой его солью, погруженного в раствор какой-нибудь легко растворимой соли с тем же анионом. Примером такого электрода может служить хлорсеребряный электрод:
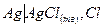
В таком электроде идет обратимая реакция образования AgCl из А g-электрода и С l¯раствора:
Ag+Cl¯↔AgCl+e
Потенциал этого электрода будет:
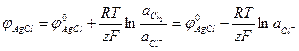
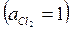 (1. 24)
(1. 24)
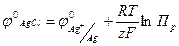 (1.24)
(1.24)
где Пр - произведение растворимости А gС1.
Электроды 2-го рода отличаются хорошей воспроизводимостью, большим постоянством и легко могут быть изготовлены. Поэтому их часто применяют в качестве эталонных электродов вместо водородного электрода.
Существуют также электроды, которые не обмениваются с раствором ни катионом, ни анионом, а лишь обеспечивают подвод электронов для окислительно-восстановительной реакции, протекающей на границе электрод-раствор. Такие электроды называются окислительно-восстановительными. Примером такого электрода может служить электрод, состоящий из платины, погруженной в раствор, содержащий ионы Fе2+ и Fе3+ На таком электроде протекает реакция:
Fе3+ +e↔ Fе2+ Уравнение для потенциала электрода имеет вид:
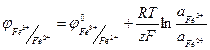 (1.25)
(1.25)
Своеобразную группу составляют газовые электроды, в которых проводник из металла ( Pt, Jr, Au) погруженного в раствор, непрерывно насыщается газом, который вступает в обмен с ионами раствора. Газовые
электроды могут быть обратимыми какотносительно катиона (водородный электрод), так и аниона (хлорный электрод).
Основные типы гальванических цепей.
Различают химические и концентрационные гальванические цепи. Электрохимическая система, работающая за счет осуществления химической реакции называется химической цепью.
Различают химические цепи с двумя и одним электролитом. К электрохимическим цепям с двумя электролитами относится элемент Якоби-Даниэля:
(+) Cu│Cu2+ ││Zn2+ │Zn (-)
На электродах этого элемента протекают следующие реакции:
(+) С u2+ +2е→Си,
(-) Zn -2е→ Zn2+
Суммарная реакция, протекающая в гальваническом элементе, следующая:
С u2++ Zn→Си+ Zn2+
ЭДС этого, гальванического элемента будет определяться уравнением:
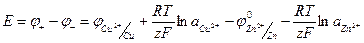 (1.27)
(1.27)
Уравнение (1.26) с учетом уравнения (1.27) запишется в следующем виде:
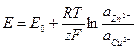 (1.28)
(1.28)
Примером химической цепи с одним электролитомможет быть цепь:
(+) 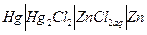 (-)
(-)
Электродные и суммарная реакция в этом гальваническом элементе будут следующие:
(+) 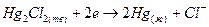
(-) 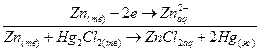
Потенциалы электродов и ЭДС этого гальванического элемента будут описываться следующими уравнениями:
 (1.29)
(1.29)
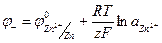 (1.30)
(1.30)
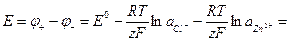
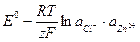
где 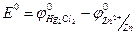
Из приведенных гальванических цепей видно,что в химических цепях электроды отличаются химическими свойствами.
Концентрационными гальваническими элементами называются элементы, в которых оба электрода одинаковы по своей природе, но различаются активностью растворов или металла электрода. Электрическая энергия в этих элементах получается за счет выравнивания концентраций веществ в элементе.
Концентрационные элементы могут быть без переноса и с переносом. Концентрационными элементами без переноса являются следующие элементы: а) с одинаковыми электродами и двумя одинаковыми по природе, но различными по концентрации растворами электролитов, причем между растворами отсутствует непосредственное соприкосновение; б) с электродами из двух сплавов, одинаковых по природе, но различных по концентрации (с одним раствором электролита);
в) с газовыми электродами, одинаковыми по природе, но с различными давлениями газа на электродах (с одним раствором электролита).
Примером концентрационного элемента без переноса с одинаковыми , электродами и с двумя одинаковыми электролитами разной концентрации служит элемент:
(+)  (-),
(-),
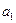
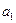 >
> 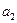
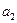
где 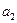 ,
, 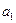 - активности
- активности 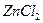 в растворах левого и правого электродов. Электродные и суммарная реакции в этом гальваническом элементе следующие:
в растворах левого и правого электродов. Электродные и суммарная реакции в этом гальваническом элементе следующие:
(+) 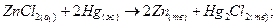
(-) 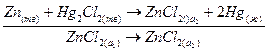
Электрическая энергия в рассматриваемом гальваническом элементе получается за счет выравнивания концентраций 2пС1^ в правой и левой частях гальванического элемента. ЭДС этого элемента определяется уравнением:
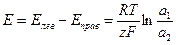 (1.33)
(1.33)
где 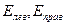 - ЭДС левого и правого полуэлементов.
- ЭДС левого и правого полуэлементов.
Примером концентрационной цепи с разными концентрациями металла электрода может служить элемент:
(+) 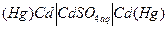 (-),
(-),
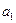
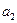 >
> 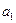
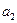
где 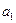 ,
, 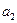 - концентрации кадмия в ртути левого и правого электродов. Электродные и суммарная реакции в этом элементе следующие:
- концентрации кадмия в ртути левого и правого электродов. Электродные и суммарная реакции в этом элементе следующие:
(+) 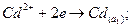
(-) 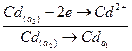
ЭДС этого концентрационного элемента получается за счет выравнивания активности кадмия в обеих амальгамах.
Уравнения для электродных потенциалов и для ЭДС этого элемента следующие:
 (1.34)
(1.34)
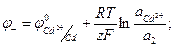 (1.35)
(1.35)
 (1.36)
(1.36)
Примером газового концентрационного элемента может служить элемент:
(+) 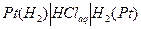 (-)
(-)

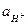
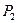
Электродные и суммарная реакции в этом гальваническом элементе следующие:
(+) 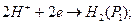
(-) 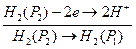
ЭДС газового концентрационного элемента без переноса получается за счет выравнивания давления водорода на обоих электродах
Уравнения для потенциалов электродов и ЭДС этого элемента имеют вид:
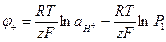 (1.37)
(1.37)
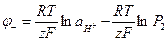 (1.38)
(1.38)
 (1.39)
(1.39)
Концентрационной цепью с переносом является гальванический элемент с двумя одинаковыми электродами и с двумя растворами одинаковых электролитов, но разной концентрации, при этом между обоими растворами имеется жидкостный контакт. В этом жидкостном контакте возникает диффузионный скачок потенциала (  ).
).
Концентрационный элемент с переносом может быть составлен из электродов 1-го рода и электродов 2-го рода. Примером элемента, составленного из электродов 1-го рода, может быть следующий гальванический элемент:
(+) 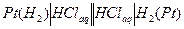 (-)
(-)
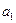 ↑
↑ 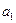
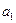 >
> 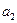
жидкостная граница
Суммарным процессом концентрационной цепи с переносом является только перенос электролита из одного раствора в другой в процессе диффузии через жидкостную границу.
ЭДС этого элемента будет равна:
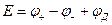 (1.40)
(1.40)
где  -величина жидкостного диффузионного потенциала.
-величина жидкостного диффузионного потенциала.
Электрическая энергия в этом элементе получается за счет диффузии электролита из раствора с большей концентрацией в раствор с меньшей концентрацией, при этом переход ионов электролита происходит непосредственно через жидкостную границу за счет диффузии в отличие от цепей без переноса.
Уравнение (1.40) для рассматриваемого гальванического элемента можно привести к виду:
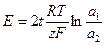 (1.41)
(1.41)
Из уравнения (1.41) видно, что если оба электрода концентрационной цепи с переносом обратимы относительно катиона, то в выражении для ЭДС множителем входит число переноса аниона, при этом в пространстве положительного полюса концентрация электролита больше, чем в пространстве отрицательного полюса.
Примером концентрационной цепи с переносом с электродами 2-го рода является цепь:
(+) Ag,AgCl│KCl║KCl│AgCl,Ag (-)
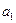
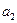
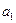 >
> 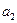
ЭДС этой гальванической цепи определяется уравнением:
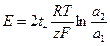 (1.42)
(1.42)
Из уравнения (1.42) следует, что если оба электрода концентрационной цепи с переносом обратимы относительно аниона, то в уравнении для ЭДС входит множителем число переноса катиона, при этом концентрация в пространстве положительного полюса меньше, чем в пространстве отрицательного полюса.
В гальванической цепи с переносом на границе двух растворов электролитов возникает разность потенциалов, которая называется диффузионным потенциалом. Растворы могут различаться природой и концентрацией электролитов. В общем случае уравнения для вычисления диффузионного потенциала получаются сложными . Рассмотрим два частных случая: а) диффузионный потенциал на границе растворов двух одинаковых электролитов, но разной концентрации; б) диффузионный потенциал на границе двух растворов электролитов одинаковой концентрации, но различающихся одним из ионов.
Для первого случая границу двух растворов электролитов можно представить как НС1\\НС1.
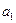

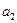
Пусть 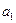 >
> 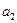 , тогда через границу раздела ионы водорода и хлорид- ионы будут переходить слева направо
, тогда через границу раздела ионы водорода и хлорид- ионы будут переходить слева направо 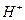
 |  |
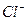

Подвижность ионов водорода больше подвижности хлорид- иона и, следовательно, с правой стороны границы будет возникать больший положительный заряд, чем с левой стороны и возникает двойной электрический слой. В двойном слое возникает скачок потенциала, который и является диффузионным потенциалом. Таким образом, причина возникновения  состоит в разной подвижности ионов и возникновении двойного электрического слоя на границе двух растворов электролита.
состоит в разной подвижности ионов и возникновении двойного электрического слоя на границе двух растворов электролита.
Уравнение для вычисления диффузионного потенциала можно вывести используя уравнения( 1.40), (1.41) и (1.33):
Из уравнения (1.40) можно получить:

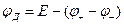 (1.43)
(1.43)
Из уравнения (1.33) следует:
 (1.44)
(1.44)
Из уравнения (1.41):
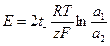 (1.45)
(1.45)
Подставляем (1.44) и (1.45) в (1.43) и получаем:
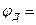
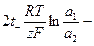


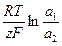 (1.46)
(1.46)
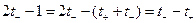 (1.47)
(1.47)
Отсюда:
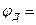
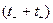
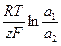 (1.48)
(1.48)
Из уравнения (1.48) следует, что если 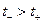 то
то  имеет положительный знак и Е будет больше
имеет положительный знак и Е будет больше 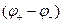 и наоборот.
и наоборот.
Границу раздела двух растворов электролитов одинаковой концентрации, но различающихся одним из ионов можно представить следующим образом : NаС1\\КС1.
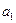
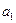
Ионы 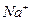 будут диффундировать слева направо, а ионы
будут диффундировать слева направо, а ионы 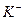 наоборот - справа налево. Так как
наоборот - справа налево. Так как 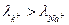 , то с левой стороны границы будет
, то с левой стороны границы будет
избыток ионов калия. В результате этого с левой стороны граница будет иметь избыток положительного заряда, а с правой - избыток отрицательного заряда. Образуется двойной электрический слой, в котором возникает скачок потенциала - диффузионный потенциал. Уравнение для вычисления <рд для этого случая будет иметь вид:
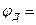
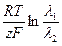
где 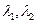 - эквивалентные электропроводности КС1 и N aCl (
- эквивалентные электропроводности КС1 и N aCl ( 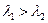 )
)
Наибольший диффузионный потенциал возникает на границе растворов, содержащих кислоты и щелочи. Наличие диффузионного потенциала нежелательно при физико-химических измерениях, т.к. он будет вносить ошибку в определяемые физико-химические величины. Поэтому в физико-химических измерениях стараются устранять
диффузионный потенциал. Для устранения диффузионного потенциала между двумя растворами в гальванической цепи вводят солевой мостик с концентрированным раствором электролита с катионом и анионом, имеющих одинаковые подвижности. Например, собирают такую гальваническую цепь:
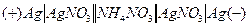
 конц.
конц. 
Подвижность ионов NН  и N0
и N0 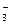 при 25ºС в водном растворе равны 74,3 и 71,4 , соответственно, т.е.
при 25ºС в водном растворе равны 74,3 и 71,4 , соответственно, т.е. 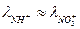 . Высокая концентрация NН
. Высокая концентрация NН 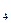 NО
NО 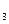 приводит к тому, что диффузионный потенциал на границе между солевым мостиком и раствором определяется диффузией ионов NН
приводит к тому, что диффузионный потенциал на границе между солевым мостиком и раствором определяется диффузией ионов NН 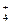 и N0
и N0 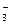 . Уменьшение диффузионного потенциала объясняется тем, что числа переноса и подвижности ионов указанных солей близки.
. Уменьшение диффузионного потенциала объясняется тем, что числа переноса и подвижности ионов указанных солей близки.
Дата добавления: 2019-07-17; просмотров: 1493; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!