Применение метода ЭДС для определения физико-химических величин.
Метод ЭДС широко применяется для измерения физико-химических величин, т.к. ЭДС легко измеряется на опыте. Главное затруднение состоит в том, что для искомой химической реакции, физико-химические характеристики, которой нужно определить, необходимо составить гальванический элемент без диффузионных потенциалов или с диффузионными потенциалами, которые можно вычислить. Удобнее всего для измерений использовать гальванический элемент с одним электролитом. Обычно в этих расчетах входит стандартная ЭДС, которая вычисляется по формуле:
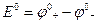 (1.50)
(1.50)
Значения 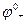 и
и 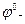 берутся из таблиц. Диффузионный потенциал или устраняется, или вычисляется. Во многих случаях нужно только мысленно составить гальванический элемент, чтобы знать для каких электродных реакций нужно использовать
берутся из таблиц. Диффузионный потенциал или устраняется, или вычисляется. Во многих случаях нужно только мысленно составить гальванический элемент, чтобы знать для каких электродных реакций нужно использовать 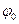 из таблиц. В этом случае практическое осуществление элемента не имеет значения.
из таблиц. В этом случае практическое осуществление элемента не имеет значения.
1.5.1. Определение стандартных термодинамических функций Δ Gº, Δ Sº, Δ Hº для химической реакции.
Для химической реакции, протекающей в гальваническом элементе, при стандартных условиях(активности всех реагирующих веществ равны единице):
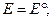

Определение коэффициента активности электролита.
Коэффициент активности fопределяется из уравнения:
f=a/c; a=f*c
|
|
|
где а, с- активность и концентрация электролита.
Рассмотрим определение коэффициента активности электролита для раствора НС l. Для определения активности электролита нужно собрать следующий гальванический элемент:
(+)Ag|AgCl|HCl|H  (Pt)(-)
(Pt)(-)
Для этого элемента:
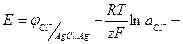

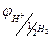 (1.52)
(1.52)
Уравнение (1.52) можно привести к виду:
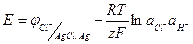 (1.54)
(1.54)
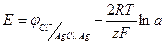
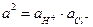 - средняя активность электролита.
- средняя активность электролита.
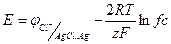 (1.55)
(1.55)
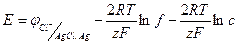 (1.56)
(1.56)
Из уравнения (1.56) получаем:
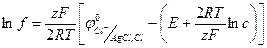 (1.57)
(1.57)
Значение 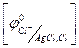 находят в таблицах, а величину Е измеряют экспериментально.
находят в таблицах, а величину Е измеряют экспериментально.
Определение константы равновесия электрохимической реакции.
Определение основано на использовании уравнения:
|
|
|
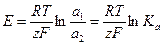 (1.58)
(1.58)
где K 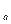 - константа равновесия электрохимической реакции.
- константа равновесия электрохимической реакции.
При стандартных условиях уравнение (1.58) запишется в следующем виде:
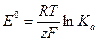 (1.59)
(1.59)
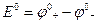 (1.60)
(1.60)
Порядок определения константы равновесия следующий:
1. Записываются уравнения электрохимической реакции и выражение для искомой константы равновесия;
2. Мысленно составляется гальванический элемент, в котором бы протекала рассматриваемая реакция в гальваническом элементе;
3. Записываются электродные реакции и суммарная реакция в гальваническом элементе;
4. Записываются выражение для константы равновесия реакции, протекающей в гальваническом элементе, и связь ее с искомой константой равновесия;
5. Устанавливается связь стандартной ЭДС со стандартными электродными потенциалами;
6. Записывается искомое выражение для константы равновесия через ЭДС.
1.5.3.1. Определение произведения растворимости 1л малорастворимой
соли (например А gС1 ).
В соответствии с выше описанным порядком записываем уравнение реакции: А gС1 = А g 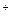 + С l
+ С l  и выражение для искомой константы равновесия:
и выражение для искомой константы равновесия:
|
|
|
 (1.61)
(1.61)
Теперь мысленно составляем гальванический элемент, в котором бы протекала рассматриваемая реакция:
(+)Ag| AgNO 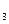 || KCl| AgCl, Ag(-)
|| KCl| AgCl, Ag(-)
Записываем электродные реакции и суммарную реакцию:
(+) Ag 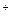 +e↔Ag
+e↔Ag 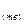
(-) 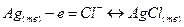
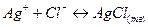
Далее записываем выражение для константы равновесия реакции, протекающей в составленном гальваническом элементе:
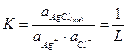 (1.62)
(1.62)
Связь этой константы равновесия с искомой находится с использованием уравнений (1.61) и (1.62):
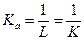 (1.63)
(1.63)
Устанавливаем взаимосвязь стандартной ЭДС со стандартными электродными потенциалами:
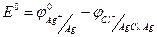 (1.64)
(1.64)
|
|
|
И наконец записываем искомое выражение для константы равновесия (L 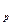 ) через ЭДС:
) через ЭДС:
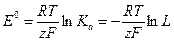 (1.65)
(1.65)
Из (1.64) и (1.65) находим уравнение для вычисления Ь:
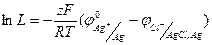 (1.66)
(1.66)
Дата добавления: 2019-07-17; просмотров: 2126; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
