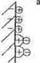
Определение константы нестойкости комплексных ионов.
Все выводы проводятся по изложенной выше методике. В качестве примера получим уравнение для расчета константы нестойкости (K 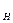 ) комплекса [Ag( CN)
) комплекса [Ag( CN)  ]
] 
[Ag(CN)  ]
]  ↔Ag
↔Ag 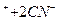
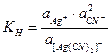 (1.67)
(1.67)
Составляем мысленно гальваническую цепь, в которой протекает 'рассматриваемая реакция:
(+)Ag|AgNO 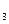 ||KCN,[Ag(CN)
||KCN,[Ag(CN)  ]
] 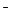
(+)Ag 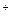 +e↔Ag
+e↔Ag 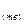
(-)Ag 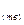 +2CN
+2CN 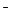 -e↔[Ag(CN)
-e↔[Ag(CN)  ]
] 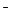

Ag 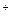 +2CN
+2CN 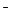 ↔[Ag(CN)
↔[Ag(CN)  ]
] 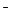
 (1.68)
(1.68)
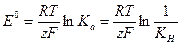 (1.69)
(1.69)
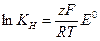 (1.70)
(1.70)
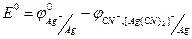
Определение константы равновесия химической реакции.
Определение проведем на примере реакции:
2Fe 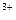 +Sn
+Sn 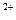 ↔2Fe
↔2Fe 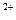 +Sn
+Sn 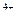
Выполняя операции аналогичные предыдущим получим:
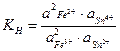 (1.72)
(1.72)
Мысленно составляем гальванический элемент, в котором протекает рассматриваемая реакция:
(+)Pt|Fe 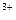 ,Fe
,Fe 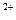 ||Sn
||Sn 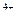 ,Sn
,Sn 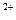 |Pt (-)
|Pt (-)
|
|
|
(+)2Fe 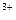 +2e↔2Fe
+2e↔2Fe 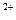
(+)Sn 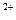 -2e↔Sn
-2e↔Sn 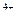
 2Fe
2Fe 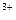 +Sn
+Sn 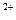 ↔2Fe
↔2Fe 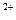 +Sn
+Sn 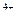
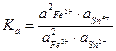 (1.73)
(1.73)
Из уравнений (1.72) и (1.73) следует:
K 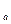 =K (1.74)
=K (1.74)
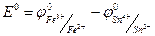 (1.75)
(1.75)
 (1.76)
(1.76)
1.5.3.4. Определение рН растворов.
рН=-l ga 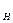 (1.77)
(1.77)
Наибольшее распространение для определения рН растворов получил стеклянный электрод. Потенциал стеклянного электрода описывается уравнением:
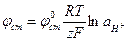 , (1.78)
, (1.78)
где 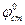 - постоянная стеклянного электрода. Для каждого электрода она различна и находится опытным путем. Для определения рН составляется следующая гальваническая цепь:
- постоянная стеклянного электрода. Для каждого электрода она различна и находится опытным путем. Для определения рН составляется следующая гальваническая цепь:
(+)стекл. электр.| испыт.раствор||КС1|А gС1,А g(-)
ЭДС для этого электрода запишется следующим образом:
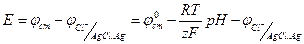 (1.79)
(1.79)
Из (1.79) находим уравнение для вычисления рН раствора:
 (1.80)
(1.80)
|
|
|
2. Строение двойного электрического слоя награнице электрод-раствор электролита.
При погружении металла в раствор на границе металла и раствора образуется двойной электрический слой. По современным представлениям существует несколько причин возникновения двойного электрического слоя:
1. Двойной электрический слой образуется в результате обмена ионами между металлом и раствором электролита.
Если химический потенциал атомов металла больше химического потенциала иона, то на границе раздела протекает процесс:
Ме-2е→Ме2+
При этом ионы выходят в раствор, а на металле остаются электроны. В результате этого граница раздела металла и раствора со стороны металла заряжается отрицательно, а со стороны раствора положительно.
Если химический потенциал иона окажется больше химического потенциала металла, то на границе раздела будет протекать процесс;
Ме2++2е->Ме
При этом ионы металла будут с поверхности металла забирать электроны. В результате этого граница раздела металла и раствора со стороны металла будет заряжаться положительно, а со стороны раствора - отрицательно (рис.2.2). В обоих случаях на границе раздела металл-раствор возникает двойной электрический слой, который называется ионным двойным электрическим слоем.
|
|
|
2. Двойной электрический слой образуется в результате специфической адсорбции на поверхности электрода ионов одного знака (рис.2.3).
металл ) раствор
 ионныйдвойной
ионныйдвойной
электрический
слой
адсорбционный
двойной
электрический
слой
металл раствор
ионный двойной
электрический
слой
адсорбционный двойной
электрический слой
рис.2.3
металл раствор
раствор металл
адсорбционный двойной электрический слой
адсорбционный двойной электрический слой
рис.2.4
Специфическая адсорбция может происходить и на заряженной (рис.2.3) и на не заряженной поверхности металла (рис.2.4). К адсорбированным ионам со стороны раствора притягиваются ионы противоположного знака. При этом образуется двойной электрический слой, который называется адсорбционным двойным электрическим слоем.
|
|
|
Если знаки заряда обкладок со стороны металла и со стороны раствора одинаковы, то скачки потенциалов в обменном и 22
адсорбционном двойных электрических слоях складываются и наоборот.
3. Двойной электрический слой образуется за счет адсорбции дипольных молекул.
Если поверхность металла заряжена, то к ней будут притягиваться дипольные молекулы растворителя. Ориентация молекул приводит к образованию двойного электрического слоя.
4. Двойной электрический слой образуется в результате выхода электронного газа на некоторое время за пределы границы металла.
В результате этого на поверхности металла со стороны раствора появляется избыточный отрицательный заряд, а со стороны металла -избыточный положительный заряд. Это и приводит к образованию двойного электрического слоя и соответственно к образованию скачка потенциала, который называется контактным потенциалом.
Как правило, все виды двойных электрических слоев реализуются одновременно. Если сумма скачков потенциалов во всех двойных электрических слоях равна нулю, то на поверхности металла имеется абсолютный нуль потенциала. Потенциал, при котором отсутствует обменный двойной электрический слой, называется потенциалом нулевого заряда.
Двойной электрический слой состоит из плотной и диффузной частей. Плотный двойной электрический слой образован плотно притянутыми к поверхности металла электрическими силами и силами специфической адсорбции ионами. Эти ионы расположены на расстоянии радиуса d сольватированного иона.
Диффузный двойной слой образован ионами, расположенными на расстоянии больше d от поверхности электрода. Такое расположение ионов получается под влиянием двух противоположных факторов:
электростатических сил, которые стремятся притянуть ионы плотно к поверхности электрода, и теплового движения, которое стремится хаотически расположить ионы в растворе.
Плотность заряда в плотном двойном электрическом слое равномерно убывает от поверхности. Плотность заряда в диффузном двойном электрическом слое убывает постепенно до нуля по мере удаления от поверхности электрода. Фактически же на расстоянии в несколько десятков атомных диаметров от поверхности электрода плотность зарядов становится пренебрежительно малой.
Скачок потенциала в диффузном двойном слое называют диффузным ψ-потенциалом. Общий скачок потенциала φ Скачок потенциала в плотном двойном слое φ-ψ,.
С увеличением концентрации раствора электролита двойной электрический слой сжимается, ионы приближаются к поверхности электрода и большая их часть из диффузного двойного электрического слоя переходит в плотный двойной электрический слой.
Кроме диффузного ψ -потенциала еще существует адсорбционный ψ -потенциал. Его возникновение связано со специфической адсорбцией ионов (рис.2.7.а,б) на поверхности электрода. Знак адсорбционного ψ -потенциала может совпадать и не совпадать со знаком общего потенциала электрода φ (рис 2.8.а,б). Для случая (2.7.6) потенциал электрода изменяется как показано на рис(2.8.а), а для случая (2.7.а) - как на рис(2.8.б).
|
|
| Рис.2.7. |
|
|
|
|
| Рис.2.8. |
 б
б
Рис,2.8
Дата добавления: 2019-07-17; просмотров: 376; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!