Виды спектров. Спектральный анализ.
Спектральный состав излучения атомов различных веществ весьма разнообразен. Тем не менее, все спектры можно разделить на три сильно отличающихся друг от друга типа.
Непрерывные (сплошные) спектры. В непрерывном спектре излучения (рис. 19.12.1) представлены волны всех длин. В спектре нет разрывов, и на экране спектрографа можно видеть сплошную разноцветную полосу с плавным переходом от одного цвета к другому.
Непрерывные (или сплошные) спектры дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры. Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом. Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.
Линейчатые спектры. Линейчатые спектры излучения (Рис. 19.13.2,3,4) представляют собой набор цветных линий различной яркости, разделенных широкими темными полосами. Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая из линий имеет конечную ширину. Линейчатые спектры дают все вещества в газообразном атомарном (но не в молекулярном) состоянии. Изолированные атомы химического элемента излучают строго определенные длины волн, характерные данному химическому элементу. Природа линейчатых спектров объясняется тем, что у атомов конкретного вещества существуют только ему свойственные стационарные состояния со своим набором энергетических уровней.
|
|
|
Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом. При увеличении плотности атомарного газа отдельные спектральные линии расширяются и, при очень большой плотности газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Полосатые спектры. Полосатые спектры излучения состоят из отдельных полос, разделенных темными промежутками (Рис 19.14: а, б).
С помощью очень хорошего спектрального прибора можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
|
|
|
Спектры поглощения. Если пропускать белый свет сквозь холодный, неизлучающий газ, то на фоне непрерывного спектра источника появляются темные линии поглощения (Рис. 19.15). Газ поглощает наиболее интенсивно свет как раз тех длин волн, которые он испускает в сильно нагретом состоянии. Темные линии на фоне непрерывного спектра - это линиипоглощения, образующие в совокупности спектр поглощения. Спектры поглощения могут быть непрерывными, линейчатыми и полосатыми.
Атом, поглощая свет, переходит из основного состояния в возбужденное, причем для возбуждения атомов пригодны строго определенные кванты энергии 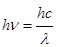 , соответствующие данному газу. Поэтому газ поглощает из непрерывного спектра те самые кванты света, которые может излучать сам.
, соответствующие данному газу. Поэтому газ поглощает из непрерывного спектра те самые кванты света, которые может излучать сам.
Гипотеза де Бройля. Экспериментальное подтверждение гипотезы.
Французский физик де Бройль высказал смелую гипотезу о сходстве между светом и частицами вещества: если свет обладает корпускулярными свойствами, то и материальные частицы, в свою очередь, должны обладать волновыми свойствами, т.е с любой частицей вещества связана некоторая волна, точно так же, как с фотоном связана световая волна.
Движению любой частицы, обладающей импульсом 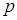 , сопоставляется волновой процесс с длиной волны:
, сопоставляется волновой процесс с длиной волны:
|
|
|
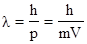
Это выражение называется длиной волны де Бройля для материальной частицы.
Существование волн де Бройля может быть установлено лишь на основе опытов, в которых проявляется волновая природа частиц. Так как волновая природа света проявляется в явлениях дифракции и интерференции, то для частиц, обладающих по гипотезе де Бройля волновыми свойствами, должны также обнаруживаться эти явления.
Как известно, при дифракции световых волн дифракционная картина особенно просто получается, когда размеры неоднородностей, на которых происходит дифракция, не слишком велики по сравнению с длиной волны.
Длины волн, связанных с частицами, должны быть очень малы, т.е. значительно меньше длин волн видимого света.
В своих опытах Дэвиссон и Джермер изучали отражение электронов от монокристалла никеля, принадлежащего к кубической системе.
В ходе экспериментов было установлено, что движение каждого электрона можно описать с помощью волны с длиной волны 0,167 нм.
Согласно гипотезе де Бройля, электрон, ускоренный в электрическом поле разностью потенциалов 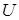 , обладает кинетической энергией
, обладает кинетической энергией 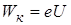 .
.
С другой стороны, модуль импульса 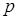 частицы связан с ее кинетической энергией
частицы связан с ее кинетической энергией 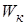 соотношением
соотношением 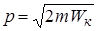 , то выражение для длины волны можно записать в виде:
, то выражение для длины волны можно записать в виде:
|
|
|
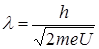
U=54B, m=9,1*10-31 кг, e=1,6*10-19 кг
В итоге из формулы, подставив значения, выходит, что длина волны также равна 0,167 нм.
Оба результата хорошо совпадают, что подтверждает наличие волновых свойств у электронов.
1927 г серия новых опытов: Томсон и Тартаковский: ими были получены дифракционные картины при прохождении электронов через тонкие металлические пленки.

Действие электронов на фотопластинку аналогично действию быстрых фотонов рентгеновского диапазона при прохождения их через фольгу из алюминия.
| |
В 1931г. впервые было получено изображение объекта, сформированное пучками электронов на электронном микроскопе.
Электронные микроскопы по своей разрешающей способности превосходят световые микроскопы в несколько тысяч раз. Предел разрешения, характеризующий способность прибора отобразить раздельно две максимально близко расположенные детали объекта, у электронного микроскопа составляет (0,15-0,3) нм, т.е. достигает уровня, позволяющего наблюдать атомарную и молекулярную структуру исследуемых объектов.
Помимо электронного микроскопа существует и ионный микроскоп, который по принципу действия аналогичен электронному микроскопу, но по сравнению с ним обладает более высокой разрешающей способностью.
Длина волны де Бройля для ионов в 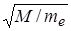 раз меньше, чем для электронов (
раз меньше, чем для электронов ( 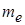 - масса электрона,
- масса электрона, 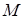 - масса иона) при одинаковом ускоряющем напряжении. Вследствие этого в ионном микроскопе очень малы эффекты искажения, обусловленные дифракцией, которые ограничивают в электронном микроскопе его разрешающую способность. Другим преимуществом ионного микроскопа является его высокая контрастность изображения.
- масса иона) при одинаковом ускоряющем напряжении. Вследствие этого в ионном микроскопе очень малы эффекты искажения, обусловленные дифракцией, которые ограничивают в электронном микроскопе его разрешающую способность. Другим преимуществом ионного микроскопа является его высокая контрастность изображения.
К недостаткам ионного микроскопа относятся:
1. заметная потеря энергии ионов даже при прохождении их через очень тонкие объекты, которые быстро разрушаются;
2. разрушение люминофора экрана ионами;
3. слабое фотографическое действие ионов.
Дата добавления: 2019-07-17; просмотров: 351; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
