Классическая модель атома по Резерфорду. Опыты Резерфорда
В 1911 г Э. Резерфорд решил проверить «Пудинговую» модель Томсона. Цель опыта Резерфорда состояла в том, чтобы экспериме-но проверить основное положение теории атома, предложенные Томсоном. На опыте было обнаружено: большинство α-частиц проходили через тонкий слой металла, не испытывая отклонений, небольшая часть частиц отклонялась на значительные углы, очень редкие α-частицы испытывали отклонения на углы близкие к 180. Эти соображения привели к тому, что атом почти пустой и весь его положит-ый заряд сосредоточен в малом объеме, имеющих размеры порядка приблизительно 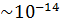 м; электроны движутся вокруг этого малого объема. Это малый объем носит название атомный ядро.
м; электроны движутся вокруг этого малого объема. Это малый объем носит название атомный ядро.
Планетарную модель атома (ядерная модель) предложил Резерфорд. Однако, в отличии от планетарной модели солнечной системы планетарная модель атома оказывается внутри противоречивой с точки зрения клас-кой физики. Непрерывное излучение уменьшает кинетич энергию электрона, следовательно, за счет излучения радиус орбиты, движущегося электрона должен уменьшаться, пока электрон не упадет на ядро. Это произойдет за время 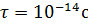 . Спектр испускания такого атома должен быть сплошным, что противоречит экспериментальным данным.
. Спектр испускания такого атома должен быть сплошным, что противоречит экспериментальным данным.
Постулаты Бора и объяснение происхождения линейчатых спектров. Атом водорода по Бору.
Опытные данные об атоме водорода. Естественно начинать изучение структуры атомов с самого простого атома – атома водорода. Ко времени создания теории Бора об атоме водорода имелись следующие экспериментальные сведения. Атом водорода состоит из ядра (протона), несущего положительный заряд, равный по величине заряду электрона, и одного электрона, который согласно планетарной модели Резерфорда, движется вокруг ядра по круговой или эллиптической орбите. Размеры атома водорода определяются диаметром орбиты электрона и составляют несколько больше 10-10 м.
|
|
|
Наиболее важные для создания теории атомов сведения были получены из спектра излучения водорода. Спектр водорода оказался наиболее простым по сравнению со спектрами других элементов. В нем были обнаружены удивительно простые и в то же время выполняющиеся с очень большой точностью закономерности в расположении спектральных линий, так называемые спектральные серии (спектральные серии были найдены также и в спектрах других элементов, но формулы для их описания оказались более сложными, а совпадение этих формул с опытом значительно менее точным). Оказалось, что частоты всех линий, которые наблюдаются в спектре излучения водорода, определяются формулой:
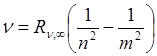 . (19.2)
. (19.2)
|
|
|
Это обобщенная формула Бальмера. Здесь ν – частота световой волны, 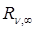 – постоянная Ридберга (
– постоянная Ридберга ( 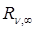 =3,293 · 1015 c-1, n=1,2,3 …, m=2, 3, 4 …) .
=3,293 · 1015 c-1, n=1,2,3 …, m=2, 3, 4 …) .
Постулаты Бора:
1. Первый постулат Бора (постулат стационарных состояний) гласит: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определенным квантовым условиям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света).
2. Второй постулат Бора (правило частот)формулируется следующим образом: излучение испускается или поглощается в виде светового кванта энергии 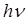 при переходе электрона из одного стационарного (устойчивого) состояния в другое (рис. 19.4). Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый переход электрона:
при переходе электрона из одного стационарного (устойчивого) состояния в другое (рис. 19.4). Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается квантовый переход электрона:
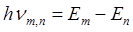
Отсюда следует, что изменение энергии атома, связанное с излучением при поглощении фотона, пропорционально частоте ν:

Рис. 19.4
поглощении фотона, пропорционально частоте ν:
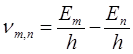 , (19.4)
, (19.4)
|
|
|
т.е. частота излучаемого света может быть представлена в виде разности двух величин, характеризующих энергию излучающей системы.
Важную роль в развитии планетарной модели сыграли эмпирические закономерности, полученные для линейчатого спектра атома водорода.
В 1858 г. швейцарский физик И. Бальмер установил, что
1. частоты девяти линий в видимой области спектра водорода удовлетворяют соотношению
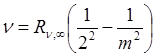 , m=3, 4, 5
, m=3, 4, 5
По мере увеличения m частота 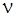 линий спектра возрастает, при этом интервалы между соседними частотами уменьшаются, так что при
линий спектра возрастает, при этом интервалы между соседними частотами уменьшаются, так что при 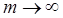 частота
частота 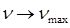 . Максимальное значение частоты в серии Бальмера, полученное при
. Максимальное значение частоты в серии Бальмера, полученное при 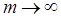 , называется границейсерии Бальмера, за пределами которой находится непрерывный спектр.
, называется границейсерии Бальмера, за пределами которой находится непрерывный спектр.
В ультрафиолетовой области спектра водорода находится серия Лаймана:
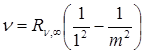 , m = 2,3,4… (19.6)
, m = 2,3,4… (19.6)
В инфракрасной области расположены еще четыре серии:
Серия Пашена, 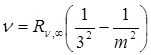 , m = 4,5,6…
, m = 4,5,6…
Серия Брэкета 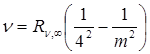 , m = 5,6,7… (19.7)
, m = 5,6,7… (19.7)
Серия Пфунда 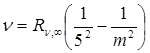 , m = 6,7,8…
, m = 6,7,8…
Серия Хэмфри  , m = 7,8,9…
, m = 7,8,9…
Бором было введено правило квантования орбит, которое гласит: в стационарном состоянии атома электрон, двигаясь по круговой орбите радиуса r, должен иметь дискретные, т.е. квантованные, значения момента импульса, удовлетворяющие условию: 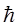
|
|
|
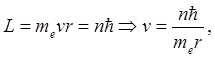 n = 1, 2, 3…, (19.8)
n = 1, 2, 3…, (19.8)
где n – главное квантовое число, 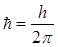 – также постоянная Планка.
– также постоянная Планка.
Атом водрода по Бору
Экспериментальная частица хар-тся массой, зарядом, величиной собственного момента импльса (спин) и величиной магнитного момента. Существование собственного мах-кого и магнит-ного момента у электрона позволяет представить его условие в виде заряженного волчка вращаю-щегося вокруг собственной в отличии от классич-кого «волчка», который может иметь любое значение мех-кого момента спин электрона имеет только одно определенное значение, равное половине постоянной Планка 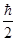 , тогда собственный магнт-ный момент электрона также имеет тоько одно определенное значение
, тогда собственный магнт-ный момент электрона также имеет тоько одно определенное значение 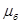

Магнетон Бора
Отрицат знак магнит момента электрона обусловлен тем, что его направление противоположно направлению спин.
15. Спектральные закономерности линейчатых спектров атома водорода. Спектральные серии
Важную роль в развитии планетарной модели сыграли эмпирические закономерности, полученные для линейчатого спектра атома водорода.
Частоты 9-ти линий в видимой обл спектра удовлетворяют соотношению:
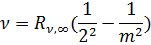
m = 3,4,5,6,7,8,9,10,11
По мере увеличения m частота линий спектра возрастает так, что  следовательно
следовательно 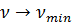 – граница серии Больмера.
– граница серии Больмера.
В ультрафиолетовой обл спектра находится серия Лаймона и частоту этих линий описываем:
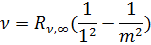
m = 2,3,4...
В инфракрасной обл расположены ещё 4 серии:
Серия Пошена: 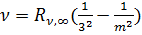 , m = 4,5..
, m = 4,5..
Серия Брэкета: 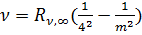 , m = 5,6..
, m = 5,6..
Серия Пфунда: 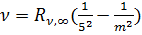 , m = 6,7..
, m = 6,7..
Серия Хэмфри:  , m = 6,7..
, m = 6,7.. 
Бором было введено правило квантования орбит: в стационарном состоянии атома электрон двигаясь по круговой орбите определённого радиуса должен иметь дискретные, т.е. квантованные значения момента импульса удовлетворяющего условию:
 , n = 1,2,3...
, n = 1,2,3...
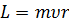
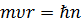

Дата добавления: 2019-07-17; просмотров: 195; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
