Методы иммобилизации ферментов
Существует два основных метода иммобилизации ферментов: физический и химический.
Физическая иммобилизация ферментов представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов:
- адсорбция на нерастворимых носителях;
- включение в поры геля;
- пространственное отделение фермента от остального объема реакционной системы с помощью полупроницаемой перегородки (мембраны);
- включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз.
Главным отличительным признаком химических методов иммобилизации является то, что путем химического взаимодействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности между белком и носителем. Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. При широком варьировании таких условий, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность.
|
|
|
Механизм действия ферментов
Акт катализа складывается из трех последовательных этапов.
1. Образование фермент-субстратного комплекса при взаимодействии через активный центр.
2. Связывание субстрата происходит в нескольких точках активного центра, что приводит к изменению структуры субстрата, его деформации за счет изменения энергии связей в молекуле. Это вторая стадия и называется она активацией субстрата. При этом происходит определенная химическая модификация субстрата и превращение его в новый продукт или продукты.
3. В результате такого превращения новое вещество (продукт) утрачивает способность удерживаться в активном центре фермента и фермент-субстратный, вернее уже фермент-продуктный комплекс диссоциирует (распадается).
Виды каталитических реакций:
А+Е = АЕ = БЕ = Е + Б
А+Б +Е = АЕ+Б = АБЕ = АБ + Е
АБ+Е = АБЕ = А+Б+Е, где Е - энзим, А и Б - субстраты, либо продукты реакции.
|
|
|
Ферментативные эффекторы - вещества, изменяющие скорость ферментативного катализа и регулирующие за счет этого метаболизм. Среди них различают ингибиторы - замедляющие скорость реакции и активаторы - ускоряющие ферментативную реакцию.
В зависимости от механизма торможения реакции различают конкурентные и неконкурентные ингибиторы. Строение молекулы конкурентного ингибитора сходно со структурой субстрата и совпадает с поверхностью активного центра как ключ с замком (или почти совпадает). Степень этого сходства может даже быть выше чем с субстратом.
Если А+Е = АЕ = БЕ = Е + Б , то И+Е = ИЕ ¹
Концентрация способного к катализу фермента при этом снижается и скорость образование продуктов реакции резко падает
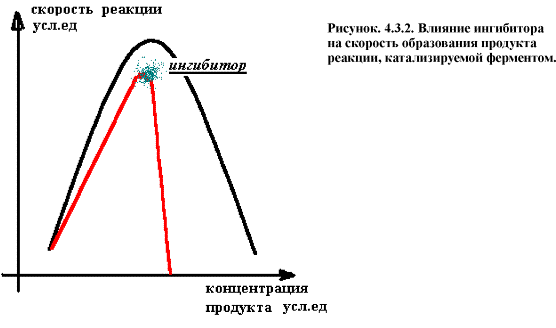
В качестве конкурентных ингибиторов выступает большое число химических веществ эндогенного и экзогенного происхождения (т.е. образующихся в организме и поступающих извне – ксенобиотики, соответственно). Эндогенные вещества являются регуляторами метаболизма и называются антиметаболитами. Многие из них используют при лечении онкологических и микробных заболеваний, т.к. они ингибируют ключевые метаболические реакции микроорганизмов (сульфаниламиды) и опухолевых клеток. Но при избытке субстрата и малой концентрации конкурентного ингибитора его действие отменяется.
|
|
|
Второй вид ингибиторов - неконкурентные. Они взаимодействую с ферментом вне активного центра и избыток субстрата не влияет на их ингибирующую способность, как в случае с конкурентными ингибиторами. Эти ингибиторы взаимодействуют или с определенными группами фермента (тяжелые металлы связываются с тиоловыми группами Цис) или чаще всего регуляторным центром, что снижает связывающую способность активного центра. Собственно процесс ингибирования - это полное или частичное подавление активности фермента при сохранении его первичной и пространственной структуры.
Различают также обратимое и необратимое ингибирование. Необратимые ингибиторы инактивируют фермент, образуя с его АК или другими компонентами структуры химическую связь. Обычно это ковалентная связь с одним из участков активного центра. Такой комплекс практически недиссоциирует в физиологических условиях. В другом случае ингибитор нарушает конформационную структуру молекулы фермента - вызывает его денатурацию.
|
|
|
Действие обратимых ингибиторов может быть снято при переизбытке субстрата или под действием веществ, изменяющих химическую структуру ингибитора. Конкурентные и неконкурентные ингибиторы относятся в большинстве случаев к обратимым.
3. Амилаза (другие названия – альфа-амилаза, диастаза, панкреатическая амилаза) это биологически активное вещество, участвующее в процессе метаболизма углеводов. В организме человека большая ее часть вырабатывается поджелудочной железой, меньшая – слюнными железами.
Различают два основных типа (изофермента) амилазы: панкреатическую амилазу (вырабатывается в поджелудочной железе) и амилазу слюны.
Альфа-амилаза слюнных желез (птиалин) и панкреатическая амилаза, выделяемая поджелудочной железой в просвет двенадцатиперстной кишки, поэтапно осуществляют расщепление высокомолекулярных углеводов до простых сахаров.
Амилаза желудка имеет второстепенное значение по отношению к амилазам слюнных желез и поджелудочной железы.
Значительно более низкой амилазной активностью обладают также такие органы как яичники, фаллопиевы трубы, тонкий и толстый кишечник, печень.
У человека α-амилаза является основным пищеварительным ферментом.
Амилаза обеспечивает переваривание углеводов пищи, расщепляя их и преобразуя в глюкозу. Благодаря этому же ферменту глюкоза усваивается организмом.
Амилаза слюнных желез начинает этот процесс и может фактически совершить переваривание значительной части крахмала до поступления его в тонкую кишку и контакта с панкреатической амилазой.
Основное переваривание углеводов происходит в тонком кишечнике, где для этого имеются все необходимые условия: слабощелочная среда и ферменты, катализирующие распад гликозидных связей в углеводах.
Активность α-амилазы оптимальна при нейтральной pH = 6,7-7,0. Активность амилазы подавляется кислой средой, создаваемой желудочным соком.
Большая часть панкреатической амилазы расщепляется в нижней части кишечного тракта трипсином, небольшое количество попадает в кровь.
Из организма амилазу выводят почки вместе с мочой.
Признаком дефицита амилазы в ЖКТ может быть ее повышен-ное содержание в крови при:
- остром или хроническом панкреатите;
- кисте поджелудочной железы;
- камне, опухоли в протоке поджелудочной железы;
- раке поджелудочной железы;
- эпидемическом паротите;
- остром перитоните;
- сахарном диабете;
- заболеваниях желчных путей (холецистит);
- почечной недостаточности;
- непроходимости кишечника;
Признаком дефицита амилазы в ЖКТ может также быть ее пониженное содержание в крови при
- недостаточности поджелудочной железы;
- некрозе клеток поджелудочной железы;
- муковисцидозе;
- поражениях печени
Альфа- амилаза является кальций-зависимым ферментом, так как ее деятельность активируется ионом кальция.
Определение уровня амилазы в крови и моче применяется при диагностике заболеваний поджелудочной железы, слюнных желез, причин боли в животе.
Билет 11
1. Структурная организация ферментов. Понятие об активном, аллостерическом центрах. Функциональные группы ферментов.
Ферменты как белковые молекулы имеют 4 уровня организации: первичный, вторичный, третичиный, четвертичный. Ферменты с четвертичной структурой состоят из протомеров (субъединиц) – таких фементов большинство. Ферменты могут быть как простыми, так и сложными белками. Сложные ферменты состоят из белковой части - апофермента и небелковой – кофактора. Апоферменты и кофакторы порознь мало активны или вообще неактивны; объединение их вместе дает активную молекулу фермента. Функции и свойства апофермента и кофактора следующие. Апофермент термолабилен, определяет специфичность фермента, участвует в соединении фермента с субстратом, активирует кофактор. Кофактор термостабилен, стабилизирует апофермент, участвует в катализе.
Классификация коферментов
Коферменты представлены веществами органичской природы-нуклеопротеидами,витаминами и др. Их подразделяют следующим образом:
Исходными веществами для образования коферментов первой групы являются витамины, поэтому недостаточное поступление их с пищей сразу сказывается на синтезе этих коферментов, а как следствие нарушается и функция соответствующих сложных ферментов. Коферменты второй группы образуются из промежуточных продуктов обмена, поэтому недостатка в этих коферментах в физиологических условиях не бывает, и функция ферментов, с которыми они связаны, не нарушаются.
Активный и аллостерические центры
В структуре фермента выделяют ряд участков, несущих определенные функции:
1. Активный центр – место в пространственной структуре фермента, с которым связываются субстрат (вещество которое превращается под действием фермента); в состав активного центра фермента входят кофакторы; число активных центров в олигомарных ферментах может быть равно числу субъединиц – по одному центру на субъединицу; в активном центре различают контактный, или якорный участов, связывающий субстрат, и каталитический участок, где происходит превращение субстрата после его связывания; обычно активный центра фермента образует 12-16 аминокислотных остатков, они могут находиться в разных
местах полипептидной цепи, нередко на противоположных концах – при пространственной раскладке они сближаются и образуют активный центр; в катализе наиболее часто принимают участие функциональные группы ферментов:
· Индольные триптофана
· Имидазольные гистидина
· ОН – группы серина и трионина
· SH – группы цистидина и дисульфидные цистина
· Тиоэфирные группы метионина
· Фенольные группы тирозина
· Годрофобные цепи алифатических аминокислот и ароматиеское коньцо фенилаланина
· Гуанадиновые группы аргинина
· NH2 – группы лизина и концевые NH2 – группы полипептидной цепи
2. Кроме активного у ферментов имеется аллостерический центр, расположенный вне активного центра, но функционально связанный с ним. Молекулы, взаимодействующие с этим центром, структурно не похожи на субстрат, но влияют на связывание и превращение субстрата в активном центре, изменяя его конфигурацию; такие вещества называют аллостерическими эффекторами, через аллостерический центр они влияют на функцию активного центра: или вызывают положительный эффект(активаторы), или отрицательный(ингибиторы). Молекула фермента может иметь несколько аллостерических центров.
2. Принцип регуляции метаболических процессов: пространственная организация, роль количества молекул фермента, доступность субстрата и коферментов.
Живая клетка - открытая система, постоянно обменивающаяся с внешней средой веществами и энергией: в неё поступают питательные вещества, которые подвергаются превращениям и используются в качестве строительного и энергетического материала, из клетки выводятся конечные продукты метаболизма.
В многоклеточном организме клетка реагирует не только на изменение окружающей среды, но и на функциональную активность соседних клеток. При этом она стремится сохранить неизменным свой внутренний состав. Это состояние называют стационарным или клеточным гомеостазом.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма.
Среди всех метаболических путей, протекающих в организме, выделяют противоположно направленные процессы: катаболизм и анаболизм. Катаболизм - распад сложных веществ до простых с высвобождением энергии. Анаболизм
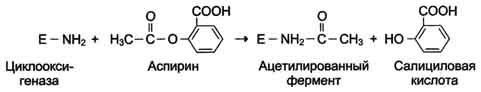
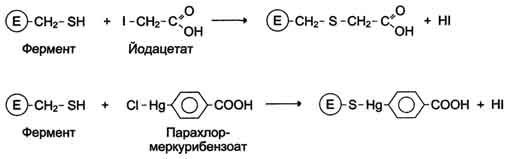
Рис. 2-28. Ингибирование активности ферментов вследствие ковалентной модификации остатков цистеина.
Анаболизм - синтез из простых более сложных веществ. Метаболические пути согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность протекания всех процессов обеспечивается сложными и многообразными механизмами регуляции.
Дата добавления: 2019-07-17; просмотров: 1063; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
