ВР 1.Подготовка помещений, оборудования, персонала, воздуха (Кт, Кх, Кмк)
ВР 1.1 Подготовка помещений
ВР 1.2 Подготовка оборудования
ВР 1.3 Подготовка персонала
ВР 1.4 Подготовка воздуха
ВР 2 Подготовка ФС и ВВ (КтКхКмб)
ВР 2.1 отвешивание ФС и ВВ
ВР 2.2 Мойка и сушка контейнеров
ТП 1 Измельчение (Кт)
ТП 2 Просеивание (Кт)
ТП 3 Смешивание ингредиентов (КтКх)
ТП 4 Стандартизация (КтКхКмб)
УМО 1 Упаковка, маркировка, отгрузка на склад (КтКхКмб)
УМО 1.1 Упаковка в первичный конт
УМО 1.2 Упаковка во вторичн конт
УМО 1.3 Упаковка в груп конт
УМО 1.4 Отгрузка на склад
Фасовка порошков Фасовка порошков обычно осуществляется по заданному объему, соответствующему определенной массе порошка дозаторами различной конструкции.
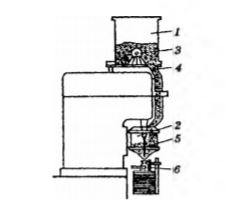
Рис. 3.1. Схема шнекового дозатора. 1 - бункер, 2 - загрузочная воронка, 3 направляющая мешалка, 4 - дроссельный клапан, 5 - дозирующий шнек, 6 - флакон. Шнековый дозатор (рис 3.1) работает следующим образом. Порошок из бункера 1 с помощью регулятора подается направляющей мешалкой 3 через дроссельный клапан 4 в загрузочную воронку 2, в которой поддерживается уровень порошка. Дозирование осуществляется поворотом дозирующего шнека 5 во флакон 6.
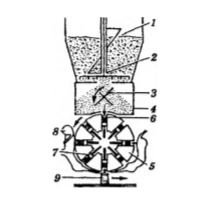
Рис. 3.2. Схема камерного вакуумного дозатора. 1. - загрузочная воронка, 2, 3 - мешалки, 4 - наполнительная ка мера, 5 - ротор, 6 - дозировочное отверстие, 7 - дозирующие поршни, 8 - ракель, 9 - флакон. Камерный вакуумный дозатор (рис. 3.2) работает следующим об разом. Фасуемый порошок подается в загрузочную воронку 1. Мешалки 2 и 3 обеспечивают равномерное распределение порошка в наполнительной камере 4. В роторе 5, замыкающем низ наполнительной камеры, расположены восемь дозировочных отверстий 6. Из центра ротора в эти отверстия установлены на резьбе дозирующие поршни 7, определяющие объем наполнения. Ротор периодически, после каждого цикла, поворачивается на одну восьмую часть его объема, дозировочные отверстия устанавливаются под наполнительной камерой, при этом порошок всасывается в находящиеся под вакуумом отверстия. После двух циклов наружная поверхность наполнительного колеса очищается ракелем 8, а избыток порошка отсасывается. Дальнейшие два цикла переводят ротор в положение совмещения с отверстием горловины подготовленного флакона 9. Порошок всасывается во флакон под воздействием короткого импульса сжатого воздуха.
|
|
|
Сроки и условия хранения порошков. Испытания для порошков: однородность содержания, однородность дозированных единиц, однородность массы, однородность массы дозы в многодозовых контейнерах и др.
Сроки и условия хранения порошков. Хранение порошков в сухом и прохладном месте. Срок хранения указывается в ФСП.
|
|
|
Испытания (ГФ РБ)
Порошки для внутреннего применения:
· Однородность дозированных единиц;
· Однородность содержания (с содержанием ДВ менее 2 мг или менее 2% от общей массы содержимого);
· Однородность массы (в однодозовых контейнерах)
· Однородность массы одной дозы, высвобождаемой из многодозового контейнера.
Порошки для наружного применения:
· Степень измельчения
· Однородность дозированных единиц (однодозовые порошки)
· Однородность содержания (с содержанием ДВ менее 2 мг или менее 2% от общей массы содержимого);
· Однородность массы (в однодозовых контейнерах)
· Стерильность (ЛС стерильно)
Однородность массы для единицы дозированного ЛС
20 единиц дозированного лекарственного средства или содержимое каждого из 20 контейнеров, в случае однодозовых лекарственных средств в индивидуальных контейнерах, отбирают по статистически обоснованной схеме. Взвешивают каждую в отдельности и рассчитывают среднюю массу. Лекарственное средство считают выдержавшим испытание, если не более двух индивидуальных масс отклоняются от средней массы на величину, превышающую значение, указанное в Таблице 2.9.5.-1. При этом ни одна индивидуальная масса не должна отклоняться от средней массы на величину в два раза превышающую значение, указанное в Таблице 2.9.5.-1.
|
|
|
·Капсулы, гранулы (без покрытия, однодозовые) и порошки (однодозовые) менее 300 мг – 10%, 300 мг и более – 7,5 %
·Порошки для приготовления лекарственных средств для парентерального применения* (однодозовые)
Более 40 мг – 10 %
2.9.6. ОДНОРОДНОСТЬ СОДЕРЖАНИЯ ДЕЙСТВУЮЩЕГО ВЕЩЕСТВА В ЕДИНИЦЕ ДОЗИРОВАННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА
Испытание на однородность содержания действующего вещества в единице дозированного лекарственного средства основывается на количественном определении содержания в индивидуальных однодозовых единицах лекарственного средства с целью выяснения, находится ли это содержание внутри пределов, установленных по отношению к среднему содержанию в испытуемом образце.
Данное испытание не проводится для поливитаминных лекарственных средств и для лекарственных средств, содержащих микроэлементы, если нет других указаний в частных статьях.
Метод. Используя аналитическую методику, указанную в частной статье, определяют содержание действующего вещества в каждой из 10 дозированных единиц лекарственного средства, отобранных по статистически обоснованной схеме.
Применяют критерии тестов А,В или С как указано в статье для испытуемой дозированной формы.
ТЕСТ А
Таблетки, порошки для приготовления лекарственных средств для парентерального применения, глазные вставки, суспензии для инъекций. Лекарственное средство выдерживает испытание, если содержание в каждой его однодозовой единице находится в пределах 85 – 115 % от среднего содержания. Лекарственное средство не выдерживает испытание, если содержание более чем в одной единице выходит за вышеуказанные пределы или если содержание хотя бы в одной единице выходит за пределы 75 – 125 % от среднего содержания.
Если содержание в одной единице лекарственного средства выходит за пределы 85 -115 %, но находится в пределах 75 – 125 %, определяют содержание в каждой из 20 дополнительных однодозовых единиц лекарственного средства, отобранных по статистически обоснованной схеме. Лекарственное средство выдерживает испытание, если содержание не более чем в одной из проанализированных 30 единиц выходит за пределы 85 – 115 % и ни в одной единице не выходит за пределы 75 -125 % от среднего содержания.
ТЕСТ В
Капсулы, порошки для приготовления лекарственных средств не для парентерального применения, гранулы, суппозитории, пессарии. Лекарственное средство выдерживает испытание, если содержание не более чем в одной единице выходит за пределы 85 – 115 % и ни в одной единице не выходит за пределы 75 – 125 % от среднего содержания в лекарственном средстве. Лекарственное средство не выдерживает испытание, если содержание более чем в трех единицах выходит за пределы 85 – 115 % от среднего содержания или если хотя бы в одной единице выходит за пределы 75 – 125 % от среднего содержания. Если содержание в двух или трех единицах лекарственного средства выходит за пределы 85 -115 %, но находится в пределах 75 – 125 %, определяют содержание в каждой из 20 дополнительных однодозовых единиц лекарственного средства, отобранных по статистически обоснованной схеме. Лекарственное средство выдерживает испытание, если содержание не более чем в трех из проанализированных 30 единиц выходит за пределы 85 – 115 % и ни в одной единице не выходит за пределы 75 -125 % от среднего содержания.
|
|
|
2.9.27. ОДНОРОДНОСТЬ МАССЫ ОДНОЙ ДОЗЫ ВЫСВОБОЖДЕННОЙ ИЗ МНОГОДОЗОВОГО КОНТЕЙНЕРА
Данное испытание предназначено для оральных лекарственных форм, таких как гранулы, порошки и жидкости для орального применения, выпускаемые в многодозовых контейнерах, снабженных встроенным дозирующим устройством.
Взвешивают индивидуально 20 доз, изъятых из одного или более контейнеров при помощи встроенного дозирующего устройства. Определяют массу каждой индивидуальной дозы и вычисляют среднюю массу. Масса не более двух индивидуальных доз может иметь отклонение более чем 10 % от средней массы и ни одна масса индивидуальной дозы не может иметь отклонение более 20 %.
Степень измельчения
2.9.12. СИТОВОЙ АНАЛИЗ
Степень измельчения порошка может быть выражена размерами отверстий сит в соответствии с Таблицей 2.1.4.-1 (2.1.4).
Степень измельчения порошка определяют просеиванием через сита с определенными номерами и выражают нижеуказанными терминами. Если такие термины не могут быть использованы, степень измельчения выражают в процентах вещества (м/м), проходящего через сито определенного размера.
При описании порошков используют следующую терминологию:
Грубый порошок. Не менее 95% массы порошка проходит через сито номер 1400 и не более 40% массы порошка проходит через сито номер 355.
Средне-мелкий порошок. Не менее 95% массы порошка проходит через сито номер 355 и не более 40% массы порошка проходит через сито номер 180.
Мелкий порошок. Не менее 95% массы порошка проходит через сито номер 180 и не более 40% массы порошка проходит через сито номер 125.
Очень мелкий порошок. Не менее 95% массы порошка проходит через сито номер 125 и не более 40% массы порошка проходит через сито номер 90.
Если указано сито одного номера, не менее 97% массы порошка должно проходить через указанное сито, если нет других указаний в частной статье.
Для определения степени измельчения порошка собирают сита, порошок полностью просеивают и взвешивают каждую фракцию.
# Если нет других указаний в частной статье, грубые, средне-мелкие порошки в количестве 25-100 г помещают на соответствующее сито, встряхивают в течение 10 мин, периодически постукивая по ситу. Для мелких и очень мелких порошков навеска образца не должна превышать 25 г, сито встряхивают в течение 20 мин. Если порошки закупоривают отверстия во время просеивания, допускается осторожно прочищать нижнюю поверхность сита. Навеску порошка, время и условия просеивания указывают в частной статье.
2.9.13. ОПРЕДЕЛЕНИЕ РАЗМЕРА ЧАСТИЦ МЕТОДОМ МИКРОСКОПИИ
Взвешивают необходимое количество испытуемого порошка (например, 10-100 мг) и суспендируют в 10,0 мл указанной в частной статье жидкости, в которой порошок не растворяется, если необходимо прибавляют вещество, улучшающее смачиваемость. Порцию гомогенной суспензии помещают в подходящую счетную ячейку и просматривают под микроскопом площадь, соответствующую не менее 10 мкг испытуемого порошка. Подсчитывают все частицы, имеющие размеры более допустимого предела. Допустимый предел размера и допустимое количество частиц, размер которых превышает предел, указывают в частной статье.
2.9.40. ОДНОРОДНОСТЬ ДОЗИРОВАННЫХ ЕДИНИЦ
Для обеспечения однородности дозированных единиц (ОДЕ) содержание активного вещества в каждой дозированной единице в серии должно находиться в пределах узкого диапазона от номинального содержания, указанного в разделе «Состав». Дозированными единицами называют дозированные формы, содержащие единицу дозы или часть дозы активного вещества в каждой единице дозированного лекарственного средства. Требование ОДЕ не относится к суспензиям, эмульсиям или гелям в однодозовых контейнерах, предназначенных для наружного применения.
Однородность дозированных единиц определяется как степень однородности распределения активного вещества в дозированных единицах. Однако, если в Фармакопее нет других указаний, требования данной статьи распространяются на каждое активное вещество, входящее в состав дозированных единиц лекарственного средства, содержащих одно или несколько активных веществ.
Для определения ОДЕ следует применять один из двух методов (таблица 2.9.40.-1):
– метод прямого определения;
– расчетно-весовой метод.
Метод прямого определения однородности
дозированных единиц основывается на количественном определении индивидуального содержания активного вещества (или активных веществ) в дозированных единицах лекарственного средства с целью выяснения, находится ли это содержание внутри установленных пределов.
Метод прямого определения может применяться во всех случаях.
Расчетно-весовой метод определения применим для следующих дозированных лекарственных форм:
1) растворы в однодозовых контейнерах и мягких капсулах;
2) твердые лекарственные формы (включая порошки, гранулы и стерильные твердые лекар- ственные формы) в однодозовых контейнерах, не содержащие других активных и вспомога- тельных веществ;
3) твердые лекарственные формы (включая стерильные твердые лекарственные формы) в однодозовых контейнерах, содержащие или не содержащие активные и вспомогательные вещества, приготовленные из истинных растворов, лиофилизированных в конечном контейнере, и маркированные с указанием метода приготовления;
4) твердые капсулы, таблетки без оболочки или покрытые пленочной оболочкой, содержащие 25 мг или более активного вещества, составляющего 25% или более массы дозированной единицы или массы содержимого твердой капсулы, за исключением того, что однородность содержания других активных веществ, присутствующих в меньших количествах, контролируется методом прямого определения.
Метод прямого определения ОДЕ является обязательным для всех дозированных форм, для которых неприменим расчетно-весовой метод. И наоборот, для лекарственных средств с пороговым пределом ниже 25 мг / 25% допускается определение ОДЕ при помощи расчетно-весового метода вместо метода прямого определения в том случае, когда относительное стандартное отклонение (RSD) концентраций (м/м или м/об) активного вещества в конечных дозированных единицах не превышает 2 %, что подтверждается результатами валидации процесса производства и фармацевтической разработки лекарственного средства. Концентрация активного вещества в единице дозированного лекарственного средства равняется результату количественного определения активного вещества в единице дозированного средства, деленному на массу индивидуальной дозированной единицы. Расчетная формула RSD приведена в таблице 2.9.40.-2.
МЕТОД ПРЯМОГО ОПРЕДЕЛЕНИЯ
Отбирают не менее 30 единиц лекарственного средства и проводят определение, как указано для данной дозированной формы. Если используются разные методики для количественного определения и испытания однородности содержимого, вводят корректирующий коэффициент, который применяют к конечным результатам.
Твердые дозированные формы. В каждой из 10 отобранных единиц определяют количественное содержание активного вещества, используя подходящий аналитический метод. Рассчитывают приемлемое значение (см. табли- цу 2.9.40.-2).
жидкие дозированные формы. В каждой из 10 отобранных единиц определяют количественное содержание активного вещества, используя подходящий аналитический метод. Количественное определение проводят из хорошо перемешанного материала, взятого из индивидуального контейнера в условиях обычного использования. Результаты выражают на выходную дозу. Рассчитывают принимаемое число (см. таблицу 2.9.40.-2).
Расчет приемлемого значения.
Приемлемое значение (AV) рассчитывают по формуле:
(M-X) +ks
K- константа приемлимости,M- контрольное зачение,S- стандартное отклонение в выборке,X-среднее значение выборки в процентах от номинального значения
РАСЧЕТНО-ВЕСОВОЙ МЕТОД
Количественное определение активного вещества (или активных веществ) проводят на репрезентативном образце серии, используя подходящий аналитический метод. Получают значение А, выраженное в процентах от номинального содержания (см. «Расчет приемлемого значения»). Допускают, что концентрация (масса активного вещества на массу дозированной единицы) одинаковая для всех дозированных единиц. Отбирают не менее 30 дозированных единиц и проводят определение, как указано для каждой дозированной лекарственной формы.
Таблетки без оболочки или таблетки, покрытые пленочной оболочкой. Точно взвешивают каждую из 10 отобранных таблеток. Рассчитывают содержание активного вещества в каждой таблетке в процентах от номинального содержания исходя из индивидуальной массы таблетки и результата количественного определения. Рассчитывают приемлемое значение.
Твердые капсулы. Точно взвешивают каждую из 10 отобранных капсул, тщательно следя за их целостностью. Извлекают подходящим способом содержимое каждой капсулы. Точно взвешивают каждую пустую капсулу и рассчитывают для каждой капсулы чистую массу содержимого путем вычитания массы оболочки из общей массы соответствующей капсулы. Рассчитывают содержание активного вещества в каждой капсуле, исходя из извлеченной из капсулы индивидуальной массы и результата количественного определения. Рассчитывают приемлемое значение.
Мягкие капсулы. Точно взвешивают каждую из 10 отобранных неповрежденных капсул, тщательно следя за их целостностью. Разрезают капсулы при помощи подходящего сухого и чистого режущего инструмента, например, ножниц или скальпеля, и извлекают содержимое из капсулы. Промывают пустую капсулу подходящим растворителем. Дают возможность растворителю испариться при комнатной температуре с поверхности оболочек в течение приблизительно 30 мин, приняв меры по предотвращению поглощения или потери влаги. По отдельности взвешивают каждую оболочку и рассчитывают массу содержимого в каждой капсуле. Рассчитывают содержание активного вещества в каждой капсуле, исходя из извлеченной из капсулы индивидуальной массы и результата количественного определения. Рассчитывают приемлемое значение.
Другие твердые дозированные формы, кроме таблеток и капсул. Определение проводят так же, как и для твердых капсул, обрабатывая каждую единицу, как указано в данном разделе. Рассчитывают приемлемое значение.
жидкие дозированные формы. Точно взвешивают количество жидкости, извлеченной из 10 отобранных индивидуальных контейнеров в условиях обычного использования. Если необходимо, рассчитывают эквивалентный объем после определения плотности. Рассчитывают содержание активного вещества в каждом контейнере исходя из изъятой из контейнера индивидуальной массы и результатов количественного определения. Рассчитывают приемлемое значение.
Расчет приемлемого значения. Рассчитывают приемлемое значение (AV) так, как и для метода прямого определения, заменяя индивидуальное содержание в единицах на рассчитанное содержание, полученное как указано ниже.
х1, х2,..., хn — отдельные значения содержания в испытанных дозированных единицах,
где
xi =wi×A /W
w1, w2,..., wn — отдельные массы испытанных дозированных единиц,
A — содержание активного вещества (процент от указанного на этикетке), полученное с использованием подходящего аналитического метода,
W — среднее значение отдельных масс (w1, w2,..., wn)
Дата добавления: 2019-07-15; просмотров: 494; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
