Классификация и номенклатура ферментов
Классификация и номенклатура ферментов основана на типе реакции, которую они катализируют, так как катализируемая реакция – это тот специфический признак, по которому один фермент отличается от другого. За основу номенклатуры принимается суммарная реакция, выражаемая формальным уравнением, которое в сочетании с названием субстрата служит основой для построения названия отдельных ферментов.
На типе катализируемой реакции основана не только классификация, но и кодовая (цифровая) нумерация ферментов. Окончание -аза должно употребляться только для отдельных ферментов, т. е. индивидуальных белков-катализаторов, поэтому его не следует применять для систем, содержащих более одного фермента. Международная комиссия по ферментам рекомендовала использование двух номенклатур: систематической и тривиальной. Систематическое название фермента более точно указывает на действие фермента и тем самым его идентифицирует. Тривиальные названия ферментов, используемые в повседневной практике, должны быть достаточно краткими. Во многих случаях тривиальные названия – это ранее принятые названия ферментов: каталаза, амилаза, липаза. Протеолитические ферменты согласно тривиальной номенклатуре сохранили названия с окончанием -ин: папаин, пепсин, трипсин и др.
Международная комиссия по ферментам разработала систему присвоения кодовых чисел (шифров) индивидуальным ферментам. Утверждена на V Биохимическом конгрессе в г. Москве в 1961 году. Шифр каждого фермента содержит четыре числа, разделенные точками. Он составляется по следующему принципу:
|
|
|
А. Первое число показывает, к какому классу принадлежит данный фермент. Различают шесть классов ферментов:
1. Оксидоредуктазы – к этому классу принадлежат ферменты, катализирующие окислительно-восстановительные реакции и переносящие электроны или протоны водорода.
2. Трансферазы – ферменты, переносящие ту или иную группу: метильную, гликозидную, аминную, фосфорную – от одного соединения (донора) к другому (акцептору этой группы).
3. Гидролазы – ферменты, катализирующие гидролитическое расщепление свещств.
Рекомендуемое название этих ферментов во многих случаях образуется из названия субстрата с присоединением окончания -аза. Следовательно, если мы встречаемся с ферментом, состоящим из названия субстрата с окончанием -аза, значит, мы имеем дело с гидролитическим ферментом (сахаразой, мальтазой).
4. Лиазы – ферменты, отщепляющие (но не путем гидролиза) от субстрата ту или иную группу с образованием двойных связей или, наоборот, присоединяющие определенные группы по двойным связям.
|
|
|
5. Изомеразы – ферменты, катализирующие геометрические или структурные изменения в пределах одной молекулы, т. е. реакции изомеризации.
6. Лигазы (синтетазы) – ферменты, катализирующие соединение друг с другом двух молекул, сопряженное с гидролизом пирофосфатной связи в молекуле АТР.
Б. Второе число, которое присваивается ферменту по классификации, обозначает подкласс. У оксидоредуктаз оно указывает на природу той группы в молекуле донора, которая подвергается окислению (1 обозначает спиртовую группу –СН–ОН; 2 – альдегидную или кетонную группу и т. д.); у трансфераз – природу транспортируемой группы; у гидролаз – тип гидролизуемой связи; у лиаз – тип связи, подвергающийся разрыву (между отщепляемой группой и остатком молекулы); у изомераз – тип катализируемой реакции изомеризации; у лигаз – тип вновь образуемой связи.
В. Третье число обозначает подподкласс. У оксидоредуктаз оно указывает для каждой группы доноров тип участвующего акцептора (1 обозначает кофермент NAD+ или NADP+; 2 – цитохром; 3 – молекулярный кислород и т. д.); у трансфераз третье число обозначает тип транспортируемой группы; у гидролаз это число уточняет тип гидролизуемой связи, а у лиаз – тип отщепляемой группы; у изомераз оно уточняет характер превращения субстрата, а у лигаз – природу образующего соединения.
|
|
|
Г. Четвертое число обозначает порядковый номер фермента в данном подподклассе.
Шифровая классификация имеет очень важное преимущество – она позволяет исключить необходимость при включении в список вновь открытых ферментов менять номера всех последующих. Новый фермент может быть помещен в конце соответствующего подподкласса без нарушения всей остальной нумерации.
Тема 4 ОКСИДОРЕДУКТАЗЫ
Оксидоредуктазы это ферменты катализирующие окислительно-восстановительные реакции. Известны три типа окисления:
- Перенос водорода;
- Присоединение кислорода;
- Перенос электронов.
Все три типа окисления встречаются в живых элементах и катализируются соответствующими оксидоредуктазами. Наиболее часто встречаются реакции сопровождающиеся переносом водорода, которые катализируются ферментами дегидрогеназами.
Дегидрогеназы
Это ферменты, катализирующие перенос водорода. Общее уравнение реакции дегидрирования
 |
Дегидрогеназы — это двухкомпонентные ферменты, состоящие из простетической группы и специфического белка.
|
|
|
Как было установлено, два удаляемых в ходе реакции атома водорода перемещаются на водородпереносящие коферменты, такие как NAD+, NADP+, FAD, FMN.
Дегидрогеназы бывают: анаэробные и аэробные.
- Анаэробные дегидрогеназы не могут передать отнятый водород непосредственно кислороду воздуха, а передают его промежуточным ферментативным системам, например аэробным дегидрогеназам. Простетической группой анаэробных дегидрогеназ являются NAD+ и NADP+ (никотинамидадениндинуклеотид и никотинамидадениндинуклеотидфосфат)
Функциональной частью обоих коферментов анаэробных дегидрогеназ является никотинамид — амид никотиновой кислоты. Это витамин РР — никотиновая кислота в виде своего амида. В состав данных коферментов входят также азотистое основание аденин, два остатка сахара — рибозы и два (в NAD+) или три (в NADP+) остатка фосфорной кислоты (рис. 9).
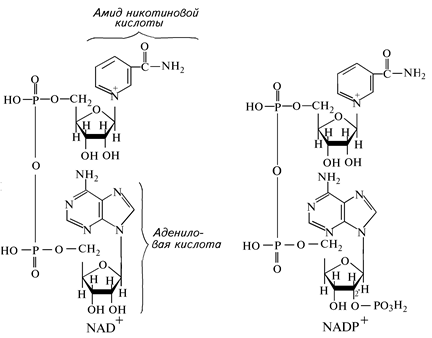
Рис. 9. Строение молекулы NAD+ и NADР+
Эти коферменты могут находиться как в окисленной — NAD+ и NADP+, так и в восстановленной — NADH и NADPH формах.
Механизм действия
Механизм действия этих дегидрогеназ до конца не установлен. Использование меченых 2Н-спиртов и изучение их окисления под действием дегидрогеназ NAD показало, что дегидрогеназы катализируют прямой перенос к NAD+ водорода, который связан с углеродом спиртовой группы. Многие наблюдения позволяют рассматривать процесс биологического окисления, т. е. дегидрирование, как удаление гидрид-иона (Н–) вместе с протоном (Н+), а не удаление двух атомов водорода. Водород, присоединенный к кислороду спирта, высвобождается в реакционную среду в виде протона (Н+).
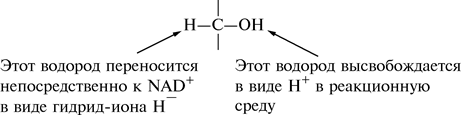
Таким образом, NAD+ и NADP+ можно рассматривать как коферменты, акцептирующие гидрид-ион.
NAD+ и NADP+ представляют собой коферменты большого числа дегидрогеназ. Они принимают участие в переносе электронов в ходе окислительно-восстановительных реакций. Обычно символически реакцию окисления с участием дегидрогеназ обозначают ± 2Н. Это означает, что происходит перенос двух электронов и двух протонов (Н+) в виде гидрид-иона (Н–) и протона (Н+), т. е. необходимо помнить, что при переносе двух атомов водорода речь идет о переносе двух протонов и двух электронов.
В присутствии восстановленного субстрата АН2 — донора электронов и соответствующей дегидрогеназы пиридиновое кольцо кофермента восстанавливается путем связывания в 4-м положении одного протона и двух электронов; второй протон отщепляется в реакционную среду. Поэтому NAD+ и NADP+ являются акцепторами электронов, хотя на самом деле переносится гидрид-ион водорода (Н–). В обратной реакции NADH + H+ и NADPH + H+ выступают в роли донора электронов (рис. 10): действуют в качестве кофермента в реакции ферментативного дегидрирования (на рисунке изображена никотинамидная часть молекулы NAD+ или NADP+, остальная ее часть обозначена буквой R).
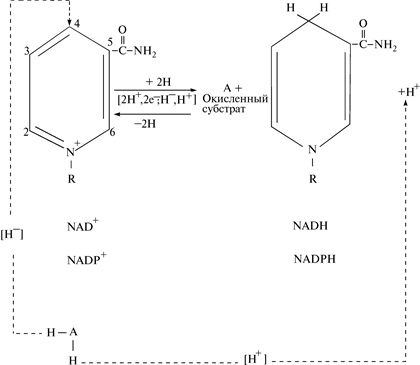
Рис. 10. Прямая и обратная реакция переноса протонов водорода (электронов) в NAD+ или NADP+
Участие пиридинуклеотидов в качестве окислителей или восстановителей в реакциях, катализируемых оксидоредуктазами, показано на рис. 11. Функциональной частью этих соединений является никотинамидное кольцо. Окисленные формы NAD+ и NADP+ несут положительный заряд, который обычно изображают локализованным на атоме азота никотинамидного кольца. Однако в результате резонанса внутри кольцевой системы пиридина можно предположить существование трех структур, различающихся локализацией положительного заряда. Одна из структур несет положительный заряд при атоме углерода С—4 (хотя может и при С—2 и С—1). Анаэробные дегидрогеназы катализирует перенос атома водорода вместе со связанными с ним электронами в виде гидрид-иона (Н–) от молекулы субстрата (АН2) к положительно заряженному атому С—4 NAD+, образуя в результате восстановленную форму кофермента NADH + H+. Электронная пара гидрид-иона водорода (Н–) становится связующей парой вновь образовавшейся ковалентной связи между атомом углерода С—4 и атомом водорода Н. Субстрат, теряющий гидрид-ион от одного из своих атомов, становится положительно заряженным ионом, который стабилизируется, отдавая протон в окружающую водную среду. В обратной реакции оксидоредуктаза катализирует перенос гидрид-иона от С—4 NADPH на протонируемый субстрат.
Таким образом, NADP+ и NADРН различаются наличием или отсутствием одного гидрид-иона, который эквивалентен двум электронам и одному протону (Н+). Именно поэтому анаэробные дегидрогеназы относят к переносчикам водорода и двухэлектронным окислительно-восстановительным ферментам.
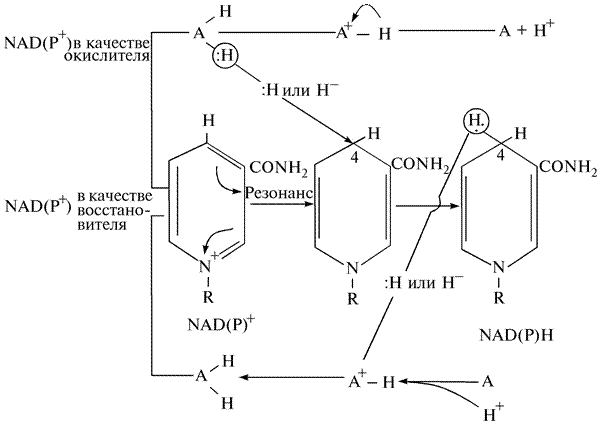
Рис. 11. Участие пиридиннуклеотидов в реакциях переноса протонов водорода (электронов) в качестве коферментов дегидрогеназ
Аэробные дегидрогеназы могут передавать отнятый водород непосредственно кислороду воздуха. Коферментами этих дегидрогеназ являются FMN и FAD (флавинмононуклеотид и флавинадениндинуклеотид).
Аэробные дегидрогеназы или флавиновые ферменты принимают участие в терминальной цепи переноса электронов в организме животных и растениях.
Простетической группой этих ферментов являются флавинмононуклеотид (FMN) и флавинадениндинуклеотид (FAD). В состав FMN входит азотистое основание диметилизоаллоксазин, вместо сахара рибозы — спирт рибит и фосфорная кислота. В состав FAD входит FMN, соединенный с другим нуклеотидом, содержащим азотистое основание — аденин, сахар—рибозу и фосфорную кислоту. Простетическая группа флавопротеинов содержит рибофлавин — это диметилизоалаксазин соединенный со спиртом рибитом (витамин В2)(рис. 12).
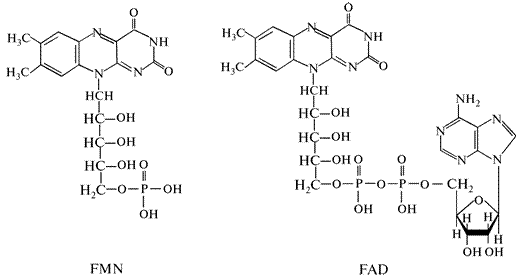
Рис. 12. Строение молекулы FMN и FAD
Коферментом флавопротеинов в большинстве случаев служит FAD, реже — FMN. Эти коферменты функционируют в качестве прочно связанных с белками—ферментами простетических групп. Это их отличает от NAD+ и NADP+, которые могут существовать в клетке в свободном виде, диффундируя от одного белка-фермента к другому. В катализируемых флавопротеинами реакциях изоаллоксазиновое кольцо служит промежуточным переносчиком водорода, отщепляемого в ходе окислительно-восстановительной реакции.
Термин «флавинадениндинуклеотид» (FAD) не совсем правомерен, так как D-рибитальная группа не образует с рибофлавином гликозидной связи и, следовательно, данная молекула не является динуклеотидом. Флавинмононуклеотид (FMN) также не является нуклеотидом, но оба эти термина прочно вошли в биохимическую терминологию.
Реакции гидрирования и дегидрирования с участием флавиновых дегидрогеназ, исходя из концепции переноса гидрид-иона Н–, можно представить в следующем виде (рис. 13).
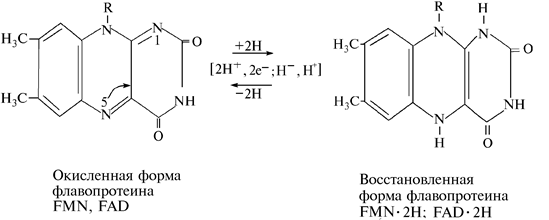
Рис. 13. Прямая и обратная реакции переноса протонов водорода
(электронов) в FAD
В этой реакции гидрид-ион Н– присоединяется в 5-е положение, а протон Н+ — в первое.
В структуры некоторых флавиновых ферментов встроены ионы металлов. Это металлофлавиновые ферменты. Окисленные формы флавиновых ферментов связывают ионы металлов трудно, но все же они образуют окрашенные в красный цвет комплексы с Ag+ и Cu+.
Железосерные белки-ферменты
Железосерные белки — это белки, в структуре которых имеется решетка, состоящая из взаимосвязанных атомов серы и железа, которую называют Fe-S-кластером.
Атомы железа, входящие в состав кластера, не связаны с гемом. Атомы серы бывают двух видов: неорганическая сера и сера цистеина. Атомы неорганической серы легко удаляются из Fe-S-кластера, их называют лабильной серой. Некоторые железосерные белки содержат более чем один Fe-S-кластер. Каждый Fe-S-кластер может принимать или отдавать лишь один электрон. При этом один из атомов железа меняет свою валентность: Fe3+ ® Fe2+ или наоборот. Поэтому железосерные белки-ферменты относятся к одноэлектронным окислительно-восстановительным системам. Они не могут принимать или отдавать водород, поэтому их называют переносчиками электронов.
К железосерным ферментам относится ферредоксин хлоропластов, осуществляющий перенос электронов от возбужденного светом хлорофилла на разнообразные акцепторы электронов. В реакциях переноса электронов в митохондриях участвуют другие железосерные ферменты.
Убихиноны
Термин «убихинон» (вездесущий хинон) используется для обозначения семейства соединений, имеющих одно и то же хиноидное ядро, но разное число изопреноидных остатков в составе боковой липофильной (гидрофобной) цепи (рис. 14). Убихинон (УХ), или кофермент Q (CoQ), функционирует в цепи переноса электронов аэробного дыхания. Убихинон восстанавливается до УХ · 2Н, присоединяя эквивалент двух электронов и двух протонов, следовательно, убихинон — двухэлектронное окислительно-восстановительное соединение и переносчик водорода. Длинная изопреноидная боковая цепь служит как бы якорем, удерживающим соединение в липидной части митохондриальных мембран, где эти соединения функционируют.
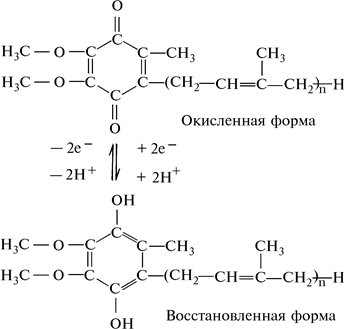
Рис. 14. Окисленная и восстановленная формы убихинонов
Цитохромы
Относятся к классу железосодержащих белков, называемых гемопротеинами. Гем представляет собой тетрапиррольный хелат железа. В этой структуре четыре пиррольных ядра, имеющих заместителей на периферии, объединены в порфириновое кольцо (рис. 15).
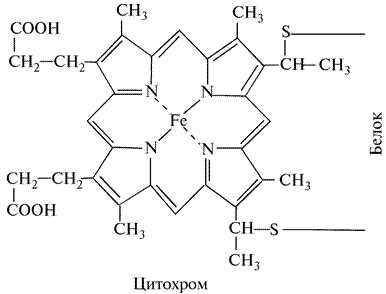
Рис. 15. Схема строения молекулы цитохрома
В центре порфиринового кольца цитохромов находится ион Fe2+. Комплексы с Fe2+ называют гемами. Эти соединения называют также феррогемами, а с Fe3+ — соединения, образующиеся путем окисления Fe2+ ферригемами.
Гемопротеин — это белок, содержащий в качестве простетической группы гем. Цитохромы — это гемопротеины, характерной особенностью которых является перенос электронов, сопряженный с обратным изменением степени окисления простетической группы. Это изменение окислительно-восстановительного состояния включает обратимое равновесие между Fe2+ и Fe3+ состояниями гема:
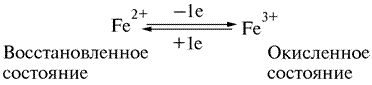
Цитохромы относятся к одноэлектронным окислительно-восстановительным соединениям. Они не могут принимать или отдавать водород, поэтому их называют переносчиками электронов. Цитохромы присутствуют во многих тканях животного, растительного и бактериального происхождения. Цитохромы подразделяются на цитохромы a, b, c и d в соответствии с положением их спектральных полос поглощения в восстановленном состоянии.
Цитохромы а и а3 существуют и функционируют в виде единого прочного комплекса. Особенностью комплекса цитохрома а · а3 является наличие в нем меди, связанной с компонентом а3, необходимой для его функционирования. Перенос электронов комплексом а · а3 включает следующие реакции:
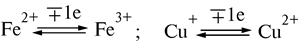
Цитохром а · а3 непосредственно реагирует с молекулярным кислородом воздуха, т. е. электроны передаются на кислород, переводя его в ионы (О-2). Далее ионы кислорода вступают во взаимодействие с протонами, образуя воду. Комплекс а · а3 часто называют цитохромоксидазой.
Дыхательная цепь
Цепь переноса электронов — совокупность окислительно-восстановительных реакций, которые происходят в дыхательной цепи и сопровождаются выделением большого количества энергии.
В высших организмах промежуточными переносчиками электронов в дыхательной цепи являются NAD+, FAD, FMN, кофермент Q (убихинон), цитохромная система и ферменты, содержащие негеминовое железо — железосерные белки. Последовательность проходящих реакций можно представить в следующем виде (железосерные белки не указаны в этой схеме):
|
|
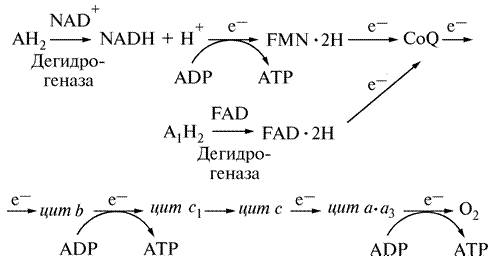
Процесс окисления субстрата АН2 в длинной дыхательной цепи (I) начинается с переноса электронов (е–) от восстановленного субстрата АН2 к NAD+. Следующим переносчиком будет FMN. От флавина электроны переходят к СоQ (убихинону), а затем в определенной последовательности переносятся по цепи цитохромов и наконец через цитохромоксидазу (комплекс цитохромов а · а3) достигают кислорода воздуха. Существует также короткая дыхательная цепь (II), когда субстрат А1Н2 взаимодействует с FAD-зависимой дегидрогеназой, которая восстанавливается до FAD · 2H, и далее электроны идут на СоQ. Дальнейший путь электронов и протонов совпадает с полным дыхательным циклом.
Смысл многоступенчатости цепной передачи электронов и протонов заключается в том, что существует связь между переходом NAD+ в NADH + Н+ и биоэнергетикой клетки. Процесс транспорта электронов — основной источник энергии, необходимой для синтеза внутриклеточной АТР. Это основной способ, посредством которого клетка превращает химическую энергию питательных веществ в метаболическую. По мере продвижения электронов по дыхательной цепи свободная энергия электронов выделяется небольшими порциями, за счет чего в клетке образуется АТР. Такой способ синтеза АТР называется окислительным фосфорилированием.
В длинной дыхательной цепи в трех пунктах происходит сопряжение переноса электронов (окисления) и фосфорилирования. Первым этапом является перенос электронов от восстановленной анаэробной дегидрогеназы NADH + Н+ к флавиновой дегидрогеназе — FMN. Резкий скачок падения энергии приводит к образованию молекулы АТР. Второй точкой сопряжения является переход электронов от цитохрома b на цитохром с1. Третья молекула АТР выделяется, когда цитохромоксидаза (комплекс цитохромов а · а3) передает электроны кислороду воздуха. В короткой дыхательной цепи выделяется две молекулы АТФ.
Глюкозооксидаза
Систематическое название фермента b-D-глюкоза: О2-оксидоредуктаза. Это двухкомпонентный фермент, содержащий в качестве простетической группы две молекулы флавинадениндинуклеотида (FAD), т. е. это флавопротеин.
Этот фермент катализирует дегидрирование глюкозы и перенос отнятого водорода на кислород воздуха с образованием перекиси водорода. При этом глюкоза превращается в глюконолактон:
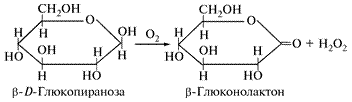
Глюкозооксидаза синтезируется плесневыми грибами при рН 5…7. Особенно активными продуцентами являются некоторые штаммы Aspergillus niger и Penicillium. Препараты глюкозооксидазы получены в кристаллическом виде.
Глюкозооксидаза стабильна в течение длительного времени при температуре 40 °С. Фермент имеет оптимальную зону рН 5,5 при 30 °С и 6,0 для 35 °С.
Так как очищенные препараты глюкозооксидазы взаимодействуют практически с глюкозой, они являются одним из важных ферментов, применяемых в пищевой технологии и клинической биохимии для определения сахара в крови.
Глюкозооксидаза нашла применение в пищевой промышленности как для удаления следов глюкозы, так и для удаления следов кислорода. Это необходимо при переработке пищевых продуктов, качество и аромат которых ухудшаются от того, что в них присутствует глюкоза, таких, например, как сухой яичный альбумин или яичный порошок. Удалять незначительные количества глюкозы желательно даже в том случае, если продукты питания подвергаются тепловой обработке, высушиванию, в процессе которых возможно взаимодействие глюкозы с белками и другими соединениями, приводящими к появлению темного окрашивания (реакция Майяра или меланоидиновая реакция).
Длительное присутствие даже небольших количеств кислорода приводит к изменению цвета и аромата пива, вина, фруктовых соков, майонеза и многих других продуктов, подвергающихся порче в результате окисления. Поэтому было предложено применять препараты глюкозооксидазы для удаления кислорода из пива, вина, фруктовых соков, ароматических экстрактов.
Полифенолоксидаза
Систематическое название фермента — монофенол-дегидроксифенилаланин: кислород оксидоредуктаза. Этот фермент известен под различными тривиальными названиями, такими как тирозиназа, фенолаза, катехолоксидаза, монофенолоксидаза, о- и n-дифенолоксидаза; орто-фенолаза.
Полифенолоксидаза является несколько более общим термином, так как включает в себя несколько близкородственных ферментов.
Систематическое название фермента указывает на то, что этот фермент катализирует реакции, в которых акцептором водорода является молекулярный кислород воздуха, а фенолы действуют как доноры водорода. Фермент катализирует окисление как одноатомных, так и двухатомных фенолов. Это окисление специфично как для о-, так и для n-положения фенольных групп. Конечными продуктами окисления под действием полифенолоксидазы являются окрашенные продукты.
Темноокрашенные продукты (меланины, флабофены), возникающие в результате действия фермента, образуются в результате чисто химической реакции конденсации образовавшихся хинонов.
Фермент представляет собой медьсодержащий протеин. Это типичный металлофермент. Содержание меди составляет 0,2 % на одну молекулу фермента. При удалении меди фермент инактивируется, но при добавлении Cu2+ происходит реактивация. Оптимум активности выражен не резко, он находится в интервале рН от 5 до 7.
Под действием этого фермента многие овощи и фрукты после их разрезания при контакте с воздухом быстро темнеют. Одновременно на разрезанные фрукты и овощи воздействует ряд других оксидоредуктаз, в том числе пероксидаза, оксидаза аскорбиновой кислоты и др.
Потемнение разрезанного картофеля, яблок, грибов, персиков и других растительных тканей в большей степени или полностью зависит от присутствия и активности полифенолоксидазы.
Процесс потемнения или побурения можно предотвратить или уменьшить путем добавления таких веществ, как мета- и тетрабораты, образующие комплексы с хинонами. Аскорбиновая кислота предотвращает реакцию побурения, вызывая восстановление о-хинонов и тем самым предотвращая их полимеризацию. Чаще всего при переработке растительного сырья для предотвращения потемнения используют двуокись серы (SO2) или бисульфит натрия (NaHSO3).
Тепловая обработка (бланшировка) — наиболее предпочтительный метод ингибирования фермента в производстве фруктовых соков. Необходимое время и температура зависят от рН: при понижении рН происходит уменьшение ферментативной активности, полифенолоксидаза необратимо инактивируется при рН ниже 3.
В пищевой промышленности интерес к полифенолоксидазе связан с необходимостью предотвращения вызываемого ею ферментативного потемнения.
Высокая активность полифенолоксидазы оказывает положительное влияние на сырье и продукты в ряде ферментативных процессов, например при ферментации чая, табака, придает характерный цвет корке при выпечке ржаного хлеба.
Цвет ржаного хлеба является результатом действия полифенолоксидазы на аминокислоту тирозин – производную монофенола. При действии этого фермента на тирозин образуются темноокрашенные вещества — меланины. Однако действие полифенолоксидазы играет отрицательную роль при производстве макаронных изделий. Если партия муки, из которой будут изготовлены макароны, имеет повышенную активность полифенолоксидазы, то макароны при сушке будут темнеть и их потребительские свойства будут снижены.
Аскорбатоксидаза
Систематическое название — L-аскорбат: кислород оксидоредуктаза.
Аскорбатоксидаза катализирует окисление L-аскорбиновой кислоты в дегидро-L-аскорбиновую кислоту в соответствии с реакцией:
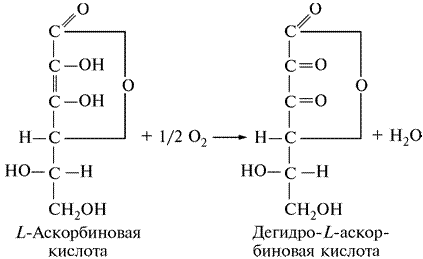
Окисление L-аскорбиновой кислоты катализируется также ионами Cu2+, но с незначительной скоростью. В этом случае образуется не вода, как при ферментативном окислении, а перекись водорода.
В качестве функциональной группы аскорбатоксидаза содержит медь, поэтому она чувствительна к действию агентов, ингибирующих ферменты, в частности содержащих тяжелые металлы.
Темно-синий цвет фермента аскорбатоксидазы, выделенной в неочищенном состоянии, обусловлен наличием меди, содержание которой колеблется в пределах 0,24 %, оптимум рН фермента 5,6.
Аскорбатоксидаза является широко распространенным ферментом и найдена во многих высших растениях, где она присутствует в растворимых частях цитоплазмы. Кристаллическая аскорбатоксидаза также выделена из растительных источников. В животных тканях подобного фермента не обнаружено.
Этот фермент ответствен за разрушение витамина С при технологической переработке растительного материала, но в то же время он положительно влияет на окраску и аромат растительных продуктов, например соков, связывая кислород.
Нежелательное действие фермента можно предотвратить, подвергая сырье кратковременной тепловой обработке — бланшированию.
Липоксигеназа
Систематическое название — линолеат: кислород оксидоредуктаза. Фермент содержит железо. На одну молекулу фермента приходится один атом трехвалентного железа в ионной форме. Фермент катализирует реакцию окисления ненасыщенных жирных кислот кислородом воздуха с образованием перекиси ненасыщенной жирной кислоты. Специфичность этого фермента состоит в том, что действию фермента подвергаются лишь те полиненасыщенные жирные кислоты, которые содержат цис- цис-1,4-пентадиеновую группу.
Жирными кислотами, содержащими цис- цис-1,4-пентадиеновую группу, кроме линолевой, являются линоленовая С18:3 и арахидоновая С20:4 кислоты.
Жирные кислоты с цис-транс- или транс-транс-конфигурацией двойных связей ферментом не окисляются.
Липоксигеназа широко распространена в растительном мире. Она найдена в пшенице и других злаках, в семенах масличных и бобовых растений. Самым богатым источником фермента являются соевые бобы.
Липоксигеназа получена в кристаллическом состоянии, она представляет собой солерастворимый белок (глобулин).
Оптимум рН фермента лежит в зоне от 6 до 7, оптимальная температура 20...30 °С.
Образующиеся гидроперекиси жирных кислот (органические перекиси) имеют высокую окислительную способность благодаря наличию перекисного кислорода и могут далее окислять ненасыщенные жирные кислоты, каротин, витамин А, аминокислоты и аскорбиновую кислоту. Липоксигеназа играет существенную роль в прогоркании жиров и жиросодержащих продуктов, в том числе получаемых из орехов, овса, муки, крупы и др.
Образование свободных радикалов под действием ферментов приводит к разрушению соединений, определяющих аромат пищевых продуктов. Поэтому при переработке пищевого сырья и выработке из него продуктов важны ингибиторы липоксигеназы. Таким ингибитором является используемый в качестве антиоксиданта токоферол – витамин Е. Фермент липоксигеназы можно инактивировать также термической обработкой продуктов.
Препараты липоксигеназы находят применение в пищевой технологии. Так, липоксигеназа применяется при производстве хлеба для получения очень белого мякиша. Действие липоксигеназы связано с одновременным окислением ею каротина и ненасыщенных жирных кислот кислородом воздуха.
Действие липоксигеназы приводит к нежелательным последствиям при длительном хранении различных продуктов переработки зерна. Ее отрицательное значение заключается в том, что при окислении ненасыщенных жирных кислот, содержащихся в муке и крупе, происходит образование гидроперекисей, которые затем окисляют различные вещества, и в первую очередь липиды, тем самым придавая продуктам неприятные вкус и запах. Именно в этом заключается сущность процесса прогоркания муки и крупы.
В то же время на самых первых этапах хранения свежеполученной пшеничной муки липоксигеназа благотворно влияет на качество муки, ускоряя ее «созревание».
Липоксигеназа имеет большое значение в макаронной промышленности. Макароны изготавливают из специальной макаронной муки, которую получают из твердых сортов пшениц. Если липоксигеназа в зерне достаточно активна, то получаются бледные макароны более низкого качества из-за обесцвечивания каротиноидов и других пигментов муки.
Пероксидаза
Систематическое название фермента пероксидазы (1.11.1.71) — донор: Н2О2 — оксидоредуктаза, т.е. в качестве окислителя фермент использует кислород пероксидов. Она катализирует реакцию
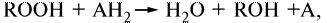
где в качестве ROOH может быть пероксид водорода HOOH или органические перекиси, т. е. она высокоспецифична в отношении акцептора водорода, и совсем не специфична в отношении донора водорода. Подвергаться окислению могут многочисленные фенолы, аминофенолы, диамины, индофенолы, аскорбат и некоторые аминокислоты. Таким образом, пероксидаза является ферментом, обладающим относительной специфичностью.
Механизм действия пероксидазы может быть описан следующим образом:

Пероксидаза с перекисью водорода образует промежуточное комплексное соединение.
Пероксидаза — это двухкомпонентный фермент, простети-ческая группа которого содержит гем.
Пероксидаза из разных источников отличается молекулярной массой: молекулярная масса пероксидазы из хрена 40 000 Да, а из молока 82 000 Да. Обычно препараты пероксидазы выделяют из хрена. Она относительна устойчива: нагревание при 85 °С в течение 30 мин инактивирует фермент только на 50 %.
Определение активности пероксидазы в молоке имеет большое значение в молочной промышленности: по наличию этого фермента можно судить о правильном проведении процесса пастеризации.
Для увеличения лежкости и сохранности перерабатываемых пищевых продуктов необходимо удалить или ингибировать пероксидазу наряду с инактивацией полифенолоксидазы.
В связи с тем что пероксидаза устойчива к действию повышенных температур, ее инактивация представляет определенные трудности.
При ферментации чая и табака пероксидаза наряду с полифенолоксидазой способствует образованию окрашенных и ароматизированных компонентов.
Каталаза
Систематическое название – Н2О2—Н2О2-оксидоредуктаза.
Каталаза дегидрирует молекулу перекиси водорода. Отнятый от субстрата водород переносится на вторую молекулу перекиси водорода, образуя воду и молеклярный кислород:

Таким образом, фермент окисляет одну молекулу перекиси водорода с одновременным восстановлением второй молекулы перекиси водорода до воды. Вместо пероксида водорода фермент может использовать в качестве субстрата и органические перекиси. Кроме того, донорами водорода могут служить метанол, этанол и другие спирты:
|
|
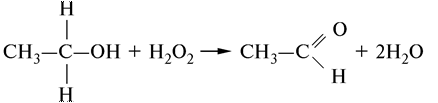
Каталаза — двухкомпонентный фермент, простетическая группа фермента содержит 4 геминовые группы, каждая из которых прочно связана с белком. Катализ не сопровождается изменением валентности железа.
Каталаза найдена во всех клетках с аэробным типом обмена веществ. Роль каталазы связана с тем, что она защищает организм от вредного влияния перекиси водорода, образующегося при дыхании.
В пищевой промышленности препараты каталазы применяются там, где желательна обработка перекисью водорода, но через определенный срок Н2О2 необходимо удалить. Так, каталаза используется для удаления избытка перекиси водорода при обработке молока в сыроварении, где Н2О2 применяется в качестве консерванта.
Дата добавления: 2019-07-15; просмотров: 1312; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
