Физико-химические свойства белков
Физические свойства
1. В живых организмах белки находятся в твердом и растворенном состоянии. Многие белки являются кристаллами, однако, они не дают истинных растворов, т.к. молекула их имеет очень большую величину. Водные растворы белков – это гидрофильные коллоиды, находящиеся в протоплазме клеток, и это активные белки. Кристаллические твердые белки – это запасные соединения. Денатурированные белки (кератин волос, миозин мускулов) являются опорными белками.
2. Все белки имеют, как правило, большую молекулярную массу. Она зависит от условий среды (t°, рН) и методов выделения и колеблется от десятков тысяч до миллионов.
3. Оптические свойства. Растворы белка преломляют световой поток, и чем больше концентрация белка, тем сильнее преломление. Пользуясь этим свойством, можно определить содержание белка в растворе.
В виде сухих пленок белки поглощают инфракрасные лучи. Они поглощаются пептидными группами.
Денатурация белков
Нативная конформация глобулярного белка – исключительно лабильная и подвержена изменениям под влиянием химических агентов или энергетических и механических нагрузок. Под влиянием внешних факторов может происходить разрыв большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная, уникальная для каждого белка конформация пептидной цепи нарушается, и белковая молекула целиком или большая ее часть принимает форму беспорядочного клубка – происходит его денатурация.
Денатурация белка – это внутримолекулярная перегруппировка его молекулы, нарушение нативной конформации, не сопровождающиеся расщеплением пептидной связи. Аминокислотная последовательность белка не изменяется. В результате денатурации происходит нарушение вторичной, третичной и четвертичной структур белка, образованных нековалентными связями, и биологическая активность белка утрачивается полностью или частично, обратимо или необратимо в зависимости от денатурирующих агентов, интенсивности и продолжительности их действия.
Денатурация происходит под действием различных факторов, которые можно подразделить на физические, химические и механические.
Физические. Денатурация вызывается высокими температурами – нагреванием раствора белка до 60…80°С. При 100°С все белки денатурируют. Кроме высоких температура, из физических факторов денатурирующее действие на белковую молекулу оказывают излучения различной частоты и природы: α-, β-, γ-излучения, токи высокой частоты, ультразвук, ультрофиолетовое излучение и др.
Химические. Из химических факторов денатурацию белков вызывают концентрированные кислоты и щелочи, соли тяжелых металлов – олова, меди, ртути, мышьяка, кадмия, свинца, марганца и др., а также действие поверхностно-активных веществ, обладающих полярными молекулами, - мочевины, гуанидинхлорида. Эти вещества нарушают нативное распределение связей, стабилизирующих белковую молекулу.
Механические – растирание, взбивание, интенсивное перемешивание растворов белка или встряхивание и др.
При денатурации кроме потерь биологической активности возникают потери или снижаются растворимость белка и его водопоглотительная способность, происходит изменение вязкости растворов белка, а также механических свойств белоксодержащих продуктов.
Денатурация может быть:
- Обратимой – в том случае, когда комплекс белок-ингибитор может распадаться, и белок возвращается в исходное состояние (высаливание).
- Необратимой – нативные свойства белка не восстанавливаются. Обычно происходит под действием специфических факторов денатурации, когда связываются активные группы.
Денатурация белков имеет большое значение во многих технологических процессах пищевой промышленности – при выпечке хлеба, сушке макарон, овощей, зерна и семян, отжиме растительного масла на прессах, консервировании, кулинарной обработке пищевых продуктов и ряде других.
Под влиянием денатурации белки пищевых продуктов приобретают большую доступность действию протеолитических ферментов, возрастает реакционная способность химических групп, входящих в состав белковой молекулы, изменяется форма белковой молекулы – она «разрыхляется» или становится более компактной в зависимости от условий денатурации, гидрофобность белка растет.
Изоэлектрическая точка
Белки, как и аминокислоты, - амфотерные электролиты, которые мигрируют в электрическом поле со скоростью, зависящей от их суммарного заряда и рН среды. При определенном для каждого белка значении рН его молекулы электронейтральны. Это значение рН называется изоэлектрической точкой белка. Изоэлектрическая точка белка зависит от числа и природы заряженных групп в молекуле. Белковая молекула заряжена положительно, если рН среды ниже величины ее изоэлектрической точки, и отрицательно, если рН среды выше значения изоэлектрической точки данного белка. В изоэлектрической точке белок обладает наименьшей растворимостью и наибольшей вязкостью, в результате чего происходит наиболее легкое осаждение белка из раствора – коагуляция белка. Изоэлектрическая точка – одна из характерных констант белков. Однако если довести раствор белка до изоэлектрической точки, то сам по себе белок все же не выпадает в осадок. Это объясняется гидрофильностью белковой молекулы.
Гидрофильность белка
На поверхности белков расположены различные гидрофильные группы, притягивающие дипольные молекулы воды. Гидрофильность различных групп разная.
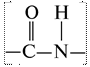
Пептидная связь связывает одну молекулу воды,
карбоксильная группа –СОО– - 4 молекулы воды, – NН+3-аминная группа – 1 и т.д. Поэтому вокруг белковой молекулы находится так называемая гидратационная оболочка, придающая устойчивость белковым растворам и препятствующая осаждению молекулы белка.
Высаливание белков
Если удалить эту водную оболочку у белковой глобулы, т.е. уменьшить ее гидратацию, то молекулы белка начнут агрегировать, образуя более крупные частицы, и под действием собственной силы тяжести начнут оседать из раствора в виде осадка.
Удалить водную оболочку можно с помощью органических растворителей (спирта, ацетона) или солей щелочных или щелочно-земельных металлов. Поскольку молекулы солей, спирта или ацетона более гидрофильны, чем белковые глобулы, они снимают с белка водную оболочку, в результате чего он легко выпадает в осадок.
Так как осаждение белка из раствора достигается путем добавления к белковому раствору достаточного количества солей, процесс выделения белка из раствора под влиянием солей носит название высаливания. Осаждающая способность соли зависит от химической природы как катиона, так и аниона. По своей осаждающей способности катионы и анионы объединены в так называемые лиотропные ряды, где они размещены по уменьшающейся слева направо осаждающейся способности.
Лиотропные ряды:
катионы: СS+, Rb+, К+, Nа+, Li+, Ва2+, Sr2+, Са2+, Мg2+;
анионы: SО2-4, Сl–, Br–, NO–3, J–, CNS–.
Высаливание широко применяют для выделения белков, при этом денатурации не происходит.
Набухание белков
При определенных условиях белковые растворы набухают, превращаются в коллоидные системы – гели. В гелях растворитель и белок образуют одну внешне гомогенную массу, подобную студню. Высушенный гель, помещенный в воду, впитывает ее в очень больших количествах. Это впитывание воды называется набуханием геля. Процессы набухания белков играют важную роль в пищевой промышленности. Набухание зерна при его обработке – замочке, кондиционировании и прорастании, набухание муки при изготовлении теста, образование студней при добавлении желатина к различным кондитерским изделиям – все эти процессы связаны с набуханием белков. Явление, обратное набуханию, т.е. выделение воды из геля, называется синерезисом.
Классификация белков
Все природные белки (протеины) подразделяют на два больших класса: простые и сложные.
Простые белки гидролизуются кислотами или щелочами до аминокислот и не дают при гидролизе других органических и неорганических соединений. Они состоят только из остатков α-аминокислот. Классификация простых белков основана на растворимости.
1. Альбумины – белки, которые растворяются в воде. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых (однодольных) растений, белки семян двудольных растений. Из водных растворов эти белки хорошо высаливаются, а при кипячении – денатурируют. Название белков обычно связано с ботаническим названием растения, в котором они локализованы. Альбумины у пшеницы и риса называются лейкозинами, гороха – легумелинами, а у клещевины – рицинами.
2. Глобулины – белки, растворимые в солях. Обычно для их экстракции применяют 10%-ный раствор NaCl. Глобулины составляют большую часть белков семян масличных культур. Многие альбумины и глобулины обладают ферментивными свойствами. Глобулины кукурузы получили название маизин, фасоли – фазеолин, гороха – легулеин, конопли – эдестин, арахиса – арахин, тыквы – кукурбитин.
3. Проламины – белки, которые растворяются в 60-80%-ном растворе этилового спирта. Название «проламины» они получили вследствие того, что в их состав входит большое количество аминокислоты пролина. Проламины синтезируются только в семенах злаковых растений. Проламины пшеницы называют глиадинами, кукурузы – зеинами, сорго – каферинами.
4. Глютелины – белки, которые извлекаются из растительных тканей разбавленными растворами щелочей (0,2%-ный NаОН). Глютелины пшеницы – это глютенин, риса – оризенин.
Проламины и глютелины составляют основную массу клейковины пшеницы. Качество клейковины, а следовательно и муки, зависит от количества и соотношения глиадина и глютенина.
Кроме этих четырех групп белков к простым относят также следующие белки со специфическими свойствами:
5. Протамины – это белки небольшой молекулярной массы, состоящие на 80% из щелочных аминокислот и не содержащие серу.
Эти белки обнаружены только в сперме (молоках) рыб. По величине молекул протамины – самые малые белки. Некоторые из них даже состоят из семи аминоксилот, среди которых аргинин, пролин и серин составляют больше половины молекулы.
6. Гистоны – низкомолекулярные белки также основного характера, содержатся в хромосомах клеточных ядер и играют важную роль в образовании структуры хроматина. Гистоны – настоящие белки, в их состав входят почти все белковые аминокислоты. Они характеризуются высоким содержанием основных аминокислот: примерно каждая четвертая аминокислота – это аргинин или лизин. Они локализованы у растений в ядре клетки, рибосомах и митохондриях, где играют роль структурных элементов этих органоидов.
Сложные белки кроме аминокислотных остатков белковой части молекулы содержат также небелковую, или простетическую группу. Простетическая группа может быть представлена химическими веществами различной природы (табл. 1). Сложные белки подразделяются по небелковому компоненту.
Связи между полипептидными цепями белка и простетической группой могут быть ковалентными и нековалентными.
Таблица 1
Простетические группы некоторых сложных белков
| Простетическая группа | Сложный белок |
| Атомы (ионы) металлов Фосфатные группы Н3РО4 Хлорофилл Моно- и олигосахариды Триацилглицеролы и сложные липиды Флавиннуклеотиды Рибонуклеиновые кислоты Дезоксирибонуклеиновые кислоты | Металлопротеины Фосфопротеины Хромопротеины Гликопротеины Липопротеины Флавопротеины Рибонуклеопротеины (рибосомы) Дезоксирибонуклеопротеины (хроматин) |
Среди сложных белков липопротеины и нуклеопротеины различаются очень высокой сложностью строения, образуя в живой клетке надмолекулярные структуры, специфическая организация которых обусловлена биохимическими процессами, протекающими с участием этих белков.
Дата добавления: 2019-07-15; просмотров: 1242; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
