Особенности ферментов как биологических катализаторов
Ферменты как биологические катализаторы имеют ряд особенностей, которые отличают их от катализаторов неорганической природы:
- Ферментативные реакции протекают в физиологически нормальных для живого организма условиях и не требуют жестких условий – повышенной температуры, высокой кислотности среды, избыточного давления;
- Ферменты как катализаторы строго специфичны, они катализируют только определенные биохимические реакции, действуя лишь на определенный субстрат;
- Ферментативные реакции в живых организмах идут последовательно, таким образом, что субстратом для каждого последующего фермента является конечный продукт предшествующей ему ферментативной реакции;
- Скорость ферментативных реакций высока, но она зависит от количества или активности фермента, концентрации субстрата, рН и состава раствора, температуры, присутствия активаторов и ингибиторов;
- Ферментативные реакции идут со 100%-ным выходом и не дают побочных продуктов реакции;
- Все ферменты являются белками. Молекулярная масса ферментов колеблется в широких пределах от 12 · 103 до 10 · 106 Да;
- Ферменты образуют в клетке мультиферментные системы, как правило, связанные с клеточными структурами. Они не токсичны.
Механизм действия ферментов
Скорость химической реакции зависит от концентрации реагирующих веществ и от температуры, так как эти факторы приводят к увеличению частоты и энергии столкновения реагирующих молекул. Чем выше температура – мера кинетической энергии молекул, тем чаще они могут сталкиваться и тем, следовательно, выше скорость реакции.
Но скорость реакции зависит не только от концентрации и температуры. Общее число столкновений молекул реагирующих веществ значительно больше, чем число прореагировавших молекул, так как индивидуальные молекулы при постоянной температуре сильно различаются по количеству содержащейся в них энергии. Вступают в реакцию только те молекулы, которые находятся в активном состоянии, т. е. обладают энергией, необходимой для преодоления активационного барьера реакции. Молекулы будут активированы, если получат дополнительное количество энергии, называемое энергией активации.
Энергия активации – это количество энергии Е, которое необходимо сообщить молекулам реагирующих веществ, чтобы перевести их в активное состояние, соответствующее вершине энергетического (активационного) барьера. Эту энергию молекулы могут получить путем повышения температуры реагирующих веществ. Как правило, повышение температуры на 10 °С ускоряет химическую реакцию приблизительно в 2 раза.
Ускорить химическую реакцию можно также путем добавления к реагирующим веществам катализатора. Сущность действия катализаторов заключается в том, что катализатор снижает энергию активации, направляя реакцию «обходным» путем, что позволяет молекулам преодолевать энергетический (активационный) барьер на более низком уровне (рис. 6).
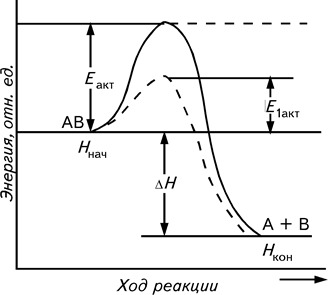
Рис. 6. Изменение энергии активации реагирующих веществ в реакции АВ ® A + В в присутствии катализатора и в его отсутствии:
Ннач, Нкон – энергия соответственно исходных веществ и конечных продуктов; DН – тепловой эффект реакции; Еакт, Е1акт – энергия активации соответственно некатализируемой и катализируемой реакций
Как видно из рис. 6, катализатор снижает энергию активации Еакт реагирующих веществ, не влияя при этом на изменение свободной энергии (DН) в ходе реакции и на конечное состояние равновесия. Реакция АВ ® А + В в присутствии катализатора К идет следующим образом:
АВ + К ® АВК
АВК ® ВК + А
ВК ® В + К
Поэтому в присутствии катализаторов, снижающих энергию активации, гораздо большая доля молекул вступает в реакцию в единицу времени.
Так, например, при гидролизе сахарозы на глюкозу и фруктозу в водной среде требуется 133,9 кДж/моль. В присутствии ионов Н+ энергия активации снижается до 107,1 кДж/моль, а при действии фермента b-фруктофуранозидазы она составляет 39,3 кДж/моль.
Ферменты, так же как и катализаторы другой природы, образуют комплексы с субстратами, которые затем в ходе катализа распадаются на фермент и продукты реакции.
Снижение энергии активации реакции гидролиза сахарозы под влиянием фермента происходит вследствие некоторой деформации молекул субстрата. Эта деформация ослабляет внутримолекулярные связи и делает молекулу значительно более способной к реакции.
Строение ферментов
Предшествующим событием при выполнении любой биологической функции белка является связывание его с другим соединением – субстратом. При связывании проявляется одно из важнейших свойств фермента – его специфичность. Для связывания необходимы контакт субстрата с активным центром фермента – контактной поверхностью белка, образованной несколькими специфическими R-группами аминокислот, расположенных определенным образом в пространстве.
Ферменты подразделяют на две группы:
1. Однокомпонентные, состоящие только из белковой молекулы;
2. Двухкомпонентные, в состав которых кроме белковой входит небелковая (непептидная) часть.
Коферменты – это органические вещества, обычно не аминокислотной природы. Они участвуют в переносе функциональных групп субстрата – атомов водорода, ацетила, аминогруппы и др. Фермент, содержащий кофермент, называют холоферментом, а белковую часть его – апоферментом или фероном. Отвечает за специфичность ферментов (каталаза и пероксидаза). Небелковая – агон или простетическая группа. Отвечает за активность фермента. Если простетическая группа отделяется от белка, она носит название кофермента. Реакция образования холофермента обратима:
Кофермент + Апофермент « Холофермент
Коферменты, как правило, входят в состав активного центра фермента.
Коферменты в своем составе содержат витамины и не могут синтезироваться организмом человека и животных. У ряда ферментов коферментами являются витамины В1, В2, В6, В12, РР, биотин, пантотеновая кислота и некоторые другие.
Рассмотрим в качестве примера фермент пируватдекарбоксилазу. Это типичный двухкомпонентный фермент, катализирующий расщепление пировиноградной кислоты на диоксид углерода и ацетальдегид:

Химическая природа активной группы пируватдекарбоксилазы представляет собой соединение молекулы тиамина – витамина В1 и двух молекул фосфорной кислоты. Эта активная группа – тиаминпирофосфат, соединяясь со специфическим белком, образует фермент пируватдекарбоксилазу.
Витамин В2 (рибофлавин) входит в состав флавинмононуклеотида (FMN) и флавинадениндинуклеотида (FAD), которые являются коферментами аэробных дегидрогеназ. Витамин РР (амид никотиновой кислоты) – составная часть коферментов анаэробных дегидрогеназ: NAD+ (никотинамид-адениндинуклеотида) и NADР+ (никотинамидадениннукле-отидфосфата).
Коферменты термостабильны, а белковая часть фермента (апофермент) термолабильна и легко денатурирует при неблагоприятных внешних воздействиях.
В состав активного центра многих ферментов входят гидроксильные группы аминокислоты серина, карбоксильные группы аспарагиновой и глутаминовой кислот, аминные группы аминокислоты лизина, сульфгидрильные группы аминокислоты цистеина.
Свойства ферментов
3.4.1 Активность ферментов. Одним из основных отличительных свойств ферментов является их очень высокая активность. По силе каталитического действия (активности) ферменты в сотни тысяч раз превосходят обычные катализаторы. Ферменты повышают скорость каталитических реакций в 108…1020 раз.
Для выражения каталитической активности согласно рекомендациям Международного биохимического союза используется катал. Катал (кат) – это каталитическая активность, способная осуществить реакцию со скоростью, равной 1 молю в секунду, в заданной системе измерения активности. В большинстве случаев каталитическая активность выражается в микрокаталах (мккат), нанокаталах (нкат) или пикокаталах (пкат), чему отвечают скорости реакций, выражающиеся в микромолях и пикомолях в секунду.
Одной из важнейших производных величин является удельная каталитическая активность фермента, которую можно выразить в каталах на 1 кг (кат/кг). Другой производной величиной является молярная каталитическая активность, выражаемая в каталах на моль фермента.
3.4.2 Специфичность ферментов. Специфичность (избира-тельность) действия ферментов выражается в их способности катализировать строго определенную реакцию, действовать на определенный субстрат или даже на определенную связь в этом субстрате без образования в итоге побочных продуктов.
Существование определенных ферментов для каждого типа химических реакций, происходящих в клетке, – основной закон биологии. Специфичность ферментов обусловлена наличием в них молекулы белка.
Различают несколько видов специфичности – абсолютную, относительную и стереохимическую.
- Абсолютная специфичность проявляется в том, что фермент действует только на один субстрат, даже на определенную связь в этом субстрате.
Уреаза обладает абсолютной специфичностью к мочевине. Этот фермент катализирует гидролиз мочевины на аммиак и диоксид углерода:
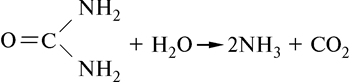
Абсолютной специфичностью обладает каталаза, расщепляющая пероксид водорода на воду и кислород:
H2O2 ® H2O + 1/2 O2
- Относительная групповая специфичность фермента проявляется в том, что он может действовать не на один, а на несколько субстратов, относящихся к одному или нескольким классам органических соединений. Так, фермент пируватдекарбоксилаза катализирует декарбоксилирование пировиноградной кислоты с образованием уксусного альдегида и диоксида углерода. Но этот же фермент декарбоксилирует и другие a-кетокислоты с более длинной углеродной цепочкой, однако скорость реакции с удлинением цепи заметно падает.
- Стереохимической специфичностью. Ферменты действуя только на определенные стереоизомерные формы субстрата.
Специфичность действия ферментов приводит к тому, что превращение веществ в организме происходит строго упорядоченно, определяя путь, по которому идет превращение веществ. Благодаря специфичности фермент направляет реакцию по одному и тому же пути.
3.4.3 Лабильность ферментов. Это зависимость их активности от факторов внешней среды. На скорость ферментативной реакции влияют следующие факторы.
- Влияние температуры. Влияние температуры на действие ферментов проявляется в той же степени, что и на все химические процессы. Повышение температуры на 10 °С согласно правилу Вант-Гоффа увеличивает скорость ферментативной реакции в 2…3 раза. Однако такое ускорение наблюдается в строго определенных температурных пределах – до 40 °С (рис. 7). Оптимальная температура не остается постоянной, с увеличением продолжительности реакции она сдвигается в сторону более низких температур. Такой характер влияния температуры связан с действием двух факторов: с одной стороны, с увеличением температуры возрастает скорость ферментативной реакции, а с другой – происходит инактивация фермента вследствие денатурации белка, что приводит к непрерывному уменьшению концентрации активного фермента.
На процесс инактивации ферментов оказывает влияние содержание воды, так как в высушенном состоянии ферменты более термостабильны. Например, триацилглицерол-липаза сохраняет свою активность в сухих семенах клещевины на 50 % после их прогревания при 120 °С в течение 2 ч.
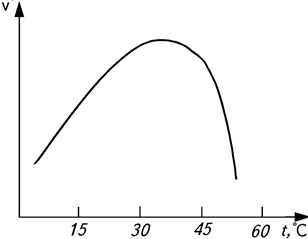
Рис.7. Зависимость скорости υ ферментативной реакции
от температуры t (°C)
Тепловая инактивация ферментов почти всегда является результатом денатурации белка, входящего в состав фермента.
- Влияние кислотности среды (рН). Для каждого фермента характерна определенная область оптимальных значений рН, при которых фермент проявляет максимальную активность (рис. 8).

Рис. 8. Зависимость скорости υ ферментативной реакции от рН cреды
Влияние рН среды на действие ферментов основано на том, что происходит изменение заряда белка различных групп в активном центре фермента, вызывающее существенное изменение конформации полипептидной цепи. Для каждого фермента известен оптимум рН, при котором его каталитическая активность максимальна. Ферменты наиболее активны в относительно узком пределе колебаний рН. Большинство растительных ферментов имеет оптимум в пределах физиологических значений рН – 4,0…7,0 (α-амилаза более чувствительна к подкислению).
- Влияние ингибиторов и активаторов. Действие большинства ферментов зависит от наличия ряда веществ, приводящих к инактивации ферментов. Эти вещества получили название ингибиторов.
Ингибиторы бывают общего действия и специфические. Ингибиторы общего действия действуют на белковую часть фермента, а специфические – блокируют активный центр фрмента.
Ингибиторы подразделяют на обратимые и необратимые. Необратимые ингибиторы связывают или разрушают функциональные группы молекулы фермента, необходимые для проявления его каталитической активности, при этом активность фермента не восстанавливается даже в том случае, если ингибитор удаляется каким-либо способом.
Участок молекулы фермента, к которому присоединяется ингибитор, вызывающий изменение конформации фермента, называется аллостерическим центром, а соответствующие ферменты – аллостерическими (от греческого слова «аллос» – другой). Вещества, которые присоединяются к аллостерическому центру, называются эффекторами.
Активаторами называются вещества, которые увеличивают скорость ферментативных реакций. К ним относятся ионы некоторых металлов. Для активирования цитохромоксидазы, каталазы, пероксидазы необходимы ионы железа, полифенолоксидазы – ионы меди, гексокиназы – ионы магния и т. д. К активаторам относятся также органические вещества, содержащие амино- и сульфгидрильные группы.
Дата добавления: 2019-07-15; просмотров: 3574; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
