Т-клетки иммунологической памяти – это долгоживущие лимфоциты, потомки клеток, встречавшихся с антигенами и сохраняющие к ним рецепторы.
Т-ЛИМФОЦИТЫ ИММУНОЛОГИЧЕСКОЙ ПАМЯТИ - после стимуляции антигеном способны сохранять информацию о нем до 10—15 лет и передавать ее другим клеткам. Эти клетки защищены от апоптоза. Благодаря наличию в организме Т-клеток памяти обеспечивается ускоренный иммунный ответ по вторичному типу при повторном попадании данного антигена в организм. Этим объясняется форсированная динамика вторичного иммунного ответа. Маркером Т- лимфоцитов памяти является мембранный антигенCD45RO.
Раньше ошибочно выделяли субпопуляцию Т-супрессоров, которые считались ответственными за подавление иммунного ответа. Однако в настоящее время показано, что самостоятельной субпопуляции Т- супрессоров нет. В угнетении, подавлении иммунного ответа решающее значение играет апоптоз простимулированных лимфоцитов, а также цитокин – трансформирующий фактор роста β.
Около 10 % лимфоцитов не имеют ни Т-, ни В-маркеров, они не относятся ни к Т-, ни к В-лимфоцитам и ранее получили название НУЛЕВЫЕ ЛИМФОЦИТЫ . Эта разнородная популяция лимфоцитов в зависимости от их морфофункциональных особенностей подразделяется на:
l ЕСТЕСТВЕННЫЕ (natural) КИЛЛЕРНЫЕ КЛЕТКИ (сокращенно ЕКК=ЕК=NK-клетки) и
L КИЛЛЕРНЫЕ КЛЕТКИ (К-клетки).
Общей особенностью НК- и К-клеток является способность лизировать клетки-мишени без предварительной сенсибилизации, что необходимо Т-лимфоцитам-киллерам. Морфологически это лимфоциты большого размера с зернистой цитоплазмой. Дифференцируются из общей клетки предшественника лимфоцитов (LSC).
|
|
|
Естественные киллеры не зависят в своем развитии от вилочковой железы. Экспрессируют на своей поверхности рецепторы к интерферону-γ и интерлейкину-2 (ИЛ 2). Функционально они являются цитотоксическими клетками киллерами, но на NK нет антигенраспознающих рецепторов, которые обязательно присутствуют на Т-киллерах. Натуральных киллеров на клетку мишень наводят антитела IgG специфичные к мембранным антигенам клетки-мишени. Первоначально антитела связываются с антигеном на клетке, а затем с помощью Fc рецептора к IgG (FcγRIII) NK присоединяется к этому комплексу АТ - АГ-клетки-мишени. Функция НК-клеток в организме заключается в защите от развития опухолей, вирусов и др.
 Основными их маркерами являютсяCD16 и CD56. (FcγRIII по CD- номенклатуре это CD16).
Основными их маркерами являютсяCD16 и CD56. (FcγRIII по CD- номенклатуре это CD16).
Разрушение клетки-мишени ЕК осуществляет с помощью перфорина. Содержание ЕК (CD16+ клеток) у здоровых людей – 8 – 22%.
К-клетки неоднородная группа клеток, несущая на своей поверхности рецепторы к Fc- фрагменту Ig G и способны к антителозависимой клеточной цитотоксичности. К ним относятся моноциты, нейтрофилы, макрофаги, эозинофилы, конечно НК и некоторые лимфоциты.
|
|
|
Антителозависимая клеточноопосредованная цитотоксичность (АЗКЦ) является своеобразным отражением связи между гуморальным и клеточным звеньями иммунной системы. Антитела выступают в роли«наводчиков» клеток-эффекторов на клетки-мишени, несущие чужеродные антигены.
Все лимфоциты (Т-, В-, НК- и К-клетки) обладают способностью к миграции и рециркуляции (см. методическую, что обеспечивает повсеместный контроль за размножением клеток собственного организма, а при проникновении чужеродного антигена —генерализированный иммунный ответ и сохранение иммунологической памяти обантигене.
Основные этапы формирования TCR и субпопуляций Тх/Тк в тимусе
Роль стромальных элементов, эпителиальных и дендритных клеток, гуморальных факторов тимуса в дифференцировке Т - лимфоцитов
В составе тимуса имеются несколько долек, каждая из которых представлена эпителиальными клетками, дендритными клетками, макрофагами, лимфоцитами и другими клетками. Тимоцит - перемещается внутри органа, постоянно взаимодействуя с тимусной стромой.
Это взаимодействие со стромой обеспечивает сигналы, необходимые для созревания и клональной селекции.
|
|
|
Эпителиальные клетки тимуса формируют микроокружение,необходимое для деления и созревания лимфоцитов , их несколько разновидностей (гыстаа)
Секреторные клетки синтезируют такие пептидные гормоны, как тимолин, тимозины,тимопоэтин, которые стимулируют пролиферацию и дифференцировку тимоцитов.
Крупные эпителиальные клетки коркового вещества выполняют роль«клеток-кормилиц»для лимфоцитов.
Периваскулярные клетки входят в состав гематотимусного барьера , который предотвращает воздействие антигенов, циркулирующих в крови, на созревающие тимоциты.
Дендритные клетки тимуса играют важную роль в процессе отрицательной селекции созревающих Т-лимфоцитов, т.к. они представляют на своей поверхности собственные антигенные пептиды организма в комплексе с белками МНС. Если образующийся лимфоцит способен реагировать против собственных антигенов организма , то он получает от дендритной клетки сигнал к апоптозу.
29) Аг-независимый этап дифференцировки В-лимфоцитов
Антигеннезависимая дифференцированка у человека происходит в красном костном мозге, где формируется группа малодифференцированных В-лимфоцитов (кластер CD 19). КОЕ В-лимфоцитов преобразуются в лимфобласты, их которых формируется незрелый В-лимфоцит, его цитоплазма синтезируетIgM. Из них возникают юные В-лимфоциты, зрелые приобретают способность вырабатывать иммуноглобулины всех классов. С током крови они поступают в периферические органы иммунной системы (селезенка, лимфатические узлы, лимфоидные скопления в пищеварительном тракте), где под влиянием антигена, Т-хелперов идендритных (длинноотросчатых) макрофаговпроходятантигензависимую дифференцировку. При этом в корковом веществе лимфатических узлов и герминативных центрах лимфоидных фолликулов остальных органов возникает пул эффекторных клеток В-лимфоцитов (кластер CD 20). Из стимулированных В-лимфоцитов образуются В-лимфобласты, которые, размножаясь, приобретают способность к синтезу антител, становясь последовательно плазмобластами, проплазмоцитами и плазмоцитами. Решающими факторами размножения и трансформации являются цитокины (ил-2,4,5,10) и интерфероны, синтезируемые хелперами.
|
|
|
1)Антигенпредоставляющие клетки, происхождение, характеристика, основные маркеры, роль в иммунных реакциях
Антиген Т-клеткам представляют специализированные антигенпрезентирующие клетки (АПК) при прямом контактном взаимодействии. Презентация сопровождается передачей дополнительных сигналов (костимуляцией), обеспечивающей активацию клеток, распознавших антиген. В качестве АПК теоретически может выступать любая клетка, экспрессирующая молекулы MHC как I, так и II класса, а также костимулирующие молекулы. Как известно, всеми этими качествами обладают «профессиональные» АПК — дендритные клетки, макрофаги и В-лимфоциты (рис. 3.81); их могут приобретать многие другие клетки (например, эндотелиальные, эпителиальные) при активации, например, в условиях воспаления. Однако реально при первичном иммунном ответе, требующем вовлечения наивных Т-лимфоцитов, роль АПК могут эффективно выполнять только дендритные клетки, презентационный потенциал которых на два порядка превосходит таковой макрофагов.
Таким образом, в запуске иммунного ответа принимают участие 2 типа клеток — дендритные клетки и CD4+ Т-хелперы (здесь и далее в этой главе речь идет о первичном иммунном ответе, т.е. о реакции на первый контакт с данным антигеном). Таким образом, особое место презентации антигена в иммунных процессах обусловлено двумя обстоятельствами. Во-первых, это событие можно рассматривать как момент запуска иммунного ответа. Во-вторых, оно служит основной точкой взаимодействия подсистем врожденного и адаптивного иммунитета. При этом дендритные клетки представ- ляют врожденный, а Т-хелперы — адаптивный иммунитет.

2) Макрофаги- иммунологическая характеристика, этапы дифференцировки, маркеры. Виды макрофагов, основные функции макрофагов
Моноциты и макрофаги представляют стадии развития миелоидных клеток. Они образуют мононуклеарную фагоцитирующую систему. Циркулирующий вариант клеток — моноцит, тканевый — макрофаг. Превращение моноцита в макрофаг происходит под влиянием тканевого микроокружения и сопровождается экспрессией новых генов, т.е. может рассматриваться как дифференцировка клеток. Моноциты представляют довольно крупные клетки (диаметром 9–15мкм) с ядром бобовидной формы и тонкой структурой хроматина. Макрофаги значительно крупнее моноцитов (диаметр составляет 20–25мкм) и имеют распластанную форму. В отличие от округлых моноцитов, макрофаги имеют неправильные очертания и морфологически полиморфны.
К основным маркерам моноцитов и макрофагов относят:
1. РЕЦЕПТОРЫ ДЛЯ Fc-фрагментов иммуноглобулинов: высокоаффинный для IgG-CD64, низкоаффинный-CD16, для IgE-CD23.
2. рецепторы для компонентов комплемента - С3а, С5а, С3b (CD11b)
3. рецепторы для ЦК - ИФН; ИЛ-1, 6; ФНО, ФИМ (фактора, ингибирующего миграцию) и др.
4. адгезивные молекулы и рецепторы, которые обеспечивают одно из важных свойств этих клеток - адгезивность - CD18 и др.
5. лектины - углеводные компоненты; простые сахара.
6. рецепторы для других биологически активных субстанций: гормонов, нейромедиаторов, гистамина.
7. антигены ГКГ (HLA) - антигены I класса и II (HLA-DR) –на активированных клетках.
8. CD14 (рецептор для ЛПС); CD80 и 86

Основными биологическими функциями являются:
1. Фагоцитоз (поглощение и переваривание чужеродных частиц: микроорганизмов, опухолевых клеток, погибших собственных клеток);
2. Образование факторов иммунной защиты: синтез и секреция биологически активных веществ: цитокинов, компонентов комплемента, ферментов и др.;
3. Обработка антигена: процессинг и презентация антигенного материала;
4. Внеклеточный цитолиз: макрофаги оказывают повреждающее действие на клетки-мишени с помощью секретируемых продуктов и при контакте
5. Регуляция иммунного ответа путем выработки цитокинов, простагландинов и др. пептидных факторов;
6. Презентация антигенного материала Т-хелперам.
Макрофаги могут находиться в спокойном или активированном состоянии. Активирующими стимулами макрофагов являются: бактериальные продукты, в частности ЛПС; компоненты комплемента; цитокины (наиболее активен гамма-ИФН); прилипание к различным поверхностям и др. стимулы.
Родоначальников моноцитов/макрофагов является миелоидная стволовая клетка костного мозга, которая трансформируется в монобласт, затем проходит стадию промоноцита и, дозревая до моноцита, поступает в кровоток. Моноциты циркулируют в кровотоке от 1 до 3 дней, а затем мигрируют в различные органы и ткани, где становятся макрофагами. Средняя продолжительность жизни моноцитов/макрофагов составляет от 20 суток до 7 месяцев.
Таким образом развитие моноцитов/макрофагов проходит в 3 стадии: костный мозг - кровь - ткани.
Моноцитопоэз стимулируют моноцитарный колониестимулирующий фактор (КСФ-М) и катехоламины через а-адренорецепторы КОК-ГМ. Моноцитопоэз тормозят простагландины Е, а- и (3-интерфероны. Продукцию КСФ-М ослабляет также лактоферрин нейтрофилов. Выходу моноцитов из костного мозга в кровь препятствуют большие дозы гидрокортизона. Превращение моноцитов в макрофаги происходит в тканях под влиянием местных факторов микроокружения. Процесс трансформации моноцитов в макрофаги сопровождается морфологическими, биохимическими и функциональными изменениями. Они увеличиваются в размерах, усложняется организация внутриклеточных органелл; увеличивается количество лизосомальных ферментов.
Виды макрофагов:
1. Альвеолярные макрофаги
2. Купферовские клетки (в печени)
3. Гистиоциты - встречаются во всех органах. Это – клетки соединительной ткани: волокон, образующих строму большинства структур тела. Иногда гистиоциты превращаются в «настоящие» макрофаги.
4. Селезеночные макрофаги
5. Дендритные клетки – макрофаги, находящиеся под слизистыми оболочками и в коже, на границе с внешней средой.
6. Перитонеальные макрофаги – фагоциты, «живущие» в брюшине.
7. Макрофаги лимфатических узлов
3) Процессинг и презентация антигенов Т-хелперами
Дендритные клетки (DC) фагоцитируют внеклеточные патогены, такие как бактерии, грибки, паразиты или токсины, после чего мигрируют в лимфатическую систему. Во время миграции DC подвергаются созреванию, теряют способность к фагоцитозу и вступают во взаимодействие с Т-лимфоцитами. Созревание стимулируют присутствующие в лимфе молекулы, опознающие паттерн, ассоциированный с патогенами, которые связывают клеточные рецепторы опознавания паттерна, такие как Толл-подобные рецепторы.
В своих лизосомах DC процессируют фагоцитированные патогены, белки которых также расщепляются до мелких пептидов. Оказавшись в лимфатическом узле, DC представляют эти пептиды на поверхности клетки в контексте молекул MHC класса II. Их опознают обычно Т-лимфоциты-хелперы, называемые также CD4+ или TH, которые играют важную роль в индукции адаптивного иммунного ответа.
По сравнению с MHC класса I, экспрессия молекул MHC класса II существенно ограничена и характерна только для дендритных клеток, активированных макрофагов, В-лимфоцитов и некоторых других типов клеток, которые активируются в условиях воспалительного процесса

4)Процессинг и презентация антигенов Т- киллерами

Процессинг антигена заключается в его расщеплении на пептидные фрагменты.
5) Взаимодействие АПК с Т-лимфоцитом. Механизм распознования антигена
писать то,что обведено красным.



6)Цитокины. Определение и классификация, основные свойства цитокинов.
К цитокинам относятся разнообразные белки с молекулярной массой 15-40 кДа, которые синтезируются различными клетками в организме. Цитокины – это молекулы, обеспечивающие взаимодействие клеток иммунной системы, эндотелия сосудов, нервной системы, печени. В настоящее время известно более 200 цитокинов.
Одинаковые цитокины могут синтезироваться клетками разных типов – иммунной системы, селезенки, тимуса, соединительной ткани. С другой стороны, конкретная клетка способна образовывать множество различных цитокинов. Наибольшее разнообразие цитокинов образуется лимфоцитами, благодаря этому происходит взаимодействие лимфоцитарного иммунитета с другими иммунными механизмами и с организмом в целом.
Существенной особенностью цитокинов, в отличие от гормонов и других сигнальных молекул, является одинаковый, разный или даже противоположный результат их воздействия для разных клеток. Т.е. конечный результат воздействия цитокина зависит не от его типа, а от внутренней программы клетки-мишени, от ее индивидуальных задач!
Функции цитокинов:
Роль цитокинов в регуляции функций организма может быть разделена на 4 основные составляющие:
1. Регуляция эмбриогенеза, закладки и развития органов, в том числе органов иммунной системы.
2. Регуляция процессов роста тканей:
3. Регуляция отдельных физиологических функций:
обеспечение функциональной активности клеток,
согласованность реакций эндокринной, иммунной и нервной систем,
поддержание гомеостаза (динамического постоянства) организма.
4. Регуляция защитных реакций организма на местном и системном уровне:
изменение продолжительности и интенсивности иммунных реакций (противоопухолевая и противовирусная защита организма),
● модулирование воспалительных реакций,
● участие в развитии аутоиммунных реакций.
● стимуляция или подавление роста клеток,
● участие в процессе кроветворения.
●
●
● •••Все цитокины характеризуются общими свойствами:
● в основном аутокринное и паракринное действие,
● каскадность действия,
● отсутствие в крови в норме,
● синтез только «по требованию»,
● специфичность,
● плейотропность,
● чрезмерность,
● синергизм или антагонизм эффектов.
● Действие на клетки
● Действие цитокинов может быть:
● аутокринное – цитокин связывается с рецептором внутри клетки или секретируется и связывается с рецептором на клеточной мембране (например, IL-1, IL-6, IL-18, TNFα),
● паракринное – цитокин воздействует на соседние клетки (например, IL-1, IL-6, IL-12, IL-18, TNFα),
● эндокринное (системное) – для большинства цитокинов отсутствует. Только четыре цитокина (TNF-α, IL-1, IL-6, M-CSF) способны переносить сигнал в отдаленные клетки, но только при системных патологиях.
●
● Каскадность действия
● Секретированный цитокин оказывает влияние на клетку-мишень через высокоаффинный рецептор, находящийся на клетках. Клетка-мишень, в свою очередь, может вырабатывать новые цитокины, такой же или другие, передающие сигнал дальше. Таким образом, цитокиновая система – это система каскадного, умножительного, действия.
● Синтез по требованию
● Цитокины не синтезируются впрок, не запасаются в виде преформированных молекул. Образование и выделение их происходит только в ответ на активирующий стимул и синтез новых молекул ограничивается быстрым разрушением мРНК. Срок жизни цитокинов небольшой – они быстро инактивируются, связываясь с аутоантителами или со свободными (растворимыми) рецепторами к ним. Также цитокины быстро выводятся из кровотока печенью и почками.
● Растворимый рецептор – это отщепленный мембранным ферментом внеклеточный домен любого мембранного рецептора. Растворимые рецепторы сохраняют высокую аффинность в отношении своих лигандов и, в данном случае, способны связывать цитокины, препятствуя их доступу к работающим мембранным рецепторам. Они могут выполнять функции конкурирующих антагонистов, а также участвовать в транспорте, доставке цитокинов в очаг поражения и выведении их из организма. Растворимые рецепторы можно обнаружить в сыворотке крови и в моче.
● Чрезмерность действия
● На одну клетку могут воздействовать несколько разных цитокинов, порознь или одновременно, при этом зачастую конечный результат принципиально не отличается. Такое явление получило название чрезмерность (избыточность), т.е. действие одних цитокинов перекрывается или частично дублируется другими. Чрезмерность может быть показана на примере усиления пролиферации В-лимфоцитов под действием IL-2, IL-4, IL-5, секретируемых разными типами Т-хелперов.
●
● Плейотропность действия
● В то же время один и тот же цитокин способен действовать на гистологически разные типы клеток, имеющих к нему рецепторы, и индуцировать одну или разную функциональную активность клеток-мишеней, т.е. цитокины проявляют плейотропность.
● Примером плейотропности может служить влияние IL-6 на разные типы клеток, где он подавляет выработку IL-1 и TNFα, стимулируя в то же время продукцию гемопоэтических факторов — M-CSF, G-CSF, GM-CSF. Также примером может служить действие IL-4, который способствует не только дифференцировке «наивных» Т-хелперов, но одновременно действует и на В-клетки, способствуя их пролиферации и дифференцировке в плазматические клетки.
●
● Синергизм эффектов
● В результате своего воздействия на клетку цитокины могут усиливать действие других цитокинов, т.е. проявлять синергизм. Например, лимфотоксин-α (также называемый TNFβ) из гемопоэтических клеток, макрофагальный TNFα и лимфоцитарный IFNγ стимулируют на многих типах клеток повышенную экспрессию антигенов гистосовместимости класса I (MHC-I, major histocompatibility complex). Их совместное действие превышает тот эффект, который индуцирует каждый из цитокинов, действующий по отдельности.
● Синергизм влияние цитокинов
●
● Антагонизм эффектов
● Также цитокины могут проявлять антагонизм, если один из цитокинов тормозит продукцию или эффекты других цитокинов. Так, IL-10, секретируемый T-хелперами-2, хоть и не напрямую, но подавляет выработку IFNγ Т-хелперами-1 и NK-клетками. В результате подавляются все функции макрофагов, стимулируемые IFNγ.
7)Понятие о системе цитокинов. Основные клетки продуцент цитокинов.

1. Основные продуценты цитокинов в реакциях врожденного иммунитета - клетки миелоидного происхождения.
После взаимодействия микроорганизмов или их компонентов с распознающими рецепторами врожденного иммунитета (паттерн-распознающими рецепторами, PRR) запускается внутриклеточный сигнальный каскад, приводящий к экспрессии генов двух основных групп цитокинов-провоспалительных и интерферонов типа 1.
2. В адаптивном Иммунном ответе основные продуценты цитокинов - это Т-хелперы. Покоящиеся клетки не секретируют цитокины. При распознавании антигена происходит взаимодействие костимулирующих молекул CD28 на Т-лимфоците и CD80/86 - на дендритной клетке, которое передаёт в Т-лимфоциты сигналы, индуцирующие выработку цитокинов, и в первую очередь ИЛ-2. По профилю продуцируемых цитокинов выделяют следующие субпопуляции CD4+ T-лимфоцитов: Th1, Th2, Th17, Tfh, Th9 (продуценты ИЛ-9)
3.

8)Роль цитокинов в иммунном ответе.




9)Цитокины, вырабатываемые активированными Т-хелперами 1 типа. Роль в иммунном ответе.
Табличка с кратким описанием Тх1

Th1-клетки продуцируют IFNγ(интерферон гамма - КЛЮЧЕВОЙ ЦИТОКИН Тх1), IL-2, TNFα(фактор некроза опухолей), TNFβ,
IL-3, GM-CSF(гранулоцитарно-макрофагальный колонии стимул фактор)
IFNγ - ГЛАВНОЕ=активация фагоцитоза и противомикробной активности и подавление Тх2, но есть еще такая табличка
ИЛ 2 - Активация Т-клеток, запуск и поддержание их пролиферации, стимуляция пролиферации NK- и B-клеток
ИЛ 3 - Гемопоэтический фактор роста
TNFα - участвует в формировании всех основных местных, а также некоторых системных проявлений воспаления. Он активирует эндотелиальные клетки, стимулирует ангиогенез, усиливает миграцию и активирует лейкоциты. TNFα в большей степени, чем IL-1, влияет на активацию и пролиферацию лимфоцитов. В комбинации с IFNγ TNFα индуцирует активность NO-синтазы фагоцитов, что значи-
тельно усиливает их бактерицидный потенциал. TNFα стимулирует пролиферацию фибробластов, способствуя заживлению ран.
TNFβ - лимфотоксин (в методе нету)
GM-CSF поддерживает рост как смешанных гранулоцитарно-моноцитарных колоний, так и отдельно колоний гранулоцитов и моноцитов/макрофагов.

10)Цитокины, вырабатываемые активированными Т-хелперами 2 типа. Роль в иммунном ответе.
Это ИЛ-4 (аутокринный фактор роста)
ИЛ-4, 5, 6, 10, 13 (стопудово знать) ИЛ-9, 21, 23, ГМ-КСФ - индуцируют развитие гуморального им. ответа
ИЛ-4 и 10 подавляют функцию Тхелперов1
Роль:
ИЛ-4 - усиление пролиферации и диф-ки В-лимфоцитов, увеличение экспрессии молекул МНС, селекция изотипа IgE и IgG1.Активация эпителиальных и гл.мышечных клеток, альтернативна активация макрофагов
ИЛ-5 - рост и дифференцировка В-клеток, секреция IgA, стимуляция пролиферации эозинофилов, увеличение выживаемости и выброса ими белков острой фазы
ИЛ-6 - дифференцировка В-лимфоцитов и индукция белков острой фазы
ИЛ-9(это Т-клеточный фактор роста)/ИЛ-3 - привлекают и увеличивают выживаемость тучных клеток и базофилов. ИЛ-9 также действует на кроветворные клетки-предшественницы, преактивированные Т- и В-лимфоцитами (нз, зачем написала, просто в методе жирным шрифтом выделено)
ИЛ-10 - угнетение синтеза цитокинов
ИЛ-13 - рост и дифференцировка В-клеток, подавление продукции ПРОвоспалительных цитокинов, переключение синтеза АТ на изотипы IgE, IgG4. Активация эпителиальных и гл.мышечных клеток, альтернативна активация макрофагов
ИЛ-21 - индукция реакантов острой фазы
ИЛ-23 в методе не написано))
Гранулоцитарно-макрофагальный колониестимулирующий фактор - активация пролиферации предшественников макрофагов и гранулоцитов

11)Цитокины, вырабатываемые клетками макрофагально-моноцитарный ряда. Роль в развитии воспалительной реакции.
| Цитокины | Молекулы | Функции |
| ИЛ-1, ИЛ-6, ИЛ-8, ФНО-a | развитие локального и системного воспаления | |
| ТФР-B (трансформирующий фактор роста) | модуляция воспаления, репарация | |
| ИФН-а, ИФН-B, ГМ-КСФ, М-КСФ, ИЛ-12, ИЛ-18 и др. Не Я | Противовирусное действие, регуляция гемопоэза, межклеточных и межсистемных взаимодействий | |
| CCL2, CCL3, CCL4, CCL5, CXCL8 | Хемокины |
Интерлейкины (ИЛ) - цитокины, ответственные за межклеточные взаимодействия между лейкоцитами.
ФНОα обусловливает развитие токсического шока, индуцирует острофазные белки и стимулирует ангиогенез. Может индуцировать апоптоз. Способен вызывать геморрагический некроз ряда опухолей.
Интерфероны - гликопротеины, вырабатываемые клетками в ответ на вирусную инфекцию и другие стимулы. Блокируют репликацию вируса в других клетках и участвуют во взаимодействии между клетками иммунной системы. Различают две серологические группы интерферонов: I типа - ИНФ-α и -β и II типа - ИФН-γ. Интерфероны I типа оказывают противовирусные и противоопухолевые эффекты, в то время как интерферон II типа регулирует специфический иммунный ответ и неспецифическую резистентность.
ИНФ-α и ИНФ-β отличаясь по структуре и клеткам-продуцентам, обладают практически одинаковым механизмом действия. Защитное действие ИНФ I типа реализуется посредством ингибирования репликации РНК или ДНК под воздействием олигоаденилатсинтетазы, которую продуцируют интерферон-содержащие клетки. ИНФ I типа, связываясь со здоровыми клетками, защищает их от вирусов. Антивирусное действие ИНФ I типа может обусловливаться и тем, что он способен угнетать клеточную пролиферацию, препятствуя синтезу аминокислот, например триптофана. Этот механизм, а также способность индуцировать програмированную клеточную гибель некоторых опухолей лежат в основе противоопухолевого действия ИФН I типа. Кроме того, ИНФ I типа усиливает литическое действие нормальных киллеров на клетки-мишени, в том числе трансформированные клетки, индуцирует экспрессию антигенов МНС I и, наоборот, подавляет формирование тех же антигенов МНС II.
Гранулоцитарный КСФ (Г-КСФ) - стимулирует деление и дифференцировку стволовые клеток, в некоторой степени усиливает активность нейтрофилов и эозинофилов.
Макрофагальный КСФ (М-КСФ) - Активирует пролиферации предшественников макрофагов в костном мозге.
Гранулоцитарно-макрофагальный КСФ (ГМ-КСФ) - Стимулирует деление и дифференцировку предшественников гранулоцитов и макрофагов, активирует функцию макрофагов и гранулоцитов, пролиферацию Т-клеток. Участвует в стимуляции дифференцировки кроветворных предшестенников Е антигенпрезентирующие дендритные клетки.
ТФР-β - мощный деактивирующий фактор для моноцитов/макрофагов, существенно снижая их цитотоксическую и цитокинпродуцирующую активность, а также экспрессию на их поверхности молекул МНС. В этом отношении он действует синергично с другими макрофагдеактивирующими цитокинами (ИЛ-4, -10 и -13) . ТФР-β относят к преимущественно противовоспалительным цитокинам, благодаря его способности снижать продукцию нитросоединений, реакционноспособных радикалов и провоспалительных цитокинов клетками моноцитарно-макрофагального ряда. Однако в ряде случаев он способен оказывать и провоспалительные эффекты. ТФР-β угнетает апоптоз Thl, а вместе с ИЛ-2 ингибирует апоптоз Th2.
12)Интерфероны, основные клетки-продуценты, основные биологические свойства.
ЧИТАЙ ВЫШЕ 11
+

13)Методы тестирования цитокинов (ИФА, биологическое тестирование).
ИФА
Уровни цитокинов в сыворотке или других биологических жидкостях отражают текущее состояние иммунной системы, т.е. синтез цитокинов клетками организма in vivo. Более целесообразно измерять их уровни в соответствующих тканях или в естественных жидкостях, например в слезе, смывах из полостей, моче, амниотической жидкости, спинномозговой жидкости и т.д.
Проводят с помощью твердофазного ИФА. Чаще всего применяют вариант сендвич-ELISA, заключающийся в следующем: один тип МКАТ (моноклональные антитела) к определенному цитокину иммобилизируется на внутренней поверхности ячеек планшетов для исследования. В лунки планшета вносят исследуемый материал и соответствующие стандарты и контроли. После инкубации и промывки в лунки вносят вторые МКАТ к другому эпитопу данного цитокина, конъюгированные с индикаторным ферментом (пероксидазой хрена). После инкубации и промывки в ячейки вносят субстрат-перекись водорода с хромогеном. В процессе ферментативной реакции изменяется интенсивность окраски лунок, которую измеряют на автоматическом фотометре для планшетов.
(Ещё тут можно сказать:
Плюсы метода:
- ИФА с применением МКАТ против отдельных эпитопов в молекуле цитокинов отличается высокой чувствительностью и специфичностью
- объективный автоматизированный учет результатов.
Минусы метода:
1)обнаружение присутствия молекул цитокинов еще не является показателем их биологической активности,
2)возможность ложноположительных результатов из-за перекрестно реагирующих антигенных эпитопов,
3)использование ИФА не дает возможности определения цитокинов в составе иммунных комплексов.)
Биологическое тестирование

14)Основные виды клеточной цитотоксичности.

15)Цитотоксические лимфоциты, характеристика, функции.
Цитотоксические Т-лимфоциты, или цитотоксические T-клетки (cytotoxic T-lymphocyte, Тс; T-киллеры (от англ, to kill - убивать)): Т-лимфоциты, ответственные за разрушение специфических чужеродных клеток, несущих маркеры (сигналы) для разрушения иммунной системой. Могут разрушать раковые клетки (неэффективно) и клетки, инфицированные различными патогенами, в том числе вирусами. Цитотоксические Т-лимфоциты разрушают чужеродные клетки, непосредственно контактируя с ними.
Основные характеристики клеточного и гуморального звеньев иммунитета представлены в табл. 1.2. Клеточный иммунитет опосредован цитотоксическими Т-лимфоцитами и Т-хелперами. Многие микроорганизмы живут внутри клеток в недосягаемости для гуморальных антител. Чтобы справиться с внутриклеточными паразитами, возникла обособленная система приобретенного имунитета , основанная на функционировании отдельной субпопуляции лимфоцитов, а именно, цитотоксических T-лимфоцитов ( T-киллеров ). Эти клетки отличаются очень широкой специфичностью. Поскольку T-лимфоциты должны взаимодействовать с содержащими паразитов клетками, они могут узнать антиген только в том случае, если он экспрессирован на поверхности инфицированной клетки. Как и B-лимфоциты , каждая T-клетка имеет специфический рецептор, который распознает этот антиген. ( Рецептор T-лимфоцита структурно отличается от молекулы мембраного иммуноглобулина - рецептора В-лимфоцитов). При этом T-лимфоциты узнают антиген на поверхности клетки в комплексе с клеточным маркером: молекулами MHC класса I ( рис. 2.16 : "Уничтожение инфицированных вирусом клеток. Помимо механизма действия цитотоксических T-лимфоцитов показан механизм действия NK ). В процессе распознавания поверхностного антигена цитотоксический T-лимфоцит вступает в теснейший контакт со своей мишенью и уничтожает ее до начала репликации. Кроме того, он продуцирует гамма-интерферон, который ограничивает проникновение вируса в соседние клетки, особенно в тех случаях, когда вирус является слабым индуктором альфа-интерферона и бета-интерферона ( рис. 2.18 : черными квадратами обозначены молекулы MHC).
Цитотоксические T-лимфоциты относятся к субпопуляции T8 (или Ly2 ) и представляют популяцию T-эффекторов и играют важнейшую роль в уничтожении клеток, зараженных вирусами, бактериями, а возможно, участвуют и в предполагаемом надзоре за появлением опухолевых клеток .
Большинство цитотоксических T-клеток (Tц) относится к субпопуляции CD8+ и распознает антиген, презентированный в ассоциации с молекулами MHC класса I , но меньшая их часть (примерно 10%), относящаяся к субпопуляции CD4+ , способна распознавать антиген в ассоциации с молекулами MHC класса II .
Для активации и поражения мишени Tц обладают несколькими механизмами воздействия. Один из них - это передача сигналов при непосредственном клеточном контакте через поверхностные структуры, другой - непрямая сигнализация с помощью цитокинов . Кроме того в цитоплазме многих цитотоксических клеток обнаружены гранулы с белками, высвобождение которых вблизи цитоплазматической мембраны клетки-мишени вызывает ее повреждение.
Цитотоксические T-лимфоциты развиваются из предшественников. Предшественники цитотоксических клеток активируются комплексом антигена и молекул MHC класса I , размножаются и созревают под действием IL-2 , а также еще плохо идентифицированных факторов дифференцировки , продуцируемых T-хелперами .
16)Характеристика естественных киллеров, основные маркеры, рецепторы, функции.
Основные маркеры - CD56 и CD16 
Большие гранулярные лимфоцитоподобные клетки с азурофильными гранулы (перфорин, гранзимы, гранулизины). Обладают противовирусной и противоопухолевой активностью. Распознать и уничтожить клетки-мишени им позволяет рецепторы (внимательно посмотрите, они есть на слайде). Неиммунный цитолиз за счет:
1.перфорин-гранзимовый механизм
2.Fas-опосредованный апоптоз


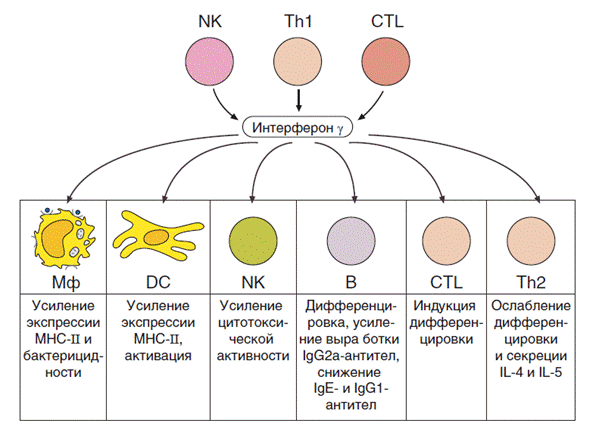
17)Роль цитокинов в клеточной цитотоксичности.
Клеточная цитотоксичность — важный механизм защиты против внутриклеточно локализованных возбудителей, таких как вирусы, некоторые бактерии и простейшие. Цитотоксическую активность могут проявлять несколько типов клеток — цитотоксические Т-клетки (Тц), нормальные киллерные клетки (НК) и иногда клетки миелоидного ряда, причем механизмы распознавания мишеней у них различные.
Основные цитокины клеточной цитотоксичности – ИФН-гамма.Интерферон повышает синтез молекул главного комплекса гистосовместимости I и II классов и активирует иммунопротеасому. Высокий уровень молекул главного комплекса гистосовместимости I класса обеспечивает эффективную презентацию вирусных пептидов цитотоксическимТ-лимфоцитами натуральным киллерам, а иммунопротеасома осуществляет процессинг вирусных пептидов, предшествующий презентации. Высокий уровень молекул главного комплекса гистосовместимости II класса обеспечивает презентацию вирусных антигеновТ-хелперам.Т-хелперы,в свою очередь, выделяют цитокины, которые координируют активность других клеток иммунной системы.Интерферон-гаммаможет прямо стимулировать клетки иммунной системы, такие как макрофаги и натуральные киллеры.
Также ИЛ-2участвует в дифференцировкеТ-киллеров,которые участвуют в реакциях клеточной цитотоксичности.
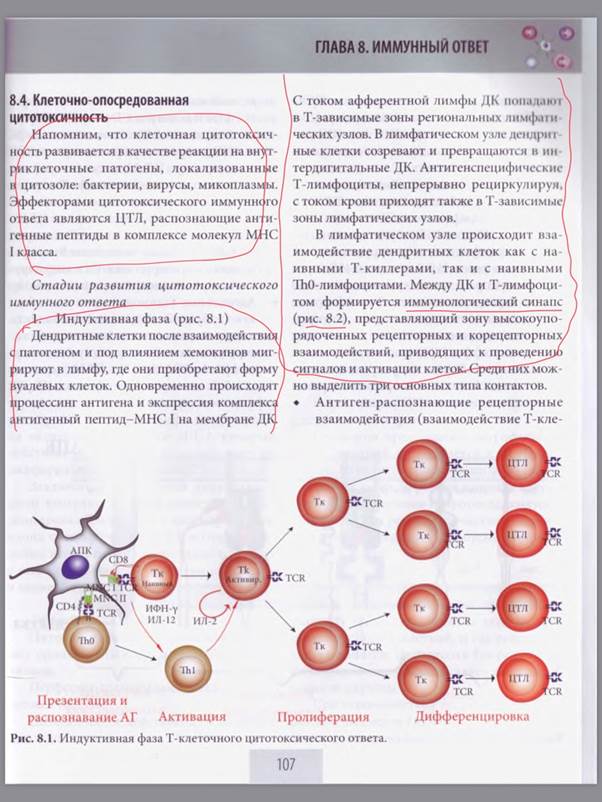
18)Основные этапы иммунного ответа.
Фазы иммунного ответа
Развитие иммунного ответа включает 2 фазы :
1 ) индуктивную : реализуется в течение 5-7 суток после попадания антигена в организм ; заключается в формиро - вании эффекторных лимфоцитарных клеток и клеток памяти . В индуктивную фазу происходят следующие процессы :
> переработка и презентация антиге на антигенпрезентирующей клеткой (AПК); >распознавание антигена при взаимодействии АПК и Т - лимфоцита ;
>активация и пролиферация специфического клона лимфоцитов ;
>дифференцировка лимфоцитов , на- правленная на формирование эффекторных клеток и клеток памяти ;
2)эффекторную : длится в среднем около двух недель ; заключается в реализации клеточной и гуморальной иммунной защиты , т.е. удалении агента , вызвавшего реакцию , и формировании иммунологической памяти .
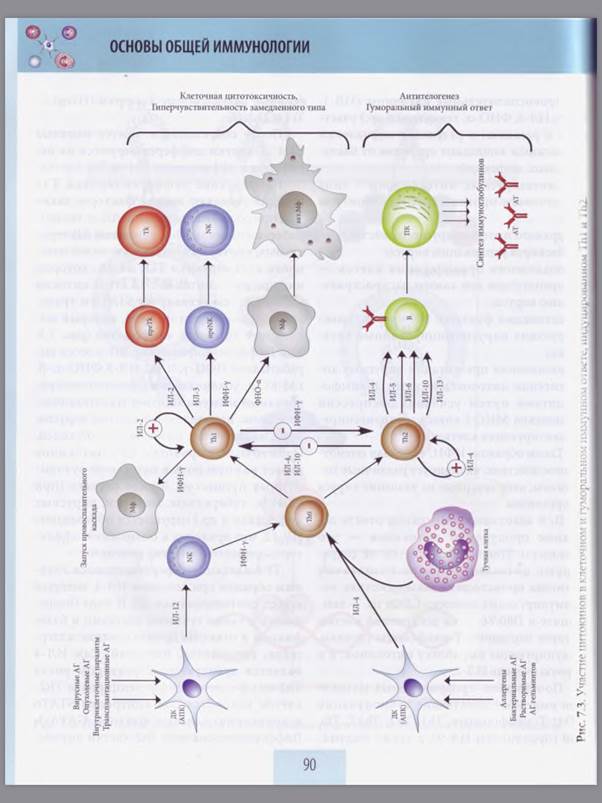
19)Основные клеточные элементы иммунной реакции при развитии иммунного ответа по гуморальному типу.
Гуморальный иммунный ответ защищает преимущественно против внеклеточно паразитирующих микроорганизмов, которые доступны действию специфических антител. Продуцентами антител (иммуноглобулинов) являются потомки активированных В-лимфоцитов — плазматические клетки. В-лимфоцит получает сигнал активации при соединении его антиген-распознающего рецептора с антигеном. Для активной пролиферации и дифференцировки в плазматические клетки потомки В-лимфоцита получают дополнительные сигналы активации — продуцируемые Th2 цитокины: интерлейкины-4, -5, -6, -10, -13. Те же цитокины усиливают продукцию и секрецию специфических для данного антигена антител зрелыми плазматическими клетками.
Данный ответ регулируется Т-хелперами типа 2 (Th2) и заканчивается образованием плазматических клеток (продуцентов антител) и В-лимфоцитов памяти. Переключение на синтез некоторых изотипов антител частично контролируется Th1. За исключением скрытого индуктивного периода иммунный ответ в среднем продолжается около трех недель с максимальным напряжением на 1-й неделе.
При иммунном ответе гуморального типа:
1. Простая нейтрализация антигена антителами при образовании иммунных комплексов «антиген + антитело» (АГ+АТ).
2. Комплементзависимый лизис антигена, связанного с антителом. Иммунные комплексы АГ+АТ, фиксированные на поверхности клеток-мишеней, присоединяют и активируют комплемент по классическому пути.
3. Фагоцитоз растворимых иммунных комплексов АГ+АТ с последующим их расщеплением в лизосомах фагоцитов.
4. Антителозависимая клеточная цитотоксичность (АЗКЦ). Реализуется путем разрушения клетками-киллерами (К-клетками) покрытых антителами (IgG) клеток-мишеней через присоединение к Fc-фрагменту IgG. Такими К-киллерами могут быть гранулоциты, макрофаги, тромбоциты, NK-клетки (натуральные киллеры).
20)Клеточные элементы иммунной реакции при развитии иммунного ответа по клеточному типу.
Клеточный иммунный ответ формируется преимущественно на внутриклеточные патогены, вирусные, опухолевые, трансплантационные антигены. В зависимости от патогена делится на
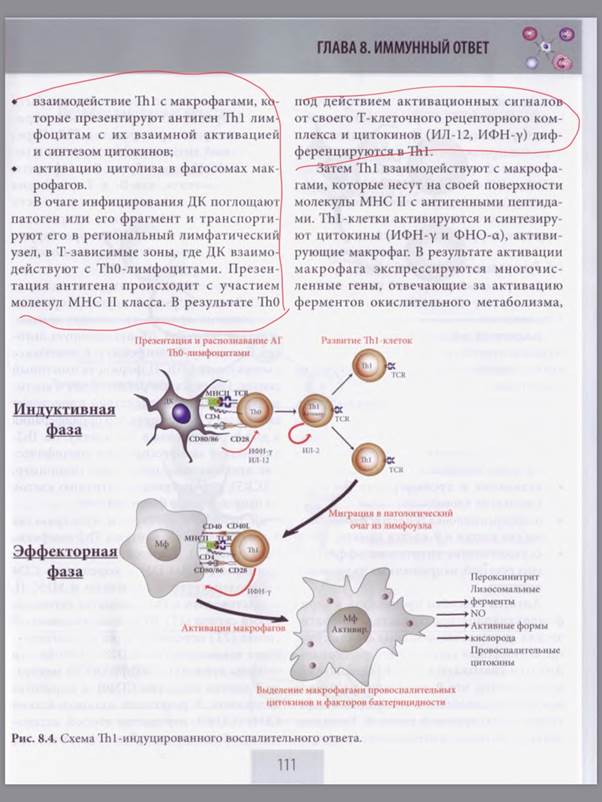
-Клеточно-опосредованную цитотоксичность - эффекторы ЦТЛ, участвуют также ДК и Тх1. ЦТЛ осуществляют перфорин-гранзимовый механизм, цитокиновый механизм, FAS-опосредованный цитолиз. На патогены в цитозоле - чаще это вирусы, ну и одноклеточные (лямблии, трихомонады
-Тх1-опосредованный воспалительный ответ участвуют ДК, Тх1, макрофаги в роли и АПК, и эффекторов. Вообще в его основе - взаимодействие Тх1 с макрофагами и последующей активацией их бактерицидности. Механизмы: провоспалительные цитокины и факторы бактерицидности, вырабатываемые макрофагами. На патогены в гранулах, эндосомах - чаще это простейшие(лейшмании, хламидии), риккетсии и различные микобактерии
21)Реакция ГЗТ, основные клеточные элементы, их роль в развитии реакции.
ГЗТ= Гиперчувствительность 4ого типа
Ведет к воспалению и повреждению тканей из-за действия собственной иммуной системы, а именно Т-клеток: Тх1 и Тх17 (НАПРАВЛЕНА НА ОГРАНИЧЕНИЕ ОЧАГА ВОСПАЛЕНИЯ, те чтоб болела только шишка на голове, а не вся голова-не пишите так, это для запоминания ^_^)
Называется замедленной, тк проявляется лишь через 48-72 часа с момента попадания в организм патогена.
Дата добавления: 2019-07-15; просмотров: 1191; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
