Физико-химические характеристики, токсикокинетика и метаболизм анализируемого вещества.
Токсическое вещество – соли нитритов.
Физические свойства токсиканта:
Нитрит натрия - это бесцветные или слегка желтоватые кристаллы, имеют соленый вкус, похожий на вкус хлорида натрия, хорошо растворимы в воде.
Нитрит натрия используется в химической промышленности при производстве красителей, фотоэмульсий, иногда в строительстве как антифриз для бетона в зимнее время, в резинотехнической, текстильной и металлообрабатывающей промышленности. Как консерванты пищевых продуктов нитриты в настоящее время не применяются.
Пути введения токсиканта – пероральный.
Уровни повреждения (молекулярный, биохимический, клеточный, тканевой, организменный): молекулярный, биохимический, клеточный, тканевой, организменный (отравление не привело к смерти).
Метаболизм анализируемого вещества – токсиканта (соль натрия нитрита).
Нитриты относятся к токсичным соединениям. Они быстро всасываются из ЖКТ. Отравления нитритами и нитратами могут быть производственными и бытовыми. Нитраты вызывают отек легких, кашель, рвоту, острую сердечно-сосудистую недостаточность. Смертельная доза нитратов находится в пределах 8-15 г. Установлено, что в организме нитраты могут восстанавливаться до нитритов. Нитриты вызывают головную боль, рвоту, угнетают дыхание, действуют на сосудистые стенки и угнетают сосудодвигательный центр. При отравлении нитритами в крови образуется метгемоглобин, повреждаются мембраны эритроцитов. Возможно образование из нитритов нитрозоаминов и аминов непосредственно в ЖКТ. При отравлении характерна сине-черная окраска губ, носа, ушных раковин, ногтей, кровь приобретает шоколадный цвет.
|
|
|
Стадии подготовки и составления схемы изолирования.
Изолирование минеральных кислот, едких щелочей и солей проводят путем настаивания объекта с водой. Для очистки полученных извлечений используют диализ.
Подготовка объекта к изолированию.
Рвотные массы гомогенизируют до состояния однородной кашицы, разбавляют водой очищенной.
Предварительное исследование объекта:
Каплю рвотных масс добавляют к раствору дифениламина в концентрированной серной кислоте. При наличии нитритов смесь окрашивается в синий цвет.
Изолирование.
Для выделения нитритов из биологического материала применяют метод настаивания исследуемых объектов с водой, который используется для выделения минеральных кислот и щелочей.
Для изолирования к подготовленному биологическому объекту добавляют очищенную воду до получения кашицеобразной массы, которую оставляют на 1-2 ч, а затем фильтруют.
Водные вытяжки, полученные при настаивании биологического материала с водой, фильтруют. Полученные фильтраты подвергают диализу. Диализ объекта проводят 2-3 раза по 4-6 часов. Полученные диализаты выпаривают на водяной бане до объёма 5-10 мл. Диализаты доводят до нейтральной реакции, а затем определяют наличие нитритов при помощи реакций с диазо-тированной сульфаниловой кислотой и с реактивом Грисса и др.
|
|
|
С помощью указанных реакций могут быть обнаружены эндогенные нитриты. Поэтому используют дополнительную перегонку диализата после подкисления уксусной кислотой. Дистиллят должен давать те же реакции на нитриты. Методика не позволяет обнаружить следовые количества естественно содержащихся нитритов.
Качественное обнаружение токсиканта.
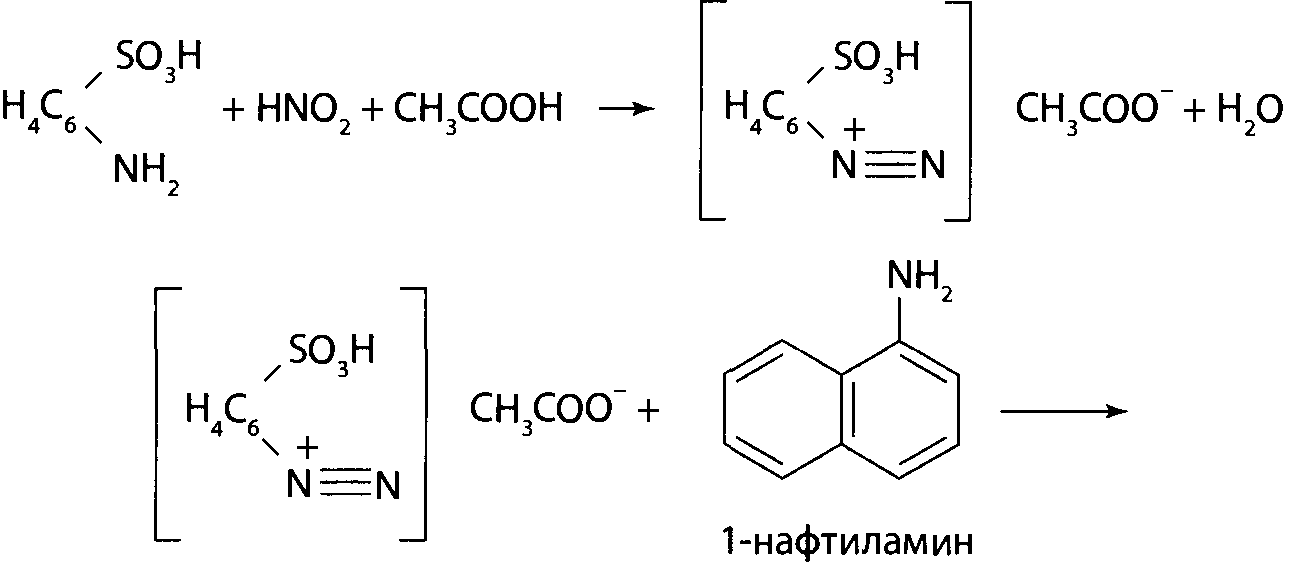
Реакция с сульфаниловой кислотой и β-нафтолом. В углубление на предметном стекле помещают 2 капли предварительно нейтрализованного диализата, прибавляют 2-3 капли 0,5% раствора сульфаниловой кислоты в 2% растворе хлороводородной кислоты. Через 3-5 мин к смеси прибавляют 1 каплю щелочного раствора β-нафтола - появляется интенсивная оранжево-красная окраска.
После подкисления диализатов, содержащих нитриты, выделяется азотистая кислота HNO2, которая с сульфаниловой кислотой (I) или с другими первичными ароматическими аминами образует соль диазония (II):
|
|
|

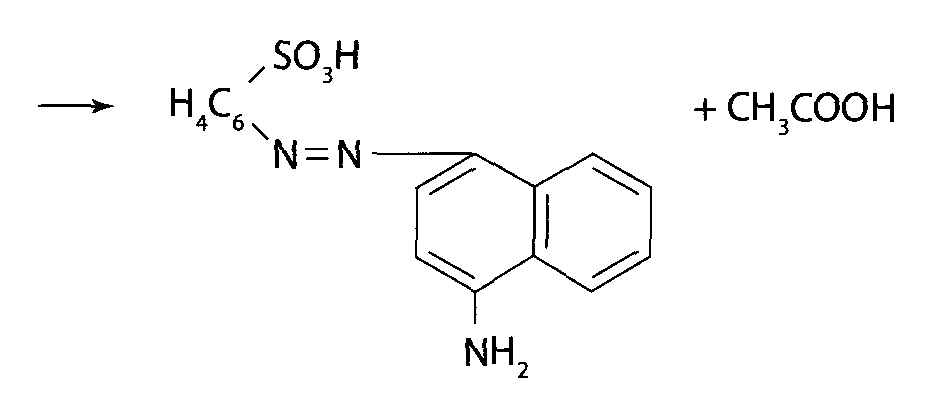
При сочетании полученной соли диазония с β-нафтолом (III) в щелочной среде образуется азокраситель (IV):

Сочетание солей диазония с фенолами и аминами происходит в параположении по отношению к фенольным или аминным группам. Если параположение занято, то сочетание происходит в орто-положении.
Реакция с реактивом Грисса (смесь сульфаниловой кислоты и 1-нафтиламина).
В углубление предметного стекла вносят несколько капель нейтрализованного уксусной кислотой диализата и прибавляют 3-4 капли реактива Грисса. Через несколько минут появляется интенсивная красная окраска.
Реакция с феназоном. К части диализата добавляют 10% раствор серной кислоты и несколько капель 1% раствора феназона - наблюдают появление зеленого окрашивания.
Обесцвечивание раствора перманганата калия:
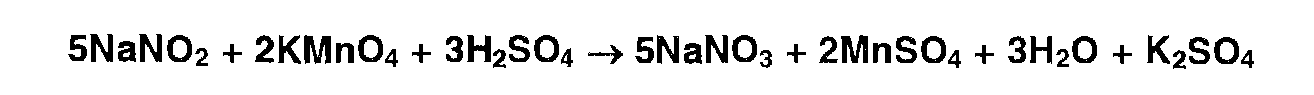
Обнаружение нитритов с помощью иод-крахмальной бумажки.
На йод-крахмальную бумажку наносят каплю 1 %-го раствора соляной кислоты и 3-4 капли нейтрализованного дистиллята. При наличии нитритов в дистилляте йод-крахмальная бумажка синеет.
Количественное определение.
Метод капиллярной газовой хроматографии.
|
|
|
Условия газохроматографического разделения: газовый хроматограф c ПИД, колонка капиллярная кварцевая HP-1(ZB-1) с метилсилоксаном, размером 30,0м х 0,32мм. Температура колонки программируемая: 40°С 6 минут, градиент 10град/мин, 100°С, 1 мин., 15 град/мин, 180°С, 3 мин., затем кондиционирование и регенерация колонки 1 мин. при температуре 250°С. Газ-носитель - водород, скорость газа-носителя 6,8 мл/мин., поддувочный газ – азот (гелий). Режим с делением потока, отношение потоков 1:15, температура инжектора -200°С. Детектор - пламенно-ионизационный, 250°С, Расход водорода - 30 мл/мин, воздуха - 300мл/мин. Сигнал регистрировалcя и обрабатывался компьютерной системой. Параллельно вводили стандартную смесь спиртов, и, отдельно, калибровочную смесь этилнитрита (с концентрацией стандартного раствора нитрита натрия 1мг/мл); при этом идентифицированы пики метанола, этанола, н-пропанола, изопропанола, н-бутанола, изобутанола, н-амилового, изоамилового спиртов, этилнитрита. Записанный метод сохраняется в памяти компьютерной системы под определенным названием и может быть вызван в любое время. Исследование на «чистых растворах» показало, что по приведенной методике обнаруживается 3,6 мкг нитрита натрия в пробе (предел обнаружения), предел определения составляет 7,5 мкг.
Дата добавления: 2019-02-26; просмотров: 569; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
