Дефекты кристаллической решетки
Https://poznayka.org/s78360t1.html
МАТЕРИАЛОВЕДЕНИЕ (для всех) –хорошая книга
Типы связей в металлах и неметаллах.
Строение и свойства металлов.
Металлы – это твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, высокой тепло- и электропроводностью.
Твердые вещества по взаимному расположению атомов делятся на аморфные и кристаллические (Рис.1.).
Аморфныминазывают твердые вещества, атомы которых располагаются в пространстве хаотично. К таким веществам относят стекло, смолу, канифоль и др.
Кристаллическими называют твердые вещества, в которых атомы расположены в пространстве в строго определенном порядке.
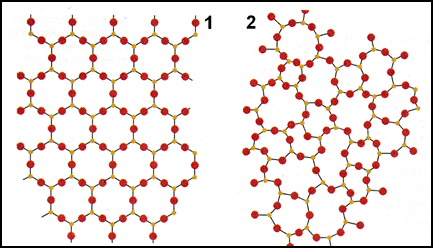
Рис. 1. Строение кристаллического (1) и аморфного (2) вещества.
Типы связей в металлах и неметаллах.
Внутренняя связность вещества – это результат сил взаимодействия между составляющими его частицами, которые могут взаимно притягиваться или отталкиваться.
Возникновение и величина сил взаимодействия между частицами, образующими вещество, зависят от типа их связей.
Различают четыре основных типа связи: 1) ионная, 2) ковалентная,
3) металлическая, 4) межмолекулярная.
Ионная связь возникает между такими атомами, у одного из которых на внешней оболочке содержится мало электронов, а у другого она почти заполнена.
Ковалентная связьвозникает, когда соседние атомы, стремясь заполнить свои внешние оболочки, объединяют требуемые для этого электроны.
|
|
|
Если на внешней оболочке меньше четырех электронов – что типично для металлов,- то все внешние электроны атомов внутри структурной единицы вещества образуют так называемый электронный газ, при этом каждый электрон свободно движется между атомными остовами и не принадлежит ни отдельному атому, ни какой либо малой группе их. Такая связь, называемая металлической, обусловлена взаимодействием между отрицательно заряженным электронным газом и положительно заряженными ионами – остовами атомов. Наличие металлической связи объясняет характерные свойства металлов. Благодаря свободным электронам при пластической деформации связь между ионами не нарушается и разрушения не происходит, что объясняет высокую пластичность металлов. Наличие свободных электронов обуславливает высокую электро- и теплопроводность металлов. С понижением температуры ослабляются тепловые колебания ионов, что повышает электропроводность и в ряде случаев приводит к явлению сверхпроводимости при температурах, близких к абсолютному нулю. Характерный металлический блеск объясняется взаимодействием световых волн со свободными электронами.
|
|
|
Межмолекулярная связьобусловлена силами, которые называют силами Ван-дер-Ваальса. Их природа пока недостаточно ясна.
Основные типы кристаллических решеток.
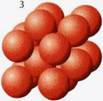
Атомы различных металлов различны, поэтому каждый металл имеет свои определенные свойства. Эти свойства зависят от расположения атомов между собой, характера их связей, от величины расстояния между ними. Металлы различаются не только порядком расположения атомов, но и кристаллической решеткой (Рис. 2.). Кристаллическая решетка представляет собой воображаемую пространственную сетку, состоящую из элементарных ячеек, в узлах которой находятся атомы. Различают следующие кристаллические решетки металлов с плотной упаковкой атомов: кубическую объемно-центрированную, кубическую гранецентрированную и гексагональную (Рис. 3.).
Атомы в кристаллической решетке находятся на определенных расстояниях друг от друга. Расстояние между центрами атомов, находящихся в двух в двух соседних узлах решетки называются параметрами или периодами решетки. Параметры решетки очень малы и измеряются в нанометрах

|

|
|
(1 нм = 10-9м).
Рис. 2. Типы кристаллических решеток металлов в виде шаровых упаковок: 1 – медь, 2 – магний, 3 – железо.
|
|
|
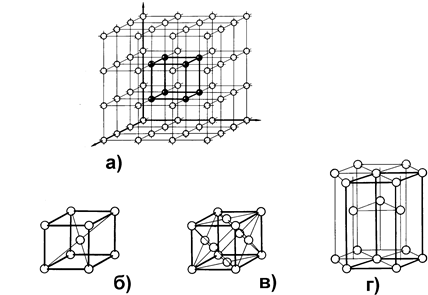
Рис. 3.
а) схематическое изображение простейшей кристаллической решетки кристалла и ее элементарной ячейки.
б) кубическая объемно-центрированная элементарная ячейка
(  -железо, хром, вольфрам, молибден, натрий и др.)
-железо, хром, вольфрам, молибден, натрий и др.)
9 атомов.
в) кубическая гранецентрированная элементарная ячейка (медь, свинец, золото, алюминий и др.) 14 атомов.
г) гексагональная элементарная ячейка (цинк, кадмий) 17 атомов.
Дефекты кристаллической решетки
Реальный металлический кристалл всегда имеет большое количество дефектов кристаллического строения, которые нарушают периодичность расположения атомов в кристаллической решетке. Дефекты оказывают значительное влияние на свойства металла. По геометрическим признакам они подразделяются на точечные, линейные, поверхностные.
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы, а также замещенные атомы примеси и внедренные атомы(Рис.4.).
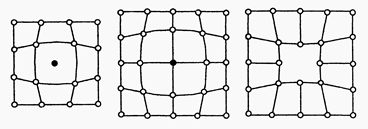
а) б) в)
Рис.4.Схемы точечных дефектов в кристаллах
а) вакансия
б) замещенный атом
в) внедренный атом
|
|
|
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями.
Краевая дислокация (Рис.5.) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости (экстраплоскости).

Рис.5.Схема краевой дислокации
Винтовая дислокация (Рис.6.) является разновидностью линейных дефектов кристаллической решетки. Она формируется и перемещается при сдвиге одной части кристалла относительно другой по какой-нибудь плоскости под действием внешних сдвиговых (касательных) сил Р (перемещение дислокации АВ…А/В/).

Рис.6. Схема винтовой дислокации
Дата добавления: 2019-02-26; просмотров: 348; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
