Так как железо является растворителем, а оксид марганца выделяется в отдельную фазу, то

(4)
Тогда
 (5)
(5)
Химическая активность веществ выражается через их концентрацию:
а = у·х ,
где а - химическая активность;
у - коэффициент химической активности;
х - концентрация, мольные доли.
Расчет показывают, что при малой концентрации веществ раствор можно считать идеальным, в этом случае у = 1, тогда а = х.Учитывая выражения (2) и (3), определим концентрацию марганца в состоянии равновесия:

Концентрация оксида железа в стали определяется составом газовой среды и температурой жидкого металла. В таблице 1 представлены значения X Fe0 в случае контакта жидкого металла с углекислым газом.
Таблица 1 – Концентрация оксида железа в стали при различной температуре
| Т, 0К | 2000 | 2200 | 2400 | 2600 | 2800 | 3000 | 3200 |
| С FeO , % | 0,55 | 1,4 | 2,55 | 4,3 | 6,6 | 8,1 | 4,0 |
Приближенный перевод величины концентрации оксида железа и марганца из мольных долей в проценты можно производить по формулам:
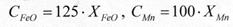
Возможные потери обычно оценивают их относительной величиной:

,
где Сp – равновесная концентрация элемента при его окислении, %;
|
|
|
С0 – исходная концентрация элемента, %.
Анализ приведенных выражений показывает, что с ростом температуры расчетная величина потерь марганца уменьшается. В действительности, как показывают эксперименты, потери марганца с ростом температуры металла увеличиваются. Это связано с тем, что с ростом температуры металла увеличивается испарение марганца. Равновесное давление паров марганца в зависимости от температуры и его концентрации в стали можно рассчитать по следующим выражениям:

Следует отметить, что не весь испарившийся металл теряется, часть его плазменным потоком в дуге переноситься в сварочную ванну. Поэтому определить интенсивность испарения элемента можно только экспериментально. Имеющиеся данные показывают, что скорость испарения металла при сварке определяется током и достигает 25% скорости плавления присадочного материала. Величины скорости испарения различных элементов представлены в таблице 2.
Таблица 2 – Скорость испарения различных элементов
| Элемент | Fe | Си | Sn |
| ап, мг/А·с | 0,0016 | 0,0002 | 0,006 |
2. Варианты заданий по практической работе №4 получить у преподавателя.
|
|
|
Контрольные вопросы
Дата добавления: 2019-02-22; просмотров: 182; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
