Кетонное и кислотное расщепление.
Ацетоуксусный эфир, как эфир β-кетокислоты, расщепляется щелочами по связи С―С:

Разбавленные щелочи вызывают кетонное расщепление эфира (а), концентрированные – кислотное (b).
Различия в направлении расщепления ацетоуксусного эфира и его гомологов определяется особенностями действия разбавленных и концентрированных щелочей. Разбавленные щелочи омыляют эфир до кислоты. Последняя при нагревании декарбоксилируется.
Ацетоуксусный эфир и его алкильные производные при действии концентрированных спиртовых растворов щелочи подвергаются так называемому кислотному расщеплению, приводящему к образованию сложных эфиров замещенных уксусных кислот. Гидролиз образующегося сложного эфира обычно осуществляют в кислой среде:

Декарбоксилирование.
β-Оксокислоты легко подвергаются декарбоксилированию, что обусловлено образованием шестизвенного переходного состояния с низкой энергией. Ацетоуксусная кислота при нагревании выше 1000С декарбоксилируется с образованием ацетона:

Декарбоксилирование является этапом так называемого кетонного расщепления замещенных ацетоуксусных эфиров с целью получения метилкетонов.
3.4. γ- и δ-Оксокислоты
Специфическим свойством γ- и δ-оксикислот является их способность к другому виду таутомерии – кольчато-цепной (цикло-оксо) таутомерии. Возникновение этого вида таутомерии обусловлено тем, что гидроксильная группа как нуклеофил обратимо присоединяется к кетонной группе:
|
|
|

Открытая (ациклическая) форма γ- и δ-оксикислот находится в равновесии с соответствующими гидроксилактонами – соединениями, которые, с одной стороны, можно рассматривать как циклический полуацеталь, а с другой – как сложный эфир. Кольчато-цепная таутомерия более известна для моносахаридов.
Биологическое окисление гидрокси- и оксокарбоновых кислот.
Реакции цикла Кребса.
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г.Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбоновых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива» углеводов, жирных кислот и аминокислот.
Цикл Кребса также называют циклом лимонной кислоты или циклом ди- и трикарбоновых кислот.
|
|
|
Участвующие в цикле ди- и трикарбоновые кислоты находятся в виде анионов, поэтому все реакции цикла Кребса даны для анионных форм.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл состоит из восьми последовательных стадий.
I стадия является реакцией нуклеофильного присоединения (АN) ацетилкофермента А по двойной связи карбонильной группы оксалоацетата. Образующийся цитрилкофермент А легко гидролизуется до цитрата (аниона лимонной кислоты) и кофермента А:

II стадия заключается в изомеризации цитрата в изоцитрат, которая осуществляется за счет двух последовательных реакций: дегидратации исходного цитрата и гидратации образующегося промежуточного продукта:

III а стадия – дегидрирование (окисление) изоцитрата дегидрогеназой с окисленной формой кофермента НАД+ с образованием оксалосукцината:

III б стадия – декарбоксилирование оксалоацетата в 2 оксоглутарат в результате внутримолекулярной дисмутации:

IV стадия является реакцией окислителного декарбоксилирования, происходящей под действием двух коферментов: НАД+ (окислитель) и HSКоА – и сопровождаемой межмолекулярной дисмутацией. На этом заканчивается этап окисления ацетильного остатка ацетилкофермета до СО2 и Н2О:
|
|
|

V стадия заключается в гидролизе сукцинилкофермента А. Это – экзэргоническая реакция, с которой сопряжен синтез одной молекулы АТФ:

VI стадия является реакцией дегидрирования сукцината в фумарат дегидрогеназой с окисленной формой кофермента ФАД, сопровождаемой межмолекулярной дисмутацией:

VII стадия заключается в стереоспецифическом присоединении молекулы воды по кратной межуглеродной связи с образованием исключительно L-малата (аниона L-оксоянтарной кислоты). Эта реакция сопровождается внутримолекулярной дисмутацией:

VIII стадия, сопровождаемая межмолекулярной дисмутацией, приводит к регенерации оксалоацетата за счет дегидрирования L-малата дегидрогеназой и окисленной формой кофермента НАД:

Образовавшийся оксалоацетат опять вступает в реакцию (I стадия) с новой молекулой ацетилкофермента А. Таким образом, из 11 реакций цикла Кребса девять сопровождаются окислительно-восстановительной дисмутаций за счет углеродных атомов, причем пять имеет межмолекулярный, а четыре – внутримолекулярный характер.
|
|
|
Как видно, за один оборот цикла, состоящего из восьми стадий, происходит полное окисление одной молекулы ацетил-КоА.
В результате реакций одного цикла Кребса образуется 12 молекул АТФ, из них одна молекула синтезируется в результате экзэргонической реакции стадии V, а остальные – за счет окисления образующихся трех молекул НАД(Н) и одной молекулы ФАД(2Н), которое протекает в электронотранспортной цепи. Всего за счет полного окисления одной молекулы стеариновой кислоты С17Н35СООН, включая реакции её β-окисления и цикла Кребса, в митохондрии синтезируется 146 молекул АТФ, а пальмитиновой кислоты С15Н31СООН – 129 молекул АТФ.
Кратко схема превращения ацетил-КоА и оксалоацетата в цикле Кребса представлена на рисунке.
 Схема превращений в цикле Кребса.
Схема превращений в цикле Кребса.
Работа ферментов цикла Кребса очень надежна, так как не известны патологические состояния, связанные с недостатком активности какого-либо из этих ферментов. Это указывает на важность реакций цикла Кребса для организма и хорошую их защищенность от внешних воздействий.
Эталонное решение задач.
1. Предложите схему синтеза молочной кислоты из 2-хлорпропановой кислоты. Обладает ли полученная кислота оптической активностью? Какой продукт образуется при нагревании молочной кислоты? Напишите схему реакции.
Решение:
Гидроксикислоты получают из галогенкарбоновых кислот в результате обработки их щелочью с последующим взаимодействием образующейся соли гидроксикислоты с кислотой:
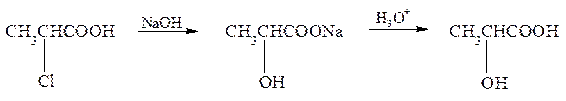
Благодаря наличию в молекуле асимметрического атома углерода она может существовать в виде двух оптически активных энантиомеров:
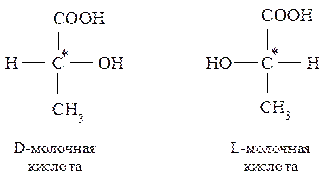
Так как молочная кислота относится к α-гидроксикислотам, то она при нагревании образует устойчивый шестичленный циклический диэфир-лактид:

2. Какое соединение образуется при нагревании 3-гидроксибутановой кислоты? Объясните, почему при нагревании этой кислоты невозможна внутри- и межмолекулярная этерификация?
Решение:
3-гидроксибутановая кислота относится к β-гидроксикислотам, а этим кислотам при нагревании или под действием минеральных кислот характерны реакции дегидратации с образованием α,β-ненасыщенных кислот:

Внутри- или межмолекулярная этерификация в этом случае невозможна, так как она привела бы к образованию неустойчивого четырех- или восьмичленного цикла (лактона и лактида соответственно).
Направленность реакции определяется большей подвижностью атома водорода в α-положении по сравнению с γ-положением.
3. Напишите схему реакций взаимодействия β-гидроксикислоты с гидроксидом натрия, этанолом и аммиаком. Назовите продукты реакции.
Решение:
Наличие в молекуле гидроксикислот карбоксильной и гидроксильной групп приводит к тому, что эти соединения вступают в реакции, свойственные как спиртам, так и кислотам. С гидроксидом натрия, этанолом и аммиаком реакции идут по карбоксильной группе:

4. Приведите схемы реакций взаимодействия молочной (2-гидроксипропановой) кислоты с галогеноводородом и уксусным ангидридом.
Решение:
Вступление в реакцию спиртового и кислотного гидроксила определяется выбором реагента и условиями реакции. С галогенводородом и уксусным ангидридом в реакции участвует спиртовой гидроксил:
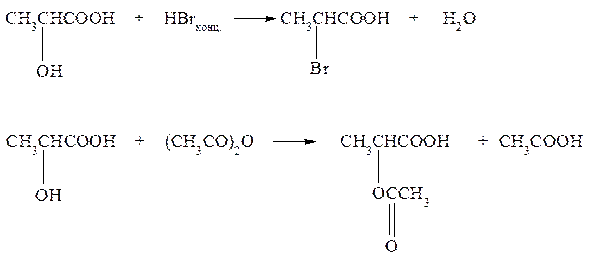
5. Напишите схему реакций взаимодействия α-гидрокислоты с натрием и пентахлоридом фосфора.
Решение:
При взаимодействии щелочных металлов с гидроксикислотами сначала получаются соли, а затем алкоголяты:

При действии пентахлорида фосфора замещается галогеном спиртовой и кислотный гидроксил:

6. Напишите схему расщепления лимонной кислоты под действием концентрированной серной кислоты. Какое карбонильное соединение получается в результате? Напишите схему соответствующей реакции.
Решение:
Нагревание с серной кислотой приводит к расщеплению лимонной кислоты на ацетондикарбоновую и муравьиную кислоты, которые распадаются далее с выделением соответственно диоксида и монооксида углерода:
Процесс распада ацетондикарбоновой кислоты приводит к образованию ацетона
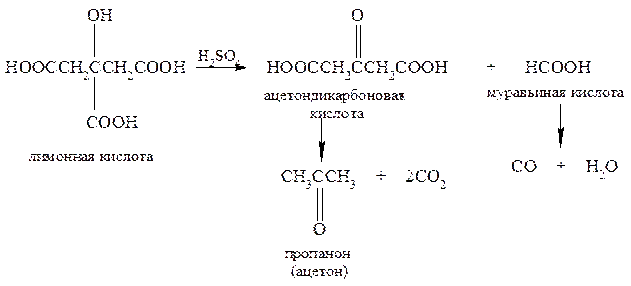
7. Напишите схемы реакций взаимодействия пировиноградной (2-оксопропановой) кислоты с гидроксидом натрия, этанолом и аммиаком.
Решение:
Наличие в молекуле пировиноградной кислоты карбонильной и карбоксильной групп приводит к тому, что в зависимости от реагента и условий реакции, процесс может протекать как по оксо-, так и по карбоксильной группе.
С гидроксидом натрия и этанолом реакция протекает по карбоксильной группе:

С аммиаком реакция протекает одновременно по карбонильной и карбоксильной группам:
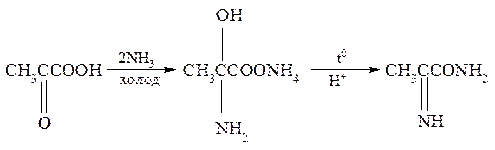
8. Приведите схемы реакций взаимодействия ацетоуксусной (3-оксобутановой) кислоты с гидроксиламином и циановодородной кислотой.
Решение:
Оксокислоты с гидроксиламином и циановодородной кислотой образуют производные по карбонильной группе. Оксогруппе характерны реакции присоединения:

9. Пировиноградная (2-оксопропановая) кислота при добавлении кислот вступает в реакцию альдольной конденсации, а образующийся альдоль легко превращается в лактон. Напишите схемы реакций.
Решение:
Некоторые α-оксокислоты из-за наличия в молекуле СН-кислотного центра вступают в реакции альдольной конденсации. Пировиноградная кислота при длительном стоянии, а ещё быстрее при добавлении кислот, превращается в соответствующий альдоль, который затем отщепляет воду, образуя лактон:

10. Напишите схемы реакций ацетоуксусного эфира с металлическим натрием, бромом, синильной кислотой, фенилгидразином.
Решение:
Ацетоуксусный эфир – пример соединения, способного к кето-енольной таутомерии. Обе формы эфира могут быть получены в свободном состоянии: кетонная – вымораживанием, енольная – перегонкой в кварцевой посуде.
В химических превращениях ацетоуксусный эфир в зависимости от реагента ведет себя как кетон или как енол.
Реакции отвечающие кетонной форме:
1) присоединение синильной кислоты:

2) действие фенилгидразина: продукт реакции теряет молекулу спирта и образует метилпиразолон:

Реакции, отвечающие енольной форме:
1) образование натрийацетоуксусного эфира:

2) присоединение брома:

Эту реакцию используют для количественного определения содержания енольной формы в равновесной смеси.
3) действие пентахлорида фосфора:

Дата добавления: 2019-02-12; просмотров: 443; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
