Образование непредельных кислот.
β-гидроксикислоты теряют воду и дают непредельные кислоты. Такое направление дегидратации связано с повышенной подвижностью водородных атомов в соседстве с карбоксильной группой, обусловленной устойчивостью (благодаря сопряжению) соответствующего аниона:

Образование лактонов.
При нагревании в кислой среде, а иногда просто при стоянии в растворе, γ- и δ- гидроксикислоты подвергаются внутримолекулярной этерификации с образованием пяти- и шестичленных лактонов, например:

Лактонами называются внутренние сложные эфиры гидрксикислот, т.е. соединения, в которых сложноэфирная группировка ― С(О)О― включена в циклическую структуру.
Легкость лактонизации γ- и δ-гидроксикислот объясняется повышенной термодинамической устойчивостью пяти- и шестичленных циклических соединений. Циклы меньшего или большего размера в этих условиях не образуются.
По номенклатуре ИЮПАК лактоны, образованные из алифатических кислот, называют, добавляя суффикс –олид к названию углеводорода с тем же числом атомов углерода. Цифрой указывают место замыкания цикла, начиная нумерацию от карбонильного атома углерода. Так, приведенный выше, γ-бутиролактон имеет систематическое название 4-бутанолид.
Отдельные представители.
Молочная кислота CH3CH(OH)COOH была впервые обнаружена К.В.Шееле (1780) в прокисшем молоке, отсюда и получила название.
|
|
|
Благодаря наличию в молекуле асимметрического атома углерода молочная кислота может существовать в виде двух оптически активных энантиомеров – D- и L-форм – и оптически неактивной рацемической формы. Последняя представляет собой молочную кислоту брожения. L(+)–Молочная кислота, образуется в мышечной ткани как продукт расщепления и дальнейшего превращения полисахарида гликогена. D(-)–Молочная кислота может быть получена под действием микроорганизмов.
Соли и сложные эфиры молочной кислоты называются лактатами. Важно отметить, что соли и эфиры L(+)-молочной кислоты являются левовращающими, а соли и эфиры D(-)–молочной кислоты – правовращающими.
Яблочная кислота HOOCCH2CH(OH)COOH – представитель гидроксидикарбоновых кислот. Яблочная кислота, как и молочная, существует в виде двух энантиомеров. L(-)–яблочная кислота, содержится в незрелых яблоках, плодах рябины и барбариса.
Лимонная кислота HOOCCH2C(OH)(COOH)CH2COOH, т.пл. 1530С – наиболее распространенная гидрокситрикарбоновая кислота. Она содержится в плодах цитрусовых (в лимонах её 6-8% от сухой массы), некоторых ягодах и фруктах.
Лимонная кислота и её соли (цитраты) широко используются в пищевой промышленности и фармации.
|
|
|
Салициловая кислота о-HOC6H4COOH представляет собой кристаллическое вещество, плохо растворимое в воде. По кислотности (рКа2,98) она превосходит почти все монозамещённые бензойные кислоты, в том числе и с электроноакцепторными заместителями.
Салициловая кислота встречается в растительном мире как в свободном состоянии, так и в связанном виде во многих эфирных маслах.
Салициловая кислота обладает антисептическими свойствами и находит применение как в медицине, так и как консервант некоторых пищевых продуктов. Но ещё более широко используются в медицинской практике производные салициловой кислоты по обеим функциональным группам. Главным образом, это сложные эфиры по карбоксильной группе – метилсалицат и фенилсалицат, имеющий торговое название салол, и по фенольному гидроксилу – ацетилсалициловая кислота, для которой одно из многочисленных торговых названий - аспирин.
Названные производные получают известными способами синтеза сложных эфиров. Так, метилсалицат образуется при этерификации салициловой кислоты метанолом:

салициловая кислота метилсалицилат
Низкая нуклеофильность фенолов не позволяет таким же способом получить фенилсалицилат. Поэтому салициловую кислоту превращают предварительно в более активный ацилирующий агент – хлорангидрид, которым затем ацилируют фенол:
|
|
|
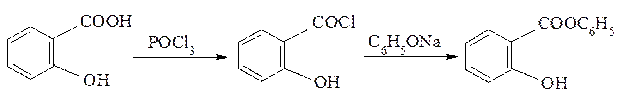
хлорангидрид фенилсалицилат
салициловой кислоты
Гидроксильная группа фенола ацилируется под действием уксусного ангидрида с количественным выходом:

ацитилсалициловая кислота
Салициловая кислота и её производные со свободной гидроксильной группой дают с раствором хлорида железа (III) фиолетовое окрашивание, характерное для фенолов, что используется в качественном анализе.
III . Оксокислоты.
Общая характеристика.
Оксокарбоновыми кислотами (оксокислотами) называются соединения, молекулы которых содержат наряду с карбоксильной группой оксогруппу, т.е. это альдегидо- или кетонокислоты .
Оксокислоты могут содержать одну, две или более карбоксильных групп. По взаимному расположению функциональных групп различают α-, β-, γ-оксокарбоновые кислоты; существуют также оксокислоты и с иным расположением функциональных групп.
Многие оксокислоты являются важными метаболитами, участвующими в обмене веществ. Биологическая роль α-оксокислот заключается в том, что они являются интермедиатами в биосинтезе α-аминокислот в живых организмах.
|
|
|
Названия оксокислот часто связано со способами получения веществ из природных источников. Например, пировиноградная кислота СН3СОСООН называется так по способу ее получения пиролизом виноградной кислоты. Альдегидо- кетокислоты также рассматривают как производные соответствующей жирной кислоты, полученной замещением водорода на ацильный остаток.
1.1. Некоторые биогенные оксокарбоновые кислоты
и их биологическая роль
| Формула | Название кислоты | Название солей и сложных эфиров | Биологическая роль кислоты |
 оксоэтановая
кислота
оксоэтановая
кислота
| Глиокси-ловая | Глиоксила-ты | Это единственная α-альдегидокисло-та. Встречается в недозрелых фрук-тах |
| Продолжение | |||
 2-оксопропановая
кислота
2-оксопропановая
кислота
| Пировино-градная | Пируваты | Важнейший проме-жуточный метабо-лит в живых систе-мах |
 3-оксобутановая
кислота
3-оксобутановая
кислота
| Ацето-уксусная | Ацетоаце-таты | Образуется в орга-низме при β-окис-лении жирных кис-лот; накапливается при сахарном диа-бете |
 оксобутандиовая
кислота оксобутандиовая
кислота
| Щавелево-уксусная | Оксалоаце-таты | Метаболит, участ-вующий в цикле Кребса |
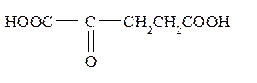 2-оксопентандиовая
кислота 2-оксопентандиовая
кислота
| α-Оксо-глутаровая | α-Оксо-глутараты | Метаболит, участ-вующий в цикле Кребса и в синтезе глутаминовой и γ-аминомасляной кислот |
В названиях альдегидо- и кетонокислот наличие карбонильной группы обозначают префиксом оксо-. Для некоторых оксокислот укоренились тривиальные названия (пировиноградная, левулиновая); для оксокислот, участвующих в биохимических циклах в живых организмах, используются традиционно сложившиеся в биохимической литературе названия – ацетоуксусная, щавелевоуксусная, кетоглутаровая и др.:
Способы получения
2.1. Гидролиз дигалогенозамещённых кислот.
Оксокислоты разных типов могут быть получены гидролизом дигалогенозамещенных кислот.

2.2. Гидролиз α-оксонитрилов.
α-Оксокислоты также получают гидролизом α-оксонитрилов, которые, в свою очередь, синтезируют из ацилгалогенидов и солей циановодородной кислоты:

2.3. Сложноэфирная конденсация.
В качестве основного способа синтеза β-оксокислот используется реакция сложноэфирной конденсации, приводящая к получению эфиров β-оксокислот, гидролизуемых далее в свободные β-оксокислоты:

2.4 Дегидратация и декарбонилирование лимонной кислоты
Частный случай получения β-оксокарбоновых кислот состоит в дегидратации и декарбонилировании лимонной кислоты олеумом на холоду:

2.5 Синтез γ-оксокислот из янтарного ангидрида.
Получение γ-оксокислот. Эти кислоты синтезируют из янтарного ангидрида и магнийорганических соединений, например:

Химические свойства
Оксокарбоновые кислоты сильнее, чем соответствующие гироксикарбоновые кислоты. Поэтому в биосредах организма (рН≈7) они обычно находятся в виде анионов.
Оксокислоты проявляют многие свойства, характерные как для карбоновых кислот, так и для альдегидов и кетонов. Оксокислоты образуют производные по карбоксильной группе – соли, сложные эфиры амиды и т.д., по оксогруппе – оксимы, гидразоны, гидроксинитрилы и т.д.

Химические свойства оксокислот существенно зависят от взаимного расположения функциональных групп. Обе группы оказывают друг на друга определенное влияние. В частности, при близком их расположении наблюдается взаимное усиление электрофильных свойств атомов углерода карбонильной и карбоксильной групп и, как следствие, усиление их реакционной способности при взаимодействии с нуклеофилами.
Кислотные свойства оксокарбоновых кислот снижаются по мере удаления оксогруппы от карбоксильной группы.
3.1. Образование гидратных форм.
α-Оксокислоты, у которых карбонильная группа находится в непосредственном соседстве с электроноакцепторной группой, легко вступают в реакции нуклеофильного присоединения. Например, некоторые α-оксокислоты легко присоединяют воду и образуют устойчивые гидратные формы:

3.2. Декарбоксилирование и декарбонилирование α-оксо-кислот.
Под действием разбавленных минеральных кислот α-оксокислоты подвергаются декарбоксилированию; нагревание с концентрированной серной кислотой приводит к декарбонилированию, т.е. отщеплению оксида углерода (II):

3.3.Кето-енольная таутомерия, β-оксокислот и их сложных эфиров..
β-оксокислоты среди оксокислот имеют наибольшее практическое значение. Специфика их химических свойств обусловлена наличием сильного СН-кислотного центра, возникновение которого связано с β-расположением функциональных групп. Именно в ряду β-оксокислот наиболее ярко проявляется один из видов динамической изомерии – кето-енольная таутомерия.
Дата добавления: 2019-02-12; просмотров: 112; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
