Галагенирование алифатических карбоновых кислот.
Региоселективное α-галогенирование карбоновых кислот достигается в методе Гель-Фольгард-Зелинского. Для введения хлора и брома в α-положение к карбоксильной группе карбоновую кислоту обрабатывают хлором или бромом в присутствии каталитических количеств красного фосфора:

Из образованных α-галогензамещенных кислот с помощью реакций нуклеофильного замещения синтезируют другие гетерофункциональные кислоты.
Реакции нуклеофильного замещения.
Одну из важнейших групп реакций, характерных для карбоновых кислот, составляют реакции нуклеофильного замещения у sp 2-гибридизованного атома углерода карбоксильной группы, в результате которых гидроксильная группа замещается на другой нуклеофил. За счет положительного мезомерного эффекта гидроксильной группы электрофильность атома углерода карбоксильной группы значительно ниже, чем у атома углерода карбонильной группы альдегидов и кетонов, поэтому реакции нуклеофильного замещения в карбоксильной группе проводятся в присутствии кислотного катализатора. Используются также иные приемы, суть которых сводится к превращению плохо уходящей группы НО─ в хорошо уходящую. В результате этих реакций образуются функциональные производные карбоновых кислот – сложные эфиры, амиды, ангидриды, галогенангидриды и др.
Реакции замещения у sp 2-гибридизованного атома углерода карбоксильной группы по своему результату относительно участвующего во взаимодействии нуклеофильного реагента могут рассматриваться как реакции ацилирования, поскольку они сопровождаются введением в молекулу нуклеофильного реагента -ацильной группы R ─ CO ─ . Важнейшие ацильные группы – ацетил СН3СО ─ , бензоил С6Н5СО ─ .
|
|
|
Образование сложных эфиров
При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а сама реакция называется реакцией этерификации:

сложный эфир
В качестве катализаторов используют концентрированную серную кислоту, газообразный хлороводород, сульфоновые кислоты, катионообменные смолы в Н+- форме. В случае сильных карбоновых кислот, таких, как щавелевая, муравьиная, трифтороуксусная, отпадает необходимость добавления минеральной кислоты, так как подобные карбоновые кислоты сами катализируют реакцию:

Реакция этерификации, как и многие другие реакции замещения у тригонального атома углерода, чаще всего протекает по тетраэдрическому механизму.
|
|
|
На стадии катализа протонируется карбонильный атом кислорода карбоновой кислоты; гидроксильная группа не присоединяет протон, потому что неподеленная пара электронов атома кислорода находится в сопряжении с карбонильной группой. Возникший карбокатион (I) обладает значительно более сильными электрофильными свойствами, чем исходная карбоновая кислота, и поэтому может присоединять даже слабый нуклеофил, каким является молекула спирта. В образовавшемся катионе (II) происходит перенос протона к одной из гидроксильных групп, и при этом формируется хорошо уходящая группа – молекула воды. После отщепления воды от катиона (III) и возврата катализатора образуется сложный эфир.

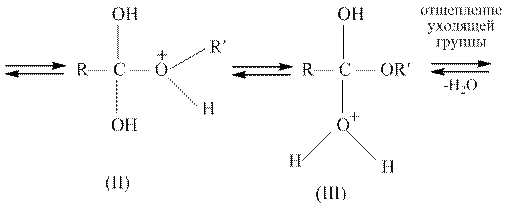
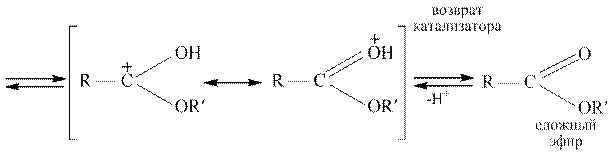
Все стадии реакции этерификации обратимы; обратная реакция представляет собой катализируемый кислотой гидролиз сложных эфиров. При получении сложных эфиров смещение равновесия вправо достигается разными способами: удалением воды азеотропной отгонкой или с помощью осушителей, ибо с применением большого избытка спирта или кислоты, если тот или другой реактив достаточно доступен. Смещение равновесия достигается также путем отгонки образующегося сложного эфира.
Дата добавления: 2019-02-12; просмотров: 105; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
