Восстановление карбоновых кислот.
Государственное образовательное учреждение высшего профессионального образования
«Московский Государственный медико-стоматологический университет» федерального агентства по здравоохранению и социальному развитию российской федерации
Кафедра общей и биоорганической химии
М.И. Антонова, А.С. Берлянд, А.А. Прокопов
БИООРГАНИЧЕСКАЯ химия
Часть IV
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ.
ГИДРОКСИКИСЛОТЫ. ОКСОКИСЛОТЫ
Учебное пособие по биоорганической химии
для самостоятельной работы студентов
стоматологических факультетов медицинских вузов
Москва 2009
Государственное образовательное учреждение высшего профессионального образования
«Московский Государственный медико-стоматологический университет» федерального агентства по здравоохранению и социальному развитию российской федерации
Кафедра общей и биоорганической химии
М.И. Антонова, А.С. Берлянд, А.А. Прокопов
БИООРГАНИЧЕСКАЯ химия
Часть IV
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
ГИДРОКСИКИСЛОТЫ. ОКСОКИСЛОТЫ
Учебное пособие по биоорганической химии
для самостоятельной работы студентов
стоматологических факультетов медицинских вузов
Рекомендуется Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов, обучающихся по специальности 060105(040400) - «Стоматология»
|
|
|
Москва 2009
ББК 24.1 я 73
O-28
УДК 546 (075.8)
Рецензенты:
зав. кафедрой органической химии ММА им. И.В. Сеченова, д. х. н., профессор Н.А. Тюкавкина,
зав. кафедрой фармакологии МГМСУ,
д.м.н., профессор А.Г. Муляр
М.И. Антонова, А.С. Берлянд, А.А. Прокопов. Биоорганическая химия, часть IV. Учебное пособие. М., МГМСУ, 2009, 99с.
Под редакцией профессора А.С. Берлянда
Настоящее учебно-методическое пособие посвящено соединениям, объединенным под общим названием «Карбоновые кислоты и их производные. Гидроксикислоты. Оксокислоты». В пособии изложен теоретический материал, разобран ряд эталонных задач, а также приведены вопросы и задачи для самостоятельной работы студентов. Пособие рекомендуется использовать студентам стоматологических, лечебных и педиатрических факультетов медицинских вузов Российской Федерации для подготовки к занятиям по биооргани-ческой химии.
ББК 24.1 я 73
© МГМСУ, 2009
© М.И. Антонова, А.С. Берлянд, А.А. Прокопов, 2009.
I . Карбоновые кислоты и их производные.
Изомерия и номенклатура.
К классу карбоновых кислот относятся соединения, содержащие карбоксильную группу COOH.
|
|
|
По числу карбоксильных групп в молекуле различают одноосновные и многоосновные кислоты. В зависимости от строения углеводородного радикала, связанного с карбоксильной группой, кислоты подразделяются на алифатические (насыщенные и ненасыщенные), алициклические, ароматические, гетероциклические.
По систематической номенклатуре кислоты называют по соответствующим предельным углеводородам с добавлением окончания -овая кислота, причем нумерация цепи начинается от углерода карбоксильной группы. В тех случаях, когда карбоксильная группа не входит в состав углеводородной цепи, используется сочетание «карбоновая кислота», выполняющее роль суффикса.
Номенклатура ИЮПАК разрешает сохранять для многих кислот их тривиальные названия, указывающие на природный источник, из которого была выделена та или иная кислота

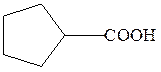
циклопентанкарбоновая кислота
Для первого представителя ароматических кислот ИЮПАК сохранено название «бензойная кислота» (C6H5СОOH). Замещенные ароматические монокарбоновые кислоты называют, используя бензойную кислоту в качестве родоначальной структуры:

4-метилбензойная кислота 3-нитробензойная кислота
|
|
|
Применяют также систему, согласно которой за основу принимают тривиальное название кислоты, соответствующей самой длинной в молекуле цепи, а атомы обозначают, начиная с соседнего с карбоксильной группой, буквами греческого алфавита.

2-метилбутановая
(α-метилмасляная) кислота
Изомерия предельных одноосновных карбоновых кислот аналогична изомерии монозамещенных предельных углеводородов. Кислоты с числом атомов углерода меньше четырех не имеют изомеров, а кислота с четырьмя атомами углерода имеет два изомера. Число изомеров увеличивается по мере возрастания углеродной цепи.
Физические свойства.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. В газовой фазе и в неполярных растворителях монокарбоновые кислоты существуют в виде димеров.

Водородные связи, возникающие в карбоновых кислотах, относятся к числу самых прочных среди других водородных связей; их энергия равна 29 кДж/моль.
Монокарбоновые кислоты с числом атомов углерода от 1 до 3 – бесцветные жидкости, смешиваются с водой в любых соотношениях. Кислоты, в молекуле которых содержится от 4 до 9 атомов углерода – маслянистые жидкости, растворимость их в воде невелика. Растворимость в воде высших гомологов уменьшается по мере удлинения углеродного радикала.
|
|
|
Практически все дикарбоновые и ароматические кислоты – твердые вещества. В ряду дикарбоновых кислот наблюдаются те же закономерности: низшие гомологи лучше растворяются в воде, чем высшие. Ароматические кислоты плохо растворимы в воде.
Способы получения.
3.1. Окисление первичных спиртов.
Первичные спирты окисляются до карбоновых кислот реагентом Джонса или перманганатом калия в кислой или щелочной среде.


3.2. Окисление альдегидов.
Для окисления альдегидов используют те же реагенты, а также оксид серебра.

3.4. Окисление алкилбензолов.
В качестве окислителей используют перманганат калия, соединения хрома(VI), азотную кислоту и т.д.

3.5. Галоформная реакция метилкетонов.

3.6. Гидролиз нитрилов.
Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:

3.7. Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т.д.).
Все функциональные производные карбоновых кислот при гидролизе в кислой или щелочной среде образуют карбоновые кислоты или их соли.

3.8. Гидролиз тригалогенопроизводных.
Тригалогенопроизводные гидролизуются в соответствующие карбоновые кислоты.

Химические свойства.
Карбоновые кислоты содержат функциональную группу СООН, связанную с радикалом или атомом водорода.

Величины валентных углов, близкие к 1200, и плоский характер карбоксильной группы указывают на sp2-характер гибридизации углерода карбоксильной группы.
В молекулах карбоновых кислот можно выделить ряд реакционных центров:
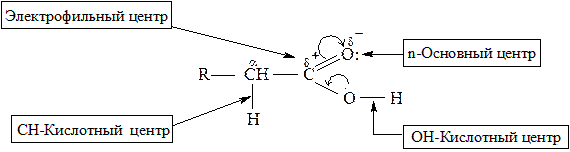
· ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
· электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
· основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения;
· СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода карбонильной группы. Это приводит к ослаблению связи между кислородом и водородом в гидроксильной группе и легкости отщепления атома водорода от гидроксила в виде протона (Н+).
Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению пониженной электронной плотности δ'+ на α-углеродном атоме кислоты.
4.1. Кислотные свойства
Карбоновые кислоты обладают более сильными кислотными свойствами, чем спирты и некоторые фенолы. В водных растворах они слабо диссоциированы, кислая среда обнаруживается с помощью индикаторов. При взаимодействии с основаниями, карбонатами, гидрокарбонатами и аммиаком карбоновые кислоты образуют соли:
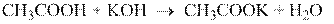


Дикарбоновые кислоты содержат две карбоксильные группы, поэтому они образуют два ряда солей – кислые и средние.


Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами Бренстеда (спиртами и большинством фенолов) объясняется тем, что атомы кислорода и углерод в карбоксильной группе стабилизированы за счет сопряжения.
В анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд поровну распределяется между двумя атомами кислорода:

Такая делокализация электронной плотности в молекуле с энергетической точки зрения всегда более выгодна. Молекула в этом случае обладает меньшей энергией и термодинамически более устойчива. Образование таких структур является движущей силой многих реакций.
Возможность выигрыша энергии при образовании симметричного аниона кислоты является причиной легкого отщепления протона от гидроксильной группы кислот, т.е. причиной проявления кислотных свойств молекулы.
Симметричное строение аниона, равноценность атомов кислорода, одинаковые длины связей углерод-кислород подтверждаются данными рентгеноструктурного анализа.
Таблица №1. Значения рКа некоторых карбоновых кислот.
| Название | Формула | Название солей и сложных эфиров | рКа |
| Монокарбоновые | |||
| Алифатические | |||
| Метановая (муравьиная) | НСООН | формиат | 3,75 |
| Этановая (уксусная) | СН3СООН | ацетат | 4,76 |
| Пропановая (пропионовая) | СН3СН2СООН | пропионат | 4,87 |
| Бутановая (масляная) | СН3(СН2)2СООН | бутират | 4,81 |
| 2-метилпропановая (изомасляная) | (СН3)2СНСООН | изобутират | 4,84 |
| Пропеновая (акриловая) | СН2=СНСООН | акрилат | 4,25 |
| Бутен-3-овая (винилуксусная) | СН2=СНСН2СООН | винилацетат | 4,69 |
| Ароматические | |||
| Бензойная | С6Н5СООН | бензоат | 4,19 |
| Дикарбоновые | |||
| Алифатические | |||
| рКа I рКа II | |||
| Этандиовая (щавелевая) | НООС─СООН | оксалат | 1,23; 4,19 |
| Пропандиовая (малоновая) | НООССН2СООН | малонат | 2,83; 5,69 |
| Бутандиовая (янтарная) | НООССН2СН2СООН | сукцинат | 4,19; 5,48 |
| Пентандиовая (глутаровая) | НООС(СН2)3СООН | глутарат | 4,34; 5,42 |
| (Z)-Бутендиовая (малеиновая) | (Z)-НООССН=СНСООН | малеинат | 1,92; 6,23 |
| (Е)-Бутендиовая (фумаровая) | (Е)-НООССН=СНСООН | фумарат | 3,02; 4,38 |
| Ароматические | |||
| Бензол-1,2-дикарбоновая (ортофталевая) | 
| фталат | 3,00; 5,41 |
| Бензол-1,4-дикарбоновая (терефталевая) | 
| терефталат | 3,54; 4,46 |
Строение радикала влияет на кислотные свойства карбоновых кислот (см. табл.1). Электронодонорные заместители снижают кислотность (значение рКаметановой кислоты на ~1 меньше, чем рКа её гомологов).
Длина и разветвленность насыщенного алкильного радикала не оказывает существенного влияния на кислотные свойства.
Ненасыщенные и ароматические кислоты обладают большей кислотностью, чем насыщенные алифатические. Ароматические кислоты с заместителем в орто-положении более сильные, чем мета- и пара-изомеры.
Таблица №2.Значения рКа замещенных алифатических карбоновых кислот.
| Формула | рКа | Формула | рКа |
| FCH2COOH | 2,66 | CH3CH(Cl)COOH | 2,80 |
| F3CCOOH | 0,23 | ClCH2CH2COOH | 4,08 |
| ClCH2COOH | 2,86 | ClCH2CH2CH2COOH | 4,52 |
| Cl3CCOOH | 0,66 | NCCH2COOH | 2,47 |
| BrCH2COOH | 2,90 | O2NCH2COOH | 1,68 |
Электроноакцепторные заместители усиливают кислотность.
Из данных, представленных в табл. 2, видно, что замещенные карбоновые кислоты различаются по своей силе. Константа диссоциации трифторуксусной кислоты ~ в 50000 раз больше константы диссоциации уксусной кислоты. Все моно-, ди- и тригалогензамещенные производные уксусной кислоты превосходят уксусную кислоту по величине константы диссоциации. Влияние электроноакцепторных заместителей на кислотные свойства карбоновых кислот в алифатическом ряду подчиняется чётким закономерностям как по числу этих заместителей, так и по взаимному расположению акцепторной и карбоксильной групп (см.табл. 2).
Изменение кислотности карбоновых кислот основывается на индуктивном эффекте заместителей. Заместители, обладающие отрицательным индуктивным эффектом (-I эф ), стабилизируют карбоксилат-анион, что непосредственно отражается на значении рКасоответствующих кислот. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга (см. табл.1).
4.2. Реакции карбоновых кислот.
Реакции карбоновых кислот можно подразделить на несколько групп.
1. Восстановление.
2. Реакции декарбоксилирования.
3. Реакции замещения при α-углеродном атоме.
4. Реакции нуклеофильного замещения (SN) у ацильного атома углерода.
Восстановление карбоновых кислот.
Карбоновые кислоты восстанавливаются до первичных спиртов с помощью литийалюминийгидрида. Восстановление идёт в более жёстких условиях, чем это требуется для восстановления альдегидов и кетонов.

Реакции декарбоксилирования.
В процессе декарбоксилирования карбоновые кислоты отцепляют оксид углерода (IV) и превращаются в соединения разных классов в зависимости от условий проведения реакции.
Алифатические кислоты при пропускании их паров над оксидами тория (IV) и марганца (IV) превращаются в кетоны:

Дикарбоновые кислоты превращаются в циклические кетоны:
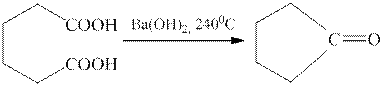
При нагревании серебряных или ртутных солей карбоновых кислот с бромом образуются алкилбромиды (реакция Бородина-Хунсдиккера).
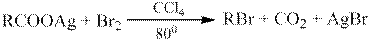
Незамещенные монокарбоновые кислоты декарбоксилируются трудно. Реакция протекает легче при наличии у α-углеродного атома электроноакцепторной группы, поляризующей связь этого атома с карбоксильной группой
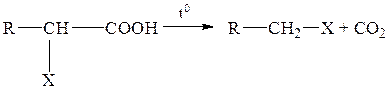
(X=OH, NO2, C≡N)
При нагревании в присутствии серной кислоты щавелевая и малоновая кислоты также декарбоксилируются.


Дата добавления: 2019-02-12; просмотров: 128; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
