Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
Коллоидные системы, коллоиды (др.-греч. κόλλα — клей + εἶδος — вид; «клеевидные») — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями, в которых дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 100 нм, распределены в дисперсионной среде, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
Специфической особенностью коллоидных растворов по сравнению с истинными является их агрегативная неустойчивость, т.е. способность разделяться на фазы под влиянием незначительных внешних воздействий. Еще легче такое расслоение происходит в случае грубодисперсных гетерогенных систем (неустойчивых эмульсий, суспензий и т.п.)
Причиной принципиальной неустойчивости гетерогенных дисперсных систем является наличие у них большой межфазной поверхности. Эта поверхность обладает большим избытком энергии. При разделении фаз (расслаивании гетерогенной системы) межфазная поверхность становится минимальной, общая энергия системы понижается, система становится более стабильной.
При своем хаотическом тепловом движении частицы дисперсной фазы сталкиваются и объединяются, так как на близких расстояниях между ними возникают межмолекулярные (ван-дер-ваальсовские) силы притяжения. Далее укрупненные частицы под действием гравитационных сил объединяются, образуя слои фаз, например, осадок твердой фазы отделяется от жидкой фазы, или более плотная жидкость опускается вниз, а более легкая остается наверху, или пузырьки газа отделяются от жидкости и т.д.
|
|
|
Но главной причиной устойчивости коллоидных систем считают наличие одноименного заряда на поверхности коллоидных частиц. Частицы не могут подойти близко друг к другу из-за электростатического отталкивания одинаковых по знаку зарядов.
С современной точки зрения, заряд на коллоидных частицах обусловлен наличием на их поверхности двойного электрического слоя (ДЭС) из ионов, возникающего либо в результате избирательной адсорбции одного из ионов электролита, находящегося в растворе, либо за счет ионизации поверхностных молекул вещества.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
|
|
|
ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ, группа явлений, наблюдаемых в дисперсных системах, мембранах и капиллярах; включает электроосмос, электрофорез, потенциал течения и потенциал оседания (седиментационный потенциал, или эффект Дорна). Электроосмос - течение жидкости в капиллярах и пористых телах, вызванное внеш. электрич. полем; обратное ему электрокинетическое явление - потенциал течения - появление электрич. разности потенциалов на концах капилляра или мембраны при протекании жидкости. Электрофорез - движение твердых частиц или капель, взвешенных в электролите, при наложении электрич. поля. Обратное электрокинетическое явление-появление электрич. разности потенциалов на границах облака оседающих (седиментирующих) частиц, взвешенных в электролите (эффект Дорна).
31. Методы очистки коллоидных растворов. Диализ, электролиз, ультрафикация.
При получении коллоидных растворов тем или иным методом, особенно с помощью химических реакций, практически невозможно точно предусмотреть необходимое количественное соотношение реагентов. По этой причине в образовавшихся золях может присутствовать чрезмерный избыток электролитов, что снижает устойчивость коллоидных растворов. Для получения высокоустойчивых систем и для изучения их свойств золи подвергают очистке как от электролитов, так и от всевозможных других низкомолекулярных примесей.
|
|
|
Очистку коллоидных растворов можно проводить либо методом диализа, либо ультрафильтрацией.
Диализ заключается в извлечении из золей низкомолекулярных веществ чистым растворителем с помощью полупроницаемой перегородки (мембраны), через которую не проходят коллоидные частицы. Периодически или непрерывно сменяя растворитель в приборе для диализа — диализаторе, можно практически полностью удалить из коллоидного раствора примеси электролитов и низкомолекулярных неэлектролитов.
Недостатком метода является большая длительность процесса очистки (недели, месяцы).
Электродиализ — это процесс диализа, ускоренный путем применения электрического тока. Прибор для его осуществления называют электродиализатором. Простейший электродиализатор представляет собой сосуд, разделенный двумя мембранами на три камеры. В среднюю камеру наливают подлежащий очистке коллоидный раствор. В боковые камеры помещают электроды от источника постоянного тока и обеспечивают подвод и отвод растворителя (воды). Под действием электрического поля происходит перенос катионов из средней камеры в катодную камеру, анионов — в анодную. Раствор в средней камере может быть в течение корот-кого времени (минуты, часы) очищен от растворенных солей.
|
|
|
Ультрафильтрация — фильтрование коллоидного раствора через полупроницаемую мембрану, пропускающую дисперсионную среду с низкомолекулярными примесями и задерживающую частицы дисперсной фазы или макромолекулы. Для ускорения процесса ультрафильтрации ее проводят при перепаде давления по обе стороны мембраны: под разрежением (вакуумом) или под повышенным давлением. Вакуум создают откачиванием воздуха из расположенного под фильтром сосуда, повышенное давление — нагнетанием воздуха в сосуд, расположенный над фильтром. Для предотвращения разрыва мембраны ее помещают на твердую пористую пластинку. Ультрафильтрация позволяет скорее отделить от коллоидного раствора электролиты и другие примеси (низкомолекулярные органические соединения), чем это происходит при диализе. При ультрафильтрации достигают высокой степени очистки золя, периодически разбавляя последний водой. На конечной стадии путем отсасывания дисперсионной среды можно сконцентрировать коллоидный раствор. Ультрафильтрация может применяться в сочетании с электродиализом (электроультрафильтрация), благодаря чему значительно ускоряется удаление солей из коллоидного раствора.
Поскольку поры обычной фильтровальной бумаги легко пропускают коллоидные частицы, при ультрафильтрации в качестве мембраны применяют специальные фильтры (целлофан, пергамент, асбест, керамические фильтры и т. п.). Применение мембраны с определенным размером пор позволяет разделить коллоидные частицы на фракции по размерам и ориентировочно определить эти размеры. Так были найдены размеры некоторых вирусов и бактериофагов. Все это говорит о том, что ультрафильтрация является не только методом очистки коллоид» ных растворов, но может быть использована для целей дисперсионного анализа и препаративного разделения дисперсных систем.
32.. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого(Вещество, которое присутствует в меньшем количестве, диспергирует и распределено в объеме другого, называют дисперсной фазой.Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсной средой)
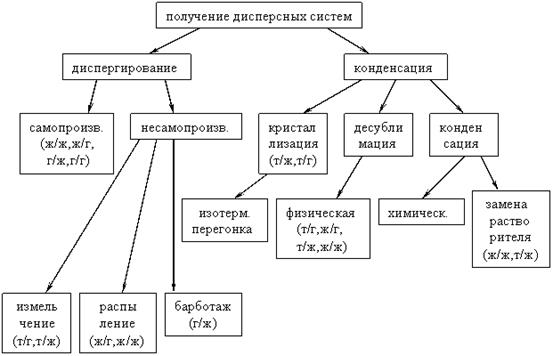
Методы диспергирования
– механическое диспергирование – осуществляется под действием внешней механической работы. Способы: истирание, раздавливание, раскалывание, распыление, барботаж (пропускание струи воздуха через жидкость)
– электрическое диспергирование – основан на образовании вольтовой дуги между электродами из распыляемого металла, помещенными в охлаждаемую ДС. Металлы при температуре вольтовой дуги испаряются, а затем в холодной ДС конденсируются. Таким методом получают в основном гидрозоли металлов (дисперсионной средой является вода), например серебра, золота и платины.
– диспергирование ультразвуком – основано на воздействии при помощи ультразвуковых колебаний с частотой выше 20 тыс. в 1 с., не улавливаемых человеческим ухом, эффективно лишь для веществ с небольшой прочностью. К ним относят серу, графит, крахмал
Физический метод конденсации –– метод замены растворителя
Химические методы конденсации основаны на реакциях гидролиза, окисления, восстановления, обмена.
Взвеси – это дисперсные системы, в которых размер частицы фазы более 100 нм. Этонепрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсная среда легко разделяются отстаиванием, фильтрованием. Такие системы разделяются на:
Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т.д.
Суспензии ( среда – жидкость, фаза – нерастворимое в ней твердое вещество).Чтобы приготовить суспензию , надо вещество измельчить до тонкого порошка, высыпать в жидкость и хорошо взболтать. Со временем частица выпадут на дно сосуда. Очевидно, чем меньше частицы, тем дольше будет сохраняться суспензия. Это строительные растворы, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты – киты, и т.д.
Аэрозоли взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях)
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде.
33. Устойчивость дисперсных систем. Седиментационная , агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
1.К осаждению дисперсной фазы - характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая) устойчивость.
2.К агрегации ее частиц.
Агрегативная или конденсационная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться).
Седиментационная (кинетическая) устойчивость – это способность системы противостоять осаждению частиц дисперсной фазы под действием силы тяжести (седиментация). Она находится в зависимости от размеров частиц в системе, осаждению которой противодействуют силы диффузии. Высокодисперсные системы устойчивы к седиментации, в то время как грубодисперсные системы седиментационно не устойчивы.
Дата добавления: 2019-02-12; просмотров: 630; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
