По числу мест, занимаемых лигандами в координационной сфере
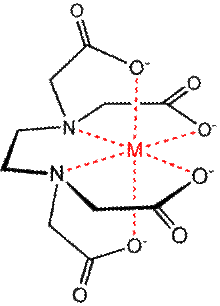

Структура комплексного иона, образованного катионом металла и анионом ЭДТА
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−, тиосульфат-ион S2O32−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Номенклатура
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
|
|
|
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
|
|
|
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3] — трифторотриаквахром
[Сo(NH3)3Cl(NO2)2] — динитритохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3 — нитрат тетрааквалития
Химическая связь в комплексных соединениях.
Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
1. Связь между комплексообразователем и лигандами донорно-акцепторная σ-типа. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали.
2. Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации, которая определяет геометрию комплекса. Тип гибридизации определяется числом, природой и электронной структурой лигандов.
3. Дополнительное упрочение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда.
4. Магнитные свойства комплекса объясняются исходя из заселённости орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
|
|
|
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных 3d–элементами: кобальтом, никелем и медью. В таблице собственные электроннные пары комплексообразователей изображены сплошными стрелками, а электронные пары лигандов, ответственные за донорно-акцепторные σ-связи, представлены пунктирными стрелками.
| Комплекс | Заселённость орбиталей комплексообразователя | Тип гибридизации ядра комплекса | Структура комплекса | ||||||||||
                              
  [CoF6]3- [CoF6]3-
| sp3d2 | Октаэдр. | |||||||||||
   [NiCl4]2- [NiCl4]2-
| sp3 | Тетраэдр. | |||||||||||
 [Cu(NH3)2]+ [Cu(NH3)2]+
| sp | Линейная |
Наряду с моноядерными комплексами, включающими только один центральный атом, существуют полиядерные, в структуре которых одновременно присутствуют два или несколько центральных атомов-комплексообразователей.
Помимо МВС для описания комплексных соединений широко используют Теорию кристаллического поля (ТКП), основанную на электростатической модели, её усовершенствованную модель – Теорию поля лигандов (ТПЛ), в которой электростатическое взаимодействие дополнено идеей перекрывания орбиталей, и, наконец, Метод молекулярных орбиталей (ММО).
|
|
|
Дата добавления: 2019-02-12; просмотров: 457; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
