Механизмы образования химической связи
В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи.
Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону.
В молекулах Н2, Li2, Na2 связи образуются за счет неспаренных s-электронов атомов. В молекулах F2 и Cl2 – за счет неспаренных р-электронов. В молекулах HF и HCl связи образуются s-электронами водорода и p-электронами галогенов.
Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов.
Из квантовых ячеек N и Н можно видеть, что атом азота имеет 3 неспаренных электрона, а атом водорода – один. Принцип насыщаемости указывает на то, что устойчивым соединением должен быть NH3, а не NH2, NH или NH4. Однако существуют молекулы, содержащие нечетное число электронов, например, NO, NO2, ClO2. Все они характеризуются повышенной реакционной способностью.
На отдельных стадиях химических реакций могут образовываться и валентно ненасыщенные группы, которые называются радикалами, например, H, NH2, O, CH3. Реакционная способность радикалов очень высока и поэтому время их существования, как правило, мало.
Химическая связь. Основные характеристики химической связи
|
|
|
Химической связью называют взаимодействие, удерживающее атомы в молекулах и обуславливающее стабильность молекул в определенных условиях.
Основные характеристики химической связи:
Энергия связи (ЕСВ ) – минимальная энергия, необходимая для разрушения связи.
Измеряется в электронвольтах (эВ) для одной связи или в кДж/моль для одного моля связей. Энергия связи является характеристикой прочности связи – чем выше энергия связи, тем прочнее связь.
Длина связи (LСВ )– расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) или в ангстремах (А). Чем короче связь, тем она, как правило, прочнее.
Насыщаемость связи – если атом образует конечное число связей с другими атомами (обычно не более 8) – связь насыщаема, если бесконечно большое (больше 1000) – ненасыщаема.
Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие связи, то связь направлена, если таких направлений нет – то ненаправлена.
Энергия и длина связи характерны для любой химической связи, насыщаемость и направленность зависят от вида связи.
24. Комплексные соединения (КС). Строение КС. Номенклатура КС. Классификация КС. Характер связи в КС.
|
|
|
Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения, имеющие внешнюю сферу, в водном растворе полностью диссоцируют на комплексный малодиссоцирующий катион ([Ag(NH3)2]+) или анион ([Fe(CN)6]3−). Комплексные соединения без внешней сферы в воде нерастворимы (например, карбонилы металлов).
Комплексные соединения разнообразны и многочисленны.
Строение комплексных соединений
Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе.
|
|
|
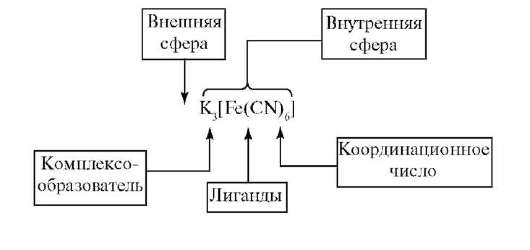
По координационной теории Вернера в комплексном соединении различают внутреннюю и внешнюю сферы. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса. Ее обычно заключают в квадратные скобки. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратными скобками. Вокруг центрального атома размешается определенное число лигандов, которое определяется координационным числом (кч). Число координированных лигандов чаще всего равно 6 или 4. Лиганд занимает около центрального атома координационное место. При координации изменяются свойства как лигандов, так и центрального атома. Часто координированные лиганды невозможно обнаружить с помощью химических реакций, характерных для них в свободном состоянии. Более прочно связанные частицы внутренней сферы называются комплексом (комплексным ионом). Между центральным атомом и лигандами действуют силы притяжения (образуется ковалентная связь по обменному и (или) донорно-акцепторному механизму), между лигандами - силы отталкивания. Если заряд внутренней сферы равен 0, то внешняя координационная сфера отсутствует.
Центральный атом (комплексообразователь) - атом или ион, который занимает центральное положение в комплексном соединении. Роль комплексообразователя чаще всего выполняют частицы, имеющие свободные орбитали и достаточно большой положительный заряд ядра, а следовательно, могут быть акцепторами электронов. Это катионы переходных элементов. Наиболее сильные комплексообразовате-ли - элементы IB и VIIIB групп. Редко в качестве комплексообразо-
|
|
|
вателей выступают нейтральные атомы d-элементов [Fe(CO)5] и атомы неметаллов в различной степени окисления [PF6]-. Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Величина координационного числа зависит от многих факторов, но обычно она равна удвоенному заряду иона-комплексообразователя:
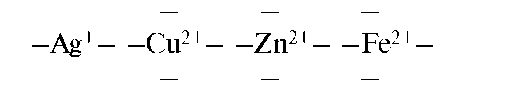
Лиганды - ионы или молекулы, которые непосредственно связаны с комплексообразователем и являются донорами электронных пар. Эти электроноизбыточные системы, имеющие свободные и подвижные электронные пары, могут быть донорами электронов, например:
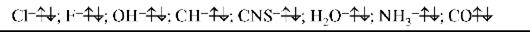
Соединения р-элементов проявляют комплексообразующие свойства и выступают в комплексном соединении в качестве лигандов. Лигандами могут быть атомы и молекулы (белка, аминокислот, нуклеиновых кислот, углеводов). По числу связей, образуемых лигандами с комплексо-образователем, лиганды делятся на моно-, ди- и полидентатные лиганды. Вышеперечисленные лиганды (молекулы и анионы) являются моноден-татными, так как они доноры одной электронной пары. К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы, способные быть донором двух электронных пар:
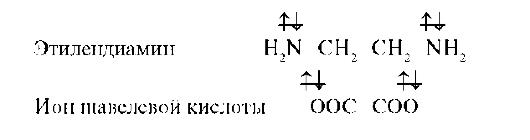
К полидентатным лигандам можно отнести 6-дентатный лиганд этилендиаминтетрауксусной кислоты:
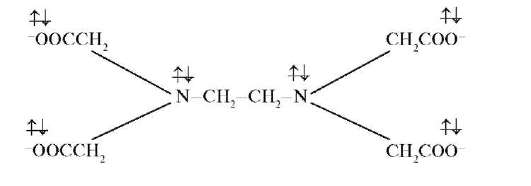
Число мест, занимаемых каждым лигандом во внутренней сфере комплексного соединения, называется координационной емкостью (дентатностью) лиганда. Она определяется числом электронных пар лиганда, которые участвуют в образовании координационной связи с центральным атомом.
Кроме комплексных соединений, координационная химия охватывает двойные соли, кристаллогидраты, распадающиеся в водном растворе на составные части, которые в твердом состоянии во многих случаях построены аналогично комплексным, но неустойчивы.
Наиболее устойчивые и разнообразные комплексы по составу и выполняемым ими функциям образуют d-элементы. Особенно большое значение имеют комплексные соединения переходных элементов: железа, марганца, титана, кобальта, меди, цинка и молибдена. Биогенные s-элементы (Na, К, Mg, Са) образуют комплексные соединения только с лигандами определенной циклической структуры, выступая также в качестве комплексообразователя. Основная часть р-элементов (N, P, S, О) является активной действующей частью комплексообразующих частиц (лигандов), в том числе и биолигандов. В этом состоит их биологическая значимость.
Следовательно, способность к комплексообразованию - это общее свойство химических элементов периодической системы, эта способность уменьшается в следующем порядке: f > d > p > s.
Номенклатура
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3] — трифторотриаквахром
[Сo(NH3)3Cl(NO2)2] — динитритохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3 — нитрат тетрааквалития
Классификация
Существует несколько классификаций комплексных соединений в основу которых положены различные принципы.
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
Дата добавления: 2019-02-12; просмотров: 537; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
