Диссоциация комплексных ионов. Константа нестойкости. Комплексообразование в организме.
1)При растворении комплексных ионов в воде происходит распад (диссоциация), причем внутренняя сфера ведет себя как единое целое:
K[Ag(CN)2] = K+ + [Ag(CN)2]-
Происходит диссоциация внутренней сферы:
[Ag(CN)2]- = Ag+ + 2CN-
2)Для характеристики комплексного соединения (иона) вводится константа нестойкости:
[ Ag + ][ CN - ](числитель)
Kнестоикости= [Ag(CN)2]- (знаменатель) =10-22
Чем константа нестоикости меньше, тем комплексное соединение более прочное.
3) Комплексообразование в организме: в живом организме d-элементы представлены в основном, как микроэлементы. «Свободных» ионов Me в организме нет, т.к. они либо гидролизуются, либо гидратитированы, либо существуют в виде К.С.. Чаще всего в биохимических реакциях d-элементы участвуют в качестве биоорганических комплексов Me. Их лигандами могут быть аминокислотные остатки, пептиды, белки, гормоны, нуклеиновые кислоты и некоторые другие. Биоорганические комплексы d-элементов называют биокластерами. В них входят Me, которые взаимодействуют с донорными атомами связывающих групп: ОН, сульфогидрильные – SH, NH2 белков или аминов, COO-.
26.Изомерия КС. Комплексообразование в организме.
Изомерия КС:
1) Сольватная изомерия: обнаруживается в изомерах когда распределение молекул воды между внутренней и внешней сферами оказывается неодинаковым.
[Cr(H2O)6]Cl3 (фиолетовый) и [Cr(H2O)5Cl]Cl2H2O (зеленый)
2) Ионизирующая изомерия: связана с различной лёгкостью диссоциации ионов из внутренней и внешней сферы комплекса.
|
|
|
[Pt(NH)4Cl2]Br2 и [Pt(NH)4Br2]Cl2
3) Координирующая изомерия: Встречается в тех комплексных соединениях, где и катион и анион являются комплексными.
[Co(NH3)6][Fe(CN)6] и [Fe(NH3)6][Co(CN)6]
4) Изомерия связи: возникает только тогда, когда монодентатные лиганды могут координироваться через два разных атома.
5) Пространственная изомерия: обусловлена тем, что одинаковые лиганды располагаются вокруг комплексообразователя либо рядом (цис), либо напротив (транс).
[clclPtNH3NH3] [clNH3PtclNH3]
6) Зеркальная (оптическая) изомерия: например в катионе дихлоро – диэтилендиамино-хрома (III)
[Cr(en)2Cl2]+
Строение гема
Гем состоит из иона двухвалентного железа и порфирина (рис. 13-1). В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками (рис. 13-1). В зависимости от структуры заместителей в кольцах пирролов различают несколько типов порфиринов: протопорфирины, этиопорфирины, мезо-порфирины и копропорфирины. Протопорфирины - предшественники всех других типов порфиринов.
|
|
|
Гемы разных белков могут содержать разные типы порфиринов. В теме гемоглобина находится протопорфирин IX, который имеет 4 метальных, 2 винильных радикала и 2 остатка пропионовой кислоты. Железо в теме находится в восстановленном состоянии (Fe+2) и связано двумя ковалентными и двумя координационными связями с атомами азота пиррольных колец. При окислении железа гем превращается в гематин (Fe3+). Наибольшее количество гема содержат эритроциты, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени из-за высокого содержания в них цитохрома Р450.
636
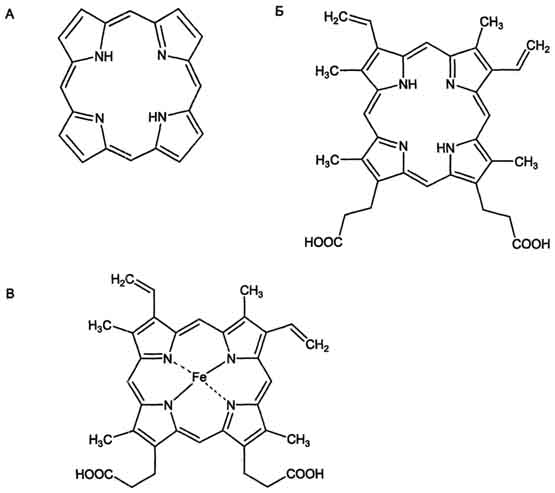
Рис. 13-1. Строение порфина (А), протопорфирина IX (Б) и гема гемоглобина (В). Порфин - циклическая структура, состоящая из четырёх пиррольных колец, связанных между собой метановыми мостиками. Протопорфирин IX имеет четыре метильных, два винильных радикала и два остатка пропионовой кислоты. В теме гемоглобина Fe2+ образует две ковалентные и две координационные связи с атомами азота пиррольных колец протопорфирина IX.
ОВР и их биологическая роль.
Окисли́тельно-восстанови́тельные реа́кции, также редокс — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
|
|
|
Биологическая роль: Окислительно-восстановительные реакции играют огромную роль в природе. Без этих реакций невозможна жизнь. Дыхание, обмен веществ, синтез растениями клетчатки из углекислого газа и воды - все это окислительно-восстановительные процессы. Большинство химических реакций, происходящих в природе - окислительно-восстановительные.
Классификация дисперсных систем. Классификация дисперсных систем по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсной средой.
Дисперстные системы – системы, состоящие из частиц одной фазы, которые распределены в другой фазе.
Дисперсные системы классифицируют по размеру частиц, по агрегатному состоянию дисперсной фазы и дисперсионной среды, по характеру взаимодействия между дисперсной фазой и дисперсионной средой. Наиболее распространена классификация по агрегатному состоянию. Возможны восемь типов дисперсных систем в зависимости от агрегатного состояния распределенного вещества и среды: Г- газообразное вещество, Ж - жидкое, Т - твердое; первая буква относится к распределяемому веществу, вторая - к среде. Все системы, отвечающие коллоидной степени дисперсности, принято называть золями.
|
|
|
1)
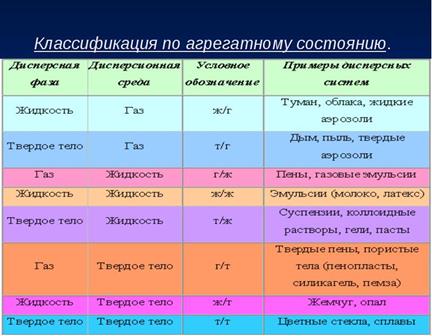
2)По степени раздробленности (дисперсности) системы делятся на следующие классы: грубодисперсные, размер частиц в которых более 10-5 м; тонкодисперсные (микрогетерогенные) с размером частиц от 10-5 до 10-7 м; коллоидно-дисперсные (ультрамикро-гетерогенные) с частицами размером от 10-7 до 10-9м. Если фиксировать внимание на двух основных компонентах дисперсных систем, то одному из них следует приписать рольдисперсионной среды, а другому - роль дисперсной фазы. В этом случае все дисперсные системы можно классифицировать по агрегатным состояниям фаз.
Коллоидная дисперсность:
Т1/Г2 – пыль в верхних слоях атмосферы, аэрозоли.
Т1/Ж2 – лиозоли, дисперсные красители вводе, латексы синтетических полимеров.
Грубая дисперсность:
Т1/Г2 – дымы
Ж1/Г2 – туманы
Т1/Ж2 – суспензии
Ж1/Ж2 – жидкие эмульсии
Г1/Ж2 – газовые эмульсии
3)По силе взаимодействия между дисперстной средой и дисперстной фазой:
Лиофильные: сильное межмолекулярное взаимодействие веществ фазы и среды с образованием сольватных оболочек из молекул дисперстной среды (мыла, глины).
Лиофобные: слабое взаимодействие вещества дисперстной фазы со средой (пены, лиозоли, аэрозоли, эмульсии).
Дата добавления: 2019-02-12; просмотров: 406; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
