Проведение анализа. Выделение ДНК. Метод выделения ДНК с помощью набора Diatom DNA Prep 100/200
1) Приготовление рабочего раствора солевого буфера. Содержимое флакона с 10-кратным солевым буфером, 10 мл, перенести в мерный цилиндр, довести бидистиллированной водой до метки 100 мл и 96%-м этиловым спиртом до метки 300 мл и перемешать. Готовый рабочий раствор солевого буфера хранить в герметично закрытой посуде при температуре 4 °С.
2) В пробирку объемом 1,5 мл внести 100 мкл исследуемой пробы, добавить 400 мкл лизирующего реагента и перемешать содержимое пробирки переворачиванием (5-10 раз). Интенсивное встряхивание смеси не рекомендуется.
3) Термостатировать пробирку со смесью 5-7 мин при температуре 65 °С. Если выделение ДНК проводится из твердого сухого мелкоизмельченного материала, то следует термостатировать 30-40 мин.
4) После термостатирования центрифугировать пробирку со смесью 10 с при 5000 об./мин в том случае, если смесь содержит несолюбилизированный клеточный дебрис или другой нерастворимый осадок. Прозрачный супернатант целиком перенести в чистую пробирку.
5) В пробирку с чистой смесью добавить 20 мкл суспензии сорбента NucleoS  (перед использованием NucleoS
(перед использованием NucleoS  следует интенсивно встряхнуть на вортексе).
следует интенсивно встряхнуть на вортексе).
6) Пробирку поместить на ротатор и перемешивать 10 мин (10-20 об./мин).
7) Центрифугировать 10 с при 5000 об./мин.
8) Осторожно, не задевая осадок, удалить супернатант.
9) К осадку добавить 200 мкл лизирующего реагента, тщательно перемешать на вортексе до гомогенного состояния.
|
|
|
Примечание. Если суспендирование затруднено (при большой нагрузке ДНК из-за сильного слипания сорбента), то его необходимо вначале осторожно суспендировать пипетированием, а затем перемешать на вортексе.
10) Добавить в пробирку 1 мл рабочего раствора солевого буфера.
11) Перемешать содержимое пробирки переворачиванием пробирки 5-10 раз.
12) Центрифугировать 10-20 с при 2000 об./мин.
13) Осторожно, не задевая осадок, удалить супернатант.
14) Добавить в пробирку 1 мл солевого буфера, перемешать содержимое пробирки на вортексе, центрифугировать 10 с при 5000 об./мин и осторожно удалить супернатант с помощью насоса.
15) Повторить положение 14.
16) Посушить осадок при температуре 65 °С в течение 4-5 мин.
17) В эту же пробирку внести 50-100 мкл Экстра Гена  (100 мкл, если выделение ДНК проводится из 200 мл цельной крови или другой, богатой ДНК, пробы).
(100 мкл, если выделение ДНК проводится из 200 мл цельной крови или другой, богатой ДНК, пробы).
Внимание! Экстра Ген  следует отбирать от общего объема при постоянном перемешивании!
следует отбирать от общего объема при постоянном перемешивании!
18) Суспедировать содержимое пробирки на вортексе 5-10 с до получения гомогенной суспензии, затем термостатировать 4-5 мин при 65 °С.
19) Еще раз суспендировать содержимое пробирки на вортексе перед центрифугированием.
|
|
|
20) Центрифугировать 1 мин при 10000 об./мин.
21) Перенести супернатант с ДНК в чистую пробирку. ДНК хранить при температуре -20 °С.
Амплификация
Общие требования к постановке идентификационной ПЦР
При проведении идентификации обязательно готовят следующие пробы:
 ДНК-матрица положительного контроля с праймерами к соответствующим возбудителям;
ДНК-матрица положительного контроля с праймерами к соответствующим возбудителям;
 ДНК-матрица отрицательного контроля с праймерами к соответствующим возбудителям;
ДНК-матрица отрицательного контроля с праймерами к соответствующим возбудителям;
 ДНК-матрица отрицательного контроля с теми же праймерами;
ДНК-матрица отрицательного контроля с теми же праймерами;
 исследуемые образцы ДНК паразитов с праймерами.
исследуемые образцы ДНК паразитов с праймерами.
Метод идентификации ДНК
Праймеры для идентификации В. hominis:
 Прямой праймер - 5’ - САС TGT GTC GTC ATT GTT TTG - 3’;
Прямой праймер - 5’ - САС TGT GTC GTC ATT GTT TTG - 3’;
 Обратный праймер - 5’ - AGG GTC GCA TAA TAG AGT GG - 3’.
Обратный праймер - 5’ - AGG GTC GCA TAA TAG AGT GG - 3’.
Праймеры для идентификации С. parvum:
 Прямой праймер 5’ - CCG AGT TTG АТС САА ААА GTT ACG AA - 3’;
Прямой праймер 5’ - CCG AGT TTG АТС САА ААА GTT ACG AA - 3’;
 Обратный праймер 5’ - CGT TAA CGG ААТ TAA CCA GAC - 3’.
Обратный праймер 5’ - CGT TAA CGG ААТ TAA CCA GAC - 3’.
Праймеры для идентификации Dirofilaria repens:
 Прямой праймер - 5’ - CCG GTA GAC CAT GGC ATT AT - 3’;
Прямой праймер - 5’ - CCG GTA GAC CAT GGC ATT AT - 3’;
 Обратный праймер - 5’ - CGG TCT TGG ACG ТТТ GGT ТА - 3’.
Обратный праймер - 5’ - CGG TCT TGG ACG ТТТ GGT ТА - 3’.
Праймеры для идентификации Dirofilaria immitis:
 Прямой праймер - 5’ - TGA TTG GTG GTT TTG GTA А - 3’;
Прямой праймер - 5’ - TGA TTG GTG GTT TTG GTA А - 3’;
 Обратный праймер - 5’ - ATA AGT ACG AGT АТС ААТ АТС - 3’.
Обратный праймер - 5’ - ATA AGT ACG AGT АТС ААТ АТС - 3’.
Реактивы, которые вносятся на холоде в пробирку типа Эппендорф, и реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлены в табл.1.
|
|
|
Таблица 1
| N п/п | Реактивы | Объем реакционной смеси, мкл
| |
| 30 | 50 | ||
| 1 | Деионизированная вода | 190 | 322 |
| 2 | Буфер для полимеразной цепной реакции с  (10 (10 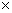 ) )
| 30 | 50 |
| 3 | Смесь нуклеотидов | 30 | 50 |
| 4 | Праймер 1 (5 пМ/мкл) | 20 | 30 |
| 5 | Праймер 2 (5 пМ/мкл) | 20 | 30 |
| 6 | Taq-полимераза (5 ед./мкл) | 10 | 18 |
Примечание. Реакционную смесь готовят на необходимое количество проб, но не меньше чем на 5.
Подготовка к проведению амплификации
Реакционную смесь разлить в каждую пробирку для проведения ПЦР - по 18 мкл.
В каждую пробирку с 18 мкл реакционной смеси добавить по 2 мкл раствора ДНК.
Смесь перемешать, центрифугировать (30 с при 3000 об./мин).
При использовании амплификатора с крышкой без подогрева в каждую пробирку добавить каплю минерального масла.
Условия амплификации представлены в табл.2.
|
|
|
Таблица 2
| Стадия | Режим (град °C - мин’); (град °С - с")
| |||
| В. hominis | С. parvum | D. repens | D. immitis | |
| Начальная денатурация | 95 °С - 5’ | 95 °С - 5’ | 94 °C - 5’ | 94 °C - 5’ |
| Денатурация | 95 °С - 1’ | 95 °C - 1’ | 94 °С - 30" | 94 °С - 1’ |
| Отжиг праймеров | 48 °С - 1’ | 45 °C - 2’ | 50 °C - 30" | 50 °С - 2’ |
| Удлинение | 72 °С - 1’ | 72 °C - 3’ | 72 °С - 1’ | 72 °C - 3’ |
| Конечное удлинение | 72 °С - 5’ | 72 °C - 4’ | 72 °С - 5’ | 72 °C - 5’ |
| Количество циклов амплификации | 35 | 35 | 30 | 30 |
После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
Дата добавления: 2019-02-12; просмотров: 252; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
