Проведение полимеразной цепной реакции (ПЦР)
Выделение ДНК
Ниже приведены методы выделения ДНК:
1) Фенол-хлороформное выделение ДНК.
2) Выделение ДНК с помощью готовых к использованию коммерческих наборов реагентов.
Допускается применение любого из методов, указанных в настоящих МУК, по выбору исполнителя.
Для повышения точности анализа исследования должны выполняться не менее чем в двух повторах (исследовать от одного образца сразу две пробы).
Метод фенол-хлороформного выделения ДНК
1) Подписать пробирки.
2) Приготовить образец для выделения ДНК:
3) Костный мозг: смешать 1:1 с солевым буфером в стерильной микроцентрифужной пробирке.
4) Биоптат/материал тканей: измельчить ткань (по 10-20 мг) стерильным пестиком или скальпелем в стерильной микроцентрифужной пробирке, смешать с 1-2 мл солевого буфера, можно также добавить протеиназу К, концентрация которой должна составить 200 мг/мл.
5) Образцы свежей крови: 3-10 мл крови центрифугировать при 3000 об./мин, аккуратно удалить супернатант. К осадку добавить равный объем солевого буфера.
6) Образцы на фильтровальной бумаге: мелко нарезать ножницами фильтровальную бумагу с каплей крови в стерильную микроцентрифужную пробирку. Добавить 250 мкл солевого буфера.
7) Соскоб: добавить 100 мкл солевого буфера на материал, который находится на предметном стекле. Перемешать и скарифицировать, используя наконечник пипетки, затем перенести суспензию с поверхности предметного стекла в стерильную микроцентрифужную пробирку. Повторить процедуру, добавив 150 мкл лизирующего буфера. Общий объем лизирующего буфера должен составить 250 мкл.
|
|
|
8) Москиты: гомогенизировать москита (тело самки или его часть) стерильным пестиком в 1,5 мл микроцентрифужной пробирке, содержащей 250 мкл солевого буфера.
9) Добавить Тритон Х-100, его конечная концентрация должна составить 1%.
10) Добавить протеиназу К, из расчета ее финальной концентрации 100-200 мкг/мл. Инкубировать всю ночь при 60 °С.
11) Добавить смесь фенол-хлороформ-изоамиловый спирт (25:24:1, v/v) в равном объеме. Аккуратно встряхнуть в течение 2-3 мин, переворачивая пробирки. Не использовать аппарат "Вортекс".
12) Центрифугировать при 16000 g (максимальная скорость) 10 мин и аккуратно перенести водную (верхнюю) фазу в чистые подписанные 1,5 мл пробирки, остатки утилизировать. Если органическая и водная фазы не достаточно хорошо отделились, следует повторить центрифугирование, увеличив время.
13) Повторить шаги 5 и 6.
14) К водной фазе добавить равный объем смеси хлороформ-изоамиловый спирт (24:1, v/v), мягко встряхнуть (не использовать аппарат "Вортекс"), центрифугировать 10 мин. Перенести вновь образовавшуюся водную фазу в чистые пробирки и оценить объем.
|
|
|
15) Добавить 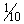 объема 3 М ацетата натрия (рН 5,2).
объема 3 М ацетата натрия (рН 5,2).
16) ПреципитироватьДНК 2,0-2,5 объемами ледяного 96%-го этанола. Аккуратно смешать, переворачивая пробирку (не использовать аппарат "Вортекс"). Инкубировать в морозильной камере - ночь или 1 ч при -70 °С.
17) Центрифугировать 30 мин при 16000 g, аккуратно слить супернатант, не потревожив осадок ДНК, который может быть невидимым.
18) Отмыть осадок ДНК 250 мкл 70%-го охлажденного этанола. Не встряхивать. Центрифугировать при 16000 g 15 мин при температуре 4 °С. Аккуратно удалить супернатант.
19) Оставить пробирку открытой при комнатной температуре до полного высыхания. Также можно использовать вакуумную сушку при 30 °С 10 мин.
20) Внести в каждую пробирку 100 мкл бидистиллированной воды или буфера Трис-ЭДТА. Оставить на 2 ч при комнатной температуре для полного растворения. Хранить при 4 °С - ночь, при -20 °С до использования.
21) Во избежание ингибирования ПЦР остатками фенольных соединений можно очистить выделенную ДНК, используя коммерческий набор подобно Nucleospin  Extract 2 в 1 от Macherey-Nagel-Germany или Qiagen PCR purification kit. Очистку производить согласно протоколу производителя. На выходе получится 30 мкл ДНК в буфере комплекта.
Extract 2 в 1 от Macherey-Nagel-Germany или Qiagen PCR purification kit. Очистку производить согласно протоколу производителя. На выходе получится 30 мкл ДНК в буфере комплекта.
|
|
|
22) Приготовленный вышеизложенным способом раствор ДНК использовать для постановки ПЦР.
4.2.2. Выделение ДНК коммерческим набором*
_______________
* Приведен оптимизированный протокол выделения ДНК с помощью набора DNA Purification Kit (Promega, USA), включавшего Cell Lysis Solution, Nuclei Lysis Solution, RNase Solution, Protein Precipitation Solution, DNA Rehydration Solution, отличающийся от протокола производителя.
1) Подписать пробирки.
2) Приготовить образец для выделения ДНК:
3) Мазок костного мозга, селезенки, лимфатического узла, язвенных поражений, капля крови на предметном стекле: добавить 300 мкл раствора, лизирующего клетки ("Cell Lysis Solution") на материал, который находится на предметном стекле. Перемешать и скарифицировать, используя наконечник пипетки, затем перенести суспензию с поверхности предметного стекла в стерильную микроцентрифужную пробирку. Мягко смешать, переворачивая пробирки, инкубировать смесь 10 мин при комнатной температуре.
4) Образцы свежей крови: к 300 мкл крови, находящейся в пробирке, добавить 300 мкл раствора, лизирующего клетки ("Cell Lysis Solution"). Мягко смешать, переворачивая пробирки, инкубировать смесь 10 мин при комнатной температуре.
|
|
|
5) Образцы на фильтровальной бумаге: мелко нарезать ножницами фильтровальную бумагу с каплей крови в стерильную микроцентрифужную пробирку. Добавить 300 мкл раствора, лизирующего клетки ("Cell Lysis Solution"), мягко смешать, переворачивая пробирки, инкубировать смесь 10 мин при комнатной температуре.
6) Москиты: гомогенизировать москита (тело самки или его часть) стерильным пестиком в 1,5 мл микроцентрифужной пробирке, содержащей 300 мкл раствора, лизирующего клетки ("Cell Lysis Solution"). Мягко смешать, переворачивая пробирки.
Центрифугировать при 13000-16000 g 2 мин при комнатной температуре.
Удалить как можно больше супернатанта, не потревожив осадок, некоторый супернатант может оставаться в пробирке. Повторить шаги 1-3.
Встряхните пробирки на аппарате "Вортекс" 10-15 с (частота колебаний 3000/мин), ресуспендируя содержимое пробирок до осветления осадка.
Добавить 100 мкл раствора, лизирующего ядро ("Nuclei Lysis Solution"), в пробирки, содержащие ресуспендированные клетки. Для разрушения лейкоцитов перемешать раствор пипеткой 5-6 раз. Раствор должен стать очень вязким.
7) Добавить 0,5 мкл раствора РНК-аз ("RNase Solution") для лизата ядра и перемешать образец переворачиванием пробирки 2-5 раз. Инкубировать смесь при 37 °С 15 мин, а затем охладить до комнатной температуры.
8) Добавить 33 мкл раствора, преципитирующего белки ("Protein Precipitation Solution"), к нуклеиновому лизату и интенсивно встряхнуть на аппарате "Вортекс" 10-20 с. Центрифугировать при 13000-16000 g 3 мин при комнатной температуре.
9) Перенести супернатант в чистые 1,5 мл микроцентрифужные пробирки, содержащие 100 мкл изопропанола комнатной температуры.
10) Перемешать раствор, аккуратно встряхивая, до появления белых нитеобразных структур ДНК (иногда они могут быть не видны). Центрифугировать при 13000-16000 g 2 мин при комнаткой температуре.
11) Удалить супернатант и добавить к ДНК 100 мкл 70%-го этанола комнатной температуры. Мягко встряхнуть пробирку несколько раз, отмывая осадок ДНК и стенки микроцентрифужной пробирки. Центрифугировать при 13000-16000 g 10 мин при комнатной температуре.
12) Осторожно удалить этанол, не задев ДНК. Перевернуть пробирку на чистую фильтровальную бумагу и высушить на воздухе осадок ДНК (ориентировочно 10-15 мин).
13) В пробирку добавить 20 мкл раствора, регидратирующего ДНК ("DNK Rehydration Solution"). Инкубировать при 65 °С 1 ч, слегка постукивая по пробирке. Также можно регидратировать ДНК, инкубируя раствор всю ночь при комнатной температуре или при 4 °С. ДНК можно использовать сразу или хранить при 2-8 °С. Не более 5 суток.
14) Приготовленный вышеизложенным способом раствор ДНК использовать для постановки ПЦР.
Амплификация
Для амплификации фрагмента длиной 300-350 п.н. спейсера ITS1 (internal transcribed spacer) между генами 18S рРНК и 5,8S рРНК использовать следующие олигонуклеотиды (праймеры):
 LITSR: 5’ - CTG GAT CAT TTT CCG ATG - 3’;
LITSR: 5’ - CTG GAT CAT TTT CCG ATG - 3’;
 L5,8S: 5’ - TGA ТАС САС ТТА TCG САС ТТ - 3’.
L5,8S: 5’ - TGA ТАС САС ТТА TCG САС ТТ - 3’.
Концентрацию праймеров для постановки ПЦР следует привести к 10 пкмоль/мкл. Исходные расчетные данные обычно приведены в паспорте на синтетические олигонуклеотиды. В том случае, если известна только оптическая плотность, концентрацию рассчитать по формуле:
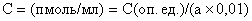 ,
,
где 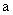 - кол-во пар оснований.
- кол-во пар оснований.
Реакционная смесь для проведения полимеразной цепной реакции представлена в табл.3.
Примечание. Также можно добавить 2,7% ДМСО от финального объема реакционной смеси. В этом случае в равном объеме уменьшить количество вносимой деионизированной воды.
Таблица 3
Реакционная смесь для ПЦР
| N п/п | Реактивы | Объем реакционной смеси, мкл
| |
| 50 | 30 | ||
| 1 | Деионизированная вода | 31,8 | 17,5 |
| 2 | Буфер для полимеразной цепной реакции с  (10 (10 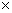 ) )
| 5 | 3 |
| 3 | Смесь дезоксинуклеозидтрифосфатов (2,5 мМ) | 4 | 2,4 |
| 4 | Праймер 1 (LITSR) | 2,5 | 1,5 |
| 5 | Праймер 2 (L5,8S) | 2,5 | 1,5 |
| 6 | Taq-полимераза (5 Ед/мкл) | 0,2 | 0,1 |
1) Для приготовления общей реакционной смеси реактивы в пробирку типа Эппендорф вносить на холоде (для этой цели целесообразно использовать настольный кулер для пробирок).
2) Реакционную смесь приготовить на необходимое количество проб, но не менее чем на 5 (оптимальный рабочий раствор для биологических образцов).
3) В пробирки для проведения ПЦР разлить из общей реакционной смеси по 46 мкл (или по 26 мкл в зависимости от выбора исполнителя).
4) В каждую пробирку для проведения ПЦР с реакционной смесью добавить 4 мкл раствора ДНК. Содержимое пробирки перемешать, центрифугировать для того, чтобы сбросить капли на дно пробирки (не более 30 с при 3000 об./мин).
5) При использовании амплификатора, не имеющего нагреваемую крышку, в каждую пробирку добавить каплю минерального масла (17-20 мкл).
6) На каждую партию (10-20 образцов) обязательно приготовить следующие пробы:
 отрицательный контроль - дистиллированная вода, для проверки качества амплификации;
отрицательный контроль - дистиллированная вода, для проверки качества амплификации;
 положительный контроль - использовать ДНК лейшмании, отличную от ожидаемой в анализе (если исследуются человеческие образцы, следует использовать ДНК не паразитирующих на человеке лейшманий, например L. turanica);
положительный контроль - использовать ДНК лейшмании, отличную от ожидаемой в анализе (если исследуются человеческие образцы, следует использовать ДНК не паразитирующих на человеке лейшманий, например L. turanica);
 контроль ингибирования - 2 мкл ДНК, использованной в положительном контроле и 2 мкл ДНК исследуемого образца. Сравнение интенсивности полос позитивного контроля и контроля ингибирования укажет на ингибирование ПЦР или его отсутствие.
контроль ингибирования - 2 мкл ДНК, использованной в положительном контроле и 2 мкл ДНК исследуемого образца. Сравнение интенсивности полос позитивного контроля и контроля ингибирования укажет на ингибирование ПЦР или его отсутствие.
Исследуемые образцы
Условия амплификации представлены в табл.4.
Таблица 4
Условия амплификации
| Стадия | Температура, °С | Время | Число циклов |
| Начальная денатурация | 95 | 2 мин | 1 |
| Денатурация | 95 | 20 с | 40 |
| Отжиг праймеров | 53 | 30 с | |
| Удлинение | 72 | 1 мин | |
| Достройка | 72 | 6 мин | 1 |
| Хранение | 6 | 1 |
После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
Дата добавления: 2019-02-12; просмотров: 234; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
