Геморрагическая омская лихорадка
Исторические сведения. Геморрагическая омская лихорадка впервые описана в 1945–1948 гг. в ходе эпидемической вспышки в Омской и Новосибирской областях. С 1958 г. в связи с депрессией переносчика регистрация случаев болезни наблюдается редко.
Этиология. Возбудитель – вирус омской лихорадки рода Flavivirus, семейства Togaviridae.
Эпидемиология. Омская геморрагическая лихорадка – природно‑очаговьгй вироз. Резервуар вирусов – ондатры, водяные крысы и другие грызуны. Переносчики – клещи Dermacentor pictus, возможно, другие клещи этого рода, гамазовые клещи и блохи.
Заражение человека происходит при контакте с инфицированными ондатрами, через укусы клещей, воздушно‑пылевым путем в лабораторных условиях.
Наибольшая частота заболеваний обычно наблюдается в летние месяцы в период активности клещей.
Патогенез и патологоанатомическая картина. Изучены недостаточно. В результате вирусемии и гематогенной диссеминации вирусов развиваются характерный капилляротоксикоз, поражение центральной и вегетативной нервной системы, эндокринной системы (надпочечники). В ходе болезни формируется стойкий иммунитет.
Клиническая картина. Инкубационный период составляет 3–10 дней. Начальный период болезни протекает остро, с высокой лихорадкой, потрясающими ознобами, головной болью и миалгиями. Отмечаются разлитая гиперемия лица и шеи, яркая инъекция сосудов склер и конъюнктивы. С первых дней болезни можно выявить петехиальные элементы на слизистой оболочке полости рта, в зеве и на конъюнктивах.
|
|
|
В отличие от крымской геморрагической лихорадки геморрагическая экзантема при омской лихорадке отмечается непостоянно (у 20–25 % больных), реже наблюдается массивное кровотечение из желудочно‑кишечного тракта и других органов.
В период разгара болезни возможно развитие менингоэнцефалита. У 30 % больных выявляют атипичную пневмонию или бронхит; часто обнаруживается гепатомегалия. У некоторых больных можно отметить преходящую протеинурию.
Лихорадочный период составляет 4–12 дней, в последних случаях лихорадка часто бывает двухволновой.
В гемограмме – лейкопения с нейтрофильным сдвигом влево, тромбоцитопения, отсутствие эозинофилов. В период второй температурной волны возможен нейтрофильный лейкоцитоз.
Прогноз. Заболевание характеризуется благоприятным течением и относительно невысокой летальностью (0,5–3 %).
Диагностика и лечение. Аналогичны таковым при крымской‑конго геморрагической лихорадке.
Желтая лихорадка
Желтая лихорадка (febres flava) – острая вирусная природно‑очаговая болезнь с трансмиссивной передачей возбудителя через укус комаров, характеризующаяся внезапным началом, высокой двухфазной лихорадкой, геморрагическим синдромом, желтухой и гепаторенальной недостаточностью. Болезнь распространена в тропических регионах Америки и Африки.
|
|
|
Желтая лихорадка относится к болезням, предусмотренным Международными медико‑санитарными правилами, подлежит регистрации в ВОЗ.
Исторические сведения. Желтая лихорадка известна в Америке и Африке с 1647 г. В прошлом инфекция нередко принимала характер тяжелых эпидемий с высокой летальностью. Вирусная природа и передача вируса комарами Aedes aegypti установлена К.Финлеем и Комиссией У.Рида в 1901 г. на Кубе. Искоренение этого вида комаров обеспечило исчезновение городских очагов инфекции на Американском континенте. Вирус желтой лихорадки был выделен в 1927 г. в Африке.
Этиология. Возбудитель – вирус желтой лихорадки (flavivirus febricis) – относится к роду flavivirus, семейству Тоgaviridae.
Эпидемиология. Выделяют два эпидемиологических вида очагов желтой лихорадки – природные, или джунглевые, и антропоургические, или городские.
Резервуаром вирусов в случае джунглевой формы являются обезьяны мармозеты, возможно, грызуны, сумчатые, ежи и другие животные.
|
|
|
Переносчиком вирусов в природных очагах желтой лихорадки являются комары Aedes simpsoni, А. аfricanus в Африке и Наеmagogus sperazzini и др. в Южной Америке. Заражение человека в природных очагах происходит через укус инфицированного комара А. simpsoni или Наеmagogus, способного передавать вирус через 9–12 дней после заражающего кровососания.
Источником инфекции в городских очагах желтой лихорадки является больной человек в периоде вирусемии. Переносчиками вирусов в городских очагах являются комары Aedes aegypti.
Заболеваемость в джунглевых очагах обычно спорадическая и связана с пребыванием или хозяйственной деятельностью человека в тропических лесах. Городская форма протекает в виде эпидемий.
В настоящее время регистрируются спорадическая заболеваемость и локальные групповые вспышки в зоне тропических лесов в Африке (Заир, Конго, Судан, Сомали, Кения и др.), Южной и Центральной Америке.
Патогенез и патологоанатомическая картина. Инокулированный вирус желтой лихорадки гематогенно достигает клеток системы макрофагов, реплицируется в них в течение 3–6, реже 9–10 дней, затем вновь проникает в кровь, обусловливая вирусемию и клиническую манифестацию инфекционного процесса. Гематогенная диссеминация вируса обеспечивает его внедрение в клетки печени, почек, селезенки, костного мозга и других органов, где развиваются выраженные дистрофические, некробиотические и воспалительные изменения. Наиболее характерны возникновение очагов колликвационного и коагуляционного некрозов в мезолобулярных отделах печеночной дольки, формирование телец Каунсилмена, развитие жировой и белковой дистрофии гепатоцитов. В результате указанных повреждений развиваются синдромы цитолиза с повышением активности АлАТ и преобладанием активности АсАТ, холестаза с выраженной гипербилирубинемией.
|
|
|
Наряду с поражением печени для желтой лихорадки характерно развитие мутного набухания и жировой дистрофии в эпителии канальцев почек, возникновение участков некроза, обусловливающих прогрессирование острой почечной недостаточности.
При патологоанатомическом исследовании обращают на себя внимание багрово‑цианотичная окраска кожных покровов, распространенная желтуха и геморрагии в коже и на слизистых оболочках. Размеры печени, селезенки и почек увеличены, в них выявляются признаки жировой дистрофии. В слизистой оболочке желудка и кишечника определяются множественные эрозии и геморрагии. Помимо изменений в печени, закономерно обнаруживают дистрофические изменения в почках, миокарде. Часто выявляются геморрагии в периваскулярных пространствах головного мозга; поражается и сердечно‑сосудистая система.
При благоприятном течении болезни формируется стойкий иммунитет.
Клиническая картина. В течении болезни выделяют 5 периодов. Инкубационный период длится 3–6 дней, реже удлиняется до 9–10 дней.
Начальный период (фаза гиперемии) протекает в течение 3–4 дней и характеризуется внезапным повышением температуры тела до 39–41 °С, выраженным ознобом, интенсивной головной болью и разлитыми миалгиями. Как правило, больные жалуются на сильные боли в поясничной области, у них отмечаются тошнота и многократная рвота. С первых дней болезни у большинства больных наблюдаются резко выраженная гиперемия и одутловатость лица, шеи и верхних отделов груди. Сосуды склер и конъюнктивы ярко гиперемированы («кроличьи глаза»), отмечаются фотофобия, слезотечение. Часто можно наблюдать прострацию, бред, психомоторное возбуждение. Пульс обычно учащен, в последующие дни развиваются брадикардия и гипотензия. Сохранение тахикардии может свидетельствовать о неблагоприятном течении болезни. У многих увеличена и болезненна печень, а в конце начальной фазы можно заметить иктеричность склер и кожи, наличие петехий или экхимозов.
Фаза гиперемии сменяется кратковременной (от нескольких часов до 1–1,5 сут) ремиссией с некоторым субъективным улучшением. В ряде случаев в дальнейшем наступает выздоровление, однако чаще следует период венозных стазов.
Состояние больного в этот период заметно ухудшается. Вновь до более высокого уровня повышается температура, нарастает желтуха. Кожные покровы бледные, в тяжелых случаях цианотичные. На коже туловища и конечностей появляется распространенная геморрагическая сыпь в виде петехий, пурпуры, экхимозов. Наблюдаются значительная кровоточивость десен, многократная рвота с кровью, мелена, носовые и маточные кровотечения. При тяжелом течении болезни развивается шок. Пульс обычно редкий, слабого наполнения, артериальное давление неуклонно снижается; развиваются олигурия или анурия, сопровождающиеся азотемией. Нередко наблюдается токсический энцефалит.
Смерть больных наступает в результате шока, печеночной и почечной недостаточности на 7–9‑й день болезни.
Продолжительность описанных периодов инфекции составляет в среднем 8–9 дней, после чего заболевание переходит в фазу реконвалесценции с медленной регрессией патологических изменений.
Среди местных жителей эндемичных районов желтая лихорадка может протекать в легкой или абортивной форме без желтухи и геморрагического синдрома, что затрудняет своевременное выявление больных.
При лабораторных исследованиях в начальной фазе болезни обычно отмечаются лейкопения со сдвигом лейкоцитарной формулы влево до промиелоцитов, тромбоцитопения, а в период разгара – лейкоцитоз и еще более выраженная тромбоцитопения, повышение показателей гематокрита, гиперкалиемия, азотемия; в моче – эритроциты, белок, цилиндры.
Выявляются гипербилирубинемия и повышение активности аминотрансфераз, преимущественно АсАТ.
Прогноз, В настоящее время летальность от желтой лихорадки приближается к 5 %.
Диагностика. Распознавание болезни основано на выявлении характерного клинического симптомокомплекса у лиц, относящихся к категории высокого риска заражения (невакцинированные люди, посещавшие джунглевые очаги желтой лихорадки на протяжении 1 нед до начала болезни).
Диагноз желтой лихорадки подтверждается выделением из крови больного вируса (в начальном периоде болезни) или антител к нему (РСК, НРИФ, РТПГА) в более поздние периоды болезни.
Дифференциальная диагностика. Проводят с другими видами геморрагических лихорадок, вирусным гепатитом, малярией.
Лечение. Больных желтой лихорадкой госпитализируют в стационары, защищенные от проникновения комаров; проводят профилактику парентерального заражения.
Терапевтические мероприятия включают комплекс противошоковых и дезинтоксикационных средств, коррекцию гемостаза. В случаях прогрессирования печеночно‑почечной недостаточности с выраженной азотемией проводят гемодиализ или перитонеальный диализ.
Профилактика. Специфическую профилактику в очагах инфекции осуществляют живой аттенуированной вакциной 17 Д и реже – вакциной «Дакар». Вакцина 17 Д вводится подкожно в разведении 1:10 по 0,5 мл. Иммунитет развивается через 7–10 дней и сохраняется в течение б лет. Проведение прививок регистрируется в международных сертификатах. Непривитые лица из эндемичных районов подвергаются карантину в течение 9 дней.
Энцефалиты вирусные
Энцефалит клещевой весенне‑летний
Син.: клещевой энцефалит, таежный энцефалит, русский дальневосточный энцефалит, весенне‑летний менингоэнцефалит, клещевой энцефаломиелит и др.
Энцефалит клещевой (encephalitis acarina) – вирусная природно‑очаговая трансмиссивная болезнь с преимущественным поражением ЦНС.
Переносчиками вирусов являются иксодовые клещи. Известны три нозогеографических варианта болезни – восточный, западный и двухволновый (двухволновая молочная лихорадка), различающиеся по ряду клинико‑эпидемиологических параметров.
Исторические сведения. Тяжелые заболевания, сопровождающиеся поражением ЦНС и приводившие к высокой летальности, стали отмечаться, начиная с 1932 г., в ряде районов таежной зоны Дальнего Востока. В 1935 г. А.Г. Панов установил клиническую самостоятельность болезни, отнес ее к энцефалиту В. Комплексные экспедиции Наркомздрава СССР, руководимые Л.А.Зильбером, Е.Н.Павловским, А.А.Смородинцевым, И.И.Рогозиным в 1937–1941 гг., выявили 29 штаммов возбудителей энцефалита, установили роль иксодовых клещей как переносчиков вирусов, изучили в общих чертах эпидемиологические особенности инфекции, ее клинические проявления, патоморфологию, разработали методы специфической профилактики и лечения болезни. В 1951–1954гг. А.А.Смородинцевым, М.П.Чумаковым и др. в западных районах СССР была описана своеобразная нозогеографическая форма клещевого энцефалита – двухволновая молочная лихорадка (Самостоятельность двухволновой молочной лихорадки, установленная А.А.Смородинцевым в 1951–1955 гг., в настоящее время многими исследователями подвергается сомнению).
Этиология. Возбудитель клещевого энцефалита относится к комплексу вирусов клещевого энцефалита роду Flavivirus, семейству Тоgaviridае, экологической группы Arboviruses. Вирусы имеют вид круглых частиц размером 25–40 им, содержат РНК, окруженную белковой оболочкой. Введение в эксперименте вирусной РНК животным вызывает у них болезнь, аналогичную вызываемой полным вирусом. Различают восточные («персулькатные») и западные («рицинусные») антигенные варианты вирусов, вызывающих различные нозогеографические формы клещевого энцефалита.
Вирус культивируется на куриных эмбрионах и клеточных культурах различного происхождения.
Из лабораторных животных наиболее чувствительны к вирусу белые мыши, сосунки хлопковых крыс, хомяки, обезьяны, из домашних животных – овцы, козы, поросята и лошади.
Вирус клещевого энцефалита обладает различной степенью устойчивости к факторам внешней среды: при нагревании до 60°С он погибает через 10 мин, а при кипячении – через 2 мин. Вирус быстро разрушается при ультрафиолетовом облучении, воздействии лизола и хлорсодержащих препаратов.
Антигенные свойства вирусов клещевого энцефалита отличаются от свойств других арбовирусов, что используется для серологической идентификации клещевого энцефалита.
Эпидемиология. Клещевой энцефалит – трансмиссивная природно‑очаговая инфекция.
Основными резервуарами и переносчиками возбудителей являются иксодовые клещи Ixodes persulcatus, преобладающие в восточных районах России, и Ixodes ricinus, обитающий преимущественно в западных районах России и ряде европейских стран, а также некоторые другие виды иксодовых и гамазовых клещей. Спустя 5–6 дней после кровососания на инфицированном животном вирус проникает во все органы клеща, концентрируясь в половом аппарате, кишечнике, слюнных железах, сохраняется в течение всей жизни членистоногого (2–4 года), что определяет механизм заражения животных и человека и трансовариальную и трансфазовую передачу вируса у клещей. В различных очагах болезни инфицированность клещей достигает 1–3 %, а в отдельные годы – 15–20 %.
Дополнительными резервуарами вирусов клещевого энцефалита являются около 130 видов грызунов и других диких млекопитающих – «прокормителей» клещей: ежи, кроты, белки, бурундуки, полевки, белозубки и т.д., а также некоторые птицы: рябчики, поползни, зяблики, дрозды и др.
Человек наиболее часто заражается клещевым энцефалитом трансмиссивным путем через укус вирусофорного клеща; вероятность заражения возрастает с увеличением длительности кровососания. Раздавливание клещей в процессе их удаления и занесение вирусов на слизистые оболочки глаза или на поврежденные участки также могут привести к заражению в естественных и лабораторных условиях. Существует алиментарный путь заражения человека клещевым энцефалитом при употреблении в пищу сырого козьего или коровьего молока.
Зона обитания основных резервуаров вирусов определяет границы очагов инфекции.
Выделяют три типа очагов болезни: I тип – природные очаги в условиях дикой природы; II тип – переходные очаги с измененным составом компонентов биоценоза как результат хозяйственной деятельности человека; III тип – антропоургические (вторичные) очаги на территориях вблизи населенных пунктов, где прокормителями клещей, кроме грызунов, становятся и домашние животные. В зависимости от биотических и абиотических факторов выделяют 7 групп очаговых регионов. Очаги клещевого энцефалита известны в таежной зоне Дальнего Востока, в лесных районах Сибири, Урала, Восточного Казахстана, европейской части России, в Чехии, Словакии, Болгарии, Австрии, Венфии, Польше, Швеции, Финляндии.
Заболеваемость клещевым энцефалитом имеет сезонный характер, достигая максимума в мае – июне. Второй, менее выраженный подъем заболеваемости наблюдается в конце лета – начале осени, что обусловлено численностью и активностью клещей в природе.
Патогенез и патологоанатомическая картина. Входными воротами инфекции при трансмиссивном заражении служит кожа, а при алиментарном – слизистая оболочка пищеварительного тракта.
После репликации в области входных ворот вирус гематогенно и лимфогенно диссеминирует в лимфатические узлы, внутренние органы и достигает ЦНС, где оказывает прямое действие на нервные клетки и индуцирует мезенхимально‑воспалительную реакцию, усиливающую патогенный эффект вируса. При алиментарном заражении вначале наблюдается висцеральная фаза с вирусемией и репликацией вируса во внутренних органах, а в дальнейшем возникает вторичная вирусемия с поражением ЦНС (двухволновой менингоэнцефалит). В ряде случаев процесс принимает хроническое прогредиентное течение с профессированием морфологических повреждений.
В патологический процесс вовлекается серое вещество головного и спинного мозга, в особенности двигательные нейроны спинного и ствола головного мозга. Наблюдается поражение нервной ткани в среднем мозге, таламической и гипоталамической областях, в коре головного мозга и мозжечка. В корешках периферических нервов развивается картина интерстициального неврита. Закономерно происходит поражение мягких оболочек мозга.
При вскрытии часто обнаруживаются отечность мозговых оболочек и вещества мозга, расширение и полнокровие сосудов, геморрагии, признаки нарушения ликворо– и гемодинамики. Уже в ранней, предпаралитической фазе болезни отмечаются пролиферация микроглии, феномен нейрофагии. Наиболее выраженные некробиотические процессы развиваются в передних рогах шейного отдела спинного мозга, в ядрах черепных нервов и ретикулярной субстанции.
Обычно отмечается полнокровие внутренних органов, нередки кровоизлияния в серозные оболочки, слизистую оболочку желудка, дыхательных путей, кишечника.
При остром течении процесса наблюдается медленная репарация повреждений и формируется стойкий иммунитет. Нарушения иммунного статуса определяют неуклонно прогрессирующее течение болезни со стойкими необратимыми парезами и параличами.
Клиническая картина. Инкубационный период продолжается 3–21 день, в среднем 10–14 дней.
В течении болезни различают начальную фазу, протекающую с преобладанием общетоксического синдрома, фазу неврологических расстройств, характеризующуюся различными вариантами поражения центральной и периферической нервной системы, и фазу исходов (выздоровление с постепенным восстановлением или сохранением остаточных неврологических нарушений, формирование прогредиентных хронических вариантов или гибель больных).
В зависимости от глубины и выраженности неврологических расстройств выделяют лихорадочную, менингеальную, менингоэнцефалитическую, менингоэнцефалополиомиелитическую и полирадикулоневритическую формы болезни. Лихорадочная и менингеальная формы являются основными при западных вариантах клещевого энцефалита, паралитические формы преобладают при восточном варианте болезни.
По степени тяжести клинической картины болезни выделяются следующие типы клещевого энцефалита: 1) заболевание с абортивным течением (или легкая форма болезни), лихорадкой в течение 3–5 дней, преходящими признаками серозного менингита и выздоровлением в течение 3–5 нед;
2) заболевания средней тяжести, протекающие с менингеальными и общемозговыми симптомами, имеющими доброкачественную динамику с выздоровлением в течение 1,5–2 мес;
3) тяжелые формы с высокой летальностью, затяжным и неполным выздоровлением, стойкими резидуальными признаками в виде парезов, параличей, мышечной атрофии. Известны молниеносные формы болезни, заканчивающиеся летально в первые сутки заболевания еще до развития характерной клинической картины, а также хронические и рецидивирующие формы клещевого энцефаломиелита.
В 8–15 % случаев болезни наблюдается непродолжительный продром: головная боль, слабость, утомляемость, нарушение сна, корешковые боли, чувство онемения в коже лица или туловища, психические нарушения.
Болезнь, как правило, развивается остро, внезапно. Возникает высокая лихорадка с подъемом температуры до 39–40,5 °С продолжительностью 3–12 дней, отмечаются жар, ознобы, мучительная головная боль, ломящие боли в конечностях, поясничной области, тошнота, повторная рвота, общая гиперестезия, фотофобия, боль в глазных яблоках.
Обычно с 3–4‑го дня, а иногда и в первые часы болезни наблюдаются признаки очагового поражения ЦНС: парестезии, парезы конечностей, диплопия, эпилептиформные судороги. Сознание в первые дни болезни сохранено, но больные заторможены, безучастны к окружающему, сонливы. Изредка наблюдаются оглушенность, бред, возможны сопор и кома.
В остром периоде лицо больных гиперемировано, инъецированы сосуды склер и конъюнктивы, отмечается гиперемия кожи шеи и груди. Характерны брадикардия, приглушенность сердечных тонов, артериальная гипотензия. Выявляются электрокардиографические признаки нарушения проводимости, стойкие, но обратимые признаки дистрофии миокарда. Тяжелая миокардиодистрофия может обусловить развитие у больных картины острой сердечной недостаточности, ведущей к смертельному исходу болезни.
Часто отмечаются гиперемия слизистой оболочки верхних дыхательных путей, учащение дыхания, одышка. Нередко выявляются ранние и поздние пневмонии; последние, протекающие на фоне нарушения центральной регуляции дыхания и кровообращения, прогностически неблагоприятны.
Характерны изменения пищеварительной системы в виде обложенности языка, при этом часто бывают тремор языка, вздутие живота и задержки стула. В случаях алиментарного заражения часто отмечается гепатолиенальный синдром.
В остром периоде наблюдаются нейтрофильный лейкоцитоз (до 10,0–20,0 * 10^9 /л), увеличение СОЭ, гипогликемия, транзиторная протеинурия.
Лихорадочная форма клещевого энцефалита характеризуется доброкачественным течением и ограничивается развитием общетоксического синдрома.
Менингеальная форма протекает доброкачественно с развитием общетоксического синдрома и признаков серозного менингита. Характерно возникновение высокой лихорадки, сильной головной боли в теменно‑затылочной области, усиливающейся при движении, повторной рвоты на высоте головной боли, фотофобии, гиперакузии и гиперестезии кожи, неравномерности сухожильных рефлексов. С первых дней болезни выявляются оболочечные симптомы: ригидность мышц затылка, симптомы Кернига, Брудзинского и др., сохраняющиеся в течение 2–3 нед. У некоторых больных могут наблюдаться преходящие энцефалитические симптомы.
При исследовании цереброспинальной жидкости – повышение ее давления до 200–400 мм вод.ст., лимфоцитарный умеренный плеоцитоз, незначительное повышение уровня белка, глюкозы и хлоридов.
Менингоэнцефалитическая форма болезни характеризуется развитием диффузного или очагового поражения головного мозга.
При диффузном клещевом менингоэнцефалите, кроме общетоксических и менингеальных симптомов, рано выявляется нарушение сознания больных от легкой заторможенности до глубокого сопора и комы. При благоприятном прогнозе сознание проясняется через 10–12 дней, но сохраняется сонливость. У части больных в остром лихорадочном периоде наблюдаются бред, галлюциноз, психомоторное возбуждение с утратой ориентации во времени и обстановке. В первые дни болезни отмечаются двигательные расстройства в виде парциальных или генерализованных единичных или многократных эпилептиформных припадков, что обычно ухудшает прогноз. Часто наблюдаются фибриллярные подергивания мышц лица и конечностей, тремор рук, угнетение глубоких рефлексов, снижение мышечного тонуса.
При очаговом менингоэнцефалите клинические проявления определяются зоной поражения ЦНС. Поражение белого вещества одного из полушарий головного мозга влечет возникновение спастических парезов правых или левых конечностей и парезов лицевого и подъязычного нервов с той же стороны. При локализации процесса в левом полушарии возникает также расстройство речи.
Поражение белого вещества в стволовом отделе мозга приводит к развитию пареза черепных нервов на стороне очага воспаления и пареза конечностей на противоположной стороне тела (альтернирующий синдром). В периоде реконвалесценции двигательные нарушения восстанавливаются в течение 2–3 мес.
Наряду с симптомами выпадения двигательных функций могут наблюдаться гиперкинезы в виде клонических судорог конечностей или части тела. В отдельных случаях стойкие миоклонические гиперкинезы в сочетании с эпилептиформными припадками входят в синдром кожевниковской эпилепсии. Возможны приступы джексоновской эпилепсии. Корковая и стволовая локализация поражения приводят к тикообразным и хореиформным подергиваниям мышц.
Характерным признаком клещевого энцефалита является сочетанное пражение черепных нервов, обусловленное повреждением серого вещества головного мозга. Черепные нервы вовлекаются в патологический процесс с различной частотой.
Наблюдается поражение глазодвигательных нервов и симпатической иннервации глаза, приводящие к птозу, косоглазию и диплопии. Нередко отмечается парез лицевого нерва, реже страдают зрительный, слуховой и вестибулярный нервы.
Распространение процесса на область ядер IX, X, XII пар черепных нервов, столь характерное для клещевого энцефалита, приводит к возникновению ранних бульбарных симптомов: парезу мягкого неба, гнусавости голоса, смазанности речи, афонии, нарушению глотания, повышению саливации с заполнением слизью дыхательных путей, тахикардии, диспноэ. Частота бульбарных расстройств достигает 25 %.
Менингоэнцефалополиомиелитическая форма болезни характеризуется наряду с общетоксическим и менингеальным синдромами возникновением признаков диффузного энцефалита, очагового энцефалита и поражения серого вещества спинного мозга. Последние относятся к типичным клиническим признакам болезни, возникают уже в первые дни заболевания и спустя 3–4 дня становятся наиболее выраженными.
У больных развиваются ранние вялые парезы мышц шеи, туловища, конечностей, симметрично поражающие мускулатуру шеи, плечевого пояса, верхних конечностей, иногда межреберную мускулатуру и диафрагму. Двигательные нарушения нижних конечностей выявляются редко и выражены незначительно, но известны и параличи восходящего типа, начинающиеся с нижних конечностей и затем распространяющиеся на туловище и верхние конечности. В период исходов болезни наряду с парезами наблюдается резко выраженная атрофия мышц, особенно дельтовидных, трапециевидных, двуглавых, трехглавых и грудных. При этом голова не удерживается в вертикальном положении, пассивно свисает, движения верхних конечностей почти полностью утрачиваются. Мышечная атрофия наблюдается и в случаях реконвалесценции с исчезновением парезов.
Полирадикулоневритическая форма клещевого энцефалита, наблюдаемая у 2–4 % больных, проявляется наряду с общетоксическими и менингеальными симптомами признаками поражения корешков и периферических нервов. Характерны парестезии в виде «ползания мурашек», покалывания в коже различных участков, боли по ходу нервных стволов, положительные симптомы «натяжения» (Лассега и др.), расстройство чувствительности в дистальных отделах конечностей по типу «перчаток» и «носков».
Двухволновой менингоэнцефалит (двухволновая молочная лихорадка), регистрируемый в европейских очагах клещевого энцефалита, характеризуется развитием двухфазной температурной реакции, продолжительностью каждая 2–15 дней с интервалом 1–2 нед, преобладанием общетоксического синдрома в ходе первой температурной волны и развитием менингеальных и общемозговых признаков при повторном повышении температуры тела с быстрой положительной динамикой и выздоровлением без остаточных явлений.
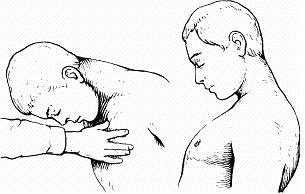
Рис. Остаточные явления после перенесенного клещевого энцефалита (паралич шейных мышц).
Диагностика. Клиническая диагностика клещевого энцефалита основывается на комплексе эпидемиологических и клинико‑лабораторных данных, выявляющих характерные синдромы болезни.
Специфическая диагностика болезни проводится с помощью вирусологических и серологических методов. Вирусологический метод предполагает выделение вируса из крови и цереброспинальной жидкости больного (в первые 5–7 дней болезни) или головного мозга умерших людей – путем внутримозгового заражения новорожденных белых мышей исследуемым материалом, а также с использованием культуры клеток и последующей идентификацией вируса с помощью метода флюоресцирующих антител (МФА).
Наряду с вирусологическими широко применяют серологические методы верификации диагноза с использованием РСК, РДПА, РПГА, ИФА, РН в парных сыворотках крови больных, взятых с интервалом 2–3 нед.
Дифференциальная диагностика. Проводится с менингитами и энцефалитами иного генеза, полиомиелитом, сосудистыми поражениями головного мозга, комами различного генеза, опухолями ЦНС, абсцессами головного мозга.
Лечение. Комплексная терапия клещевого энцефалита включает специфические, патогенетические и симптоматические средства. Для специфической терапии применяют противоэнцефалитный донорский иммуноглобулин, вводимый внутримышечно ежедневно по 3–12 мл в течение 3 дней. При тяжелой форме болезни препарат вводят 2 раза в сутки в дозе 6‑12 мл с интервалом 12 ч, в последующие дни – 1 раз в день. При появлении второй волны лихорадки требуется повторное введение препарата.
Одновременно проводят дезинтоксикационную, дегидратационную терапию, при тяжелом течении болезни – противошоковую, назначают кортикостероиды, осуществляют борьбу с дыхательной недостаточностью. При судорожном синдроме применяют 25 % раствор сульфата магния, реланиум, натрия оксибутират, барбитураты и другие седативные средства. В периоде стихания острых проявлений болезни назначают витамины группы В, прозерин, дибазол, антигистаминные препараты. Выписка больных производится через 2–3 нед: после нормализации температуры, при отсутствии неврологических расстройств. Реконвалесценты подлежат диспансеризации.
Профилактика. В очагах клещевого энцефалита применяют комплекс мероприятий по защите населения от нападения клещей (противоклещевые комбинезоны, репелленты – диметил– и дибутилфталаты), проводят взаимоосмотры с удалением и уничтожением обнаруженных клещей. После удаления присосавшихся клещей применяют специфический донорский иммуноглобулин (взрослым по 3 мл внутримышечно). Не рекомендуется использовать в пищу некипяченое молоко.
Специфическая профилактика проводится по эпидемическим показаниям за 1–1,5 мес до сезона активности клещей. Тканевую инактивированную или живую аттенуированную вакцины вводят по 1 мл под кожу трехкратно с интервалами от 3 мес до 1 года с последующей ежегодной ревакцинацией по 1 мл вакцины.
Энцефалит японский
Син.: комариный энцефалит, осенний энцефалит, энцефалит В
Энцефалит японский (encephalitis japonica) – острая вирусная трансмиссивная природно‑очаговая болезнь, протекающая с развитием тяжелого менингоэнцефалита и общетоксического синдрома, отличается высокой летальностью.
Исторические сведения. Эпидемические вспышки болезни с летальностью до 60 % описывались в Японии с 1871 г. В 1924–1925 гг. Футаки, а также Р.Канеко и И.Аоки выделили заболевание в самостоятельную нозоформу. В 1933–1936 гг. Хаиаши выделил вирус и установил его передачу при укусе комара.
В России японский энцефалит описан А.А.Смородинцевым, А.К.Шубладзе, П.А.Петрищевой и М.Б.Кролем в 1938 г. в Южном Приморье.
Этиология. Возбудитель японского энцефалита – вирус рода Flavivirus, семейства Togaviridae, экологической группы Arboviruses является РНК‑содержащим вирусом размером 15–50 нм, относится к термолабильным вирусам: инактивируется при нагревании до 56 °С через 30 мин, при кипячении – через 2 мин, но в лиофилизированном состоянии сохраняется неограниченно долго. По антигенным свойствам близок к вирусам энцефалита Сан‑Луи и Западного Нила.
К вирусу чувствительны обезьяны, белые мыши, хомяки, полевки, некоторые домашние животные и птицы.
Эпидемиология. Японский энцефалит – трансмиссивная природно‑очаговая инфекция. Резервуаром вирусов являются дикие и домашние млекопитающие и птицы.
Механизм заражения – трансмиссивный, через укус комаров. Основными переносчиками являются комары Culex tritaeniarhynhus, С.рipiens, С. bitaeniarhunchus, Аеdes japonicus, Аеdes togoi у которых предполагается трансовариальная передача вирусов.
Различают природные и антропургические очаги инфекции. В природных очагах (луговых, морских, прибрежных и лесных) резервуаром вирусов служат дикие животные (грызуны, птицы), возможно иксодовые, гамазовые и краснотелковые клещи.
В антропургических (сельских и городских) очагах в эпидемическую цепь включаются домашние животные (свиньи, овцы, коровы, лошади, домашняя птица и др.) и человек.
Японскому энцефалиту свойственна четкая сезонность с повышением заболеваемости в августе – сентябре, продолжительность вспышек не превышает 40–50 дней. Вспышкам болезни предшествуют жаркая погода и обилие осадков, с образованием большого числа временных водоемов – мест выплода комаров.
Восприимчивость к болезни высокая во всех возрастных группах, в сельских очагах болеют преимущественно мужчины, работающие вблизи заболоченных водоемов.
В эндемичных районах часто выявляются латентные формы инфекции с формированием стойкого иммунитета.
Природные и антропургические очаги болезни выявлены в Приморском крае и на Дальнем Востоке, в Японии, Восточном и Среднем Китае, Индии, Корее, Вьетнаме, на Филиппинах и некоторых других территориях Юго‑Восточной Азии.
Патогенез и патологоанатомическая картина. Из места инокуляции вирусы гематогенно диссеминируют по всем системам и органам человека, вызывая поражение эндотелия микрососудов с развитием серозно‑геморрагического интерстициального отека и геморрагии в миокарде, почках, печени, желудочно‑кишечном тракте и других органах.
Вследствие нейротропности вируса, а также в результате иммунопатологических реакций, наиболее глубокие морфофункциональные изменения развиваются в ЦНС. Характерны формирование периваскулярных инфильтратов, появление отека и геморрагии в сером и белом веществе головного мозга и мозговых оболочках, возникновение циркуляторных расстройств и некротических очагов преимущественно в области базальных ядер, зрительных бугров, лобных долей, мозжечка. Менее значительные изменения возникают в спинном мозге.
При циклическом течении инфекционного процесса постепенно развиваются саногенные и репаративные реакции, формируется стойкий иммунитет.
Клиническая картина. Инкубационный период продолжается 4–21 день, в среднем 8–14 дней. Различают периоды болезни: начальный, разгара и реконвалесценции.
Начальный период, продолжительностью 3–4 дня, развивается остро, обычно без продромальных симптомов: наблюдается внезапный подъем температуры до 39–40°С, даже до 41°С, и на этом уровне она остается 6–10 дней. Кроме температурной реакции, к первичным признакам заболевания относятся озноб, головная боль, особенно в области лба, боли в пояснице, животе, конечностях, тошнота, рвота. Лицо, склеры и верхние отделы грудной клетки гиперемированы. Отмечается повышенная потливость.
Вследствие нарушения функции гипоталамической области учащается пульс до 120–140 уд/мин, повышается артериальное давление, периферические капилляры резко сужаются.
Часто отмечается болезненность мышц и нервных стволов, определяются ригидность мышц затылка, повышение мышечного тонуса, нарушение функции глазодвигательных мышц. Сухожильные рефлексы повышены. При тяжелом течении болезни может наступить смерть больного.
В разгар болезни, с 3–4‑го дня заболевания, возникают и прогрессируют симптомы очагового поражения головного мозга, нарастают признаки менингеального синдрома, отмечается угнетение сознания вплоть до комы, часто бывают психические расстройства: делириозный статус, галлюциноз, бред.
Повышение мышечного тонуса экстрапирамидного и пирамидного характера является причиной вынужденного положения больного в постели: на спине или на боку с запрокинутой головой, согнутыми руками и ногами. Мышечная гипертония распространяется на жевательные и затылочные мышцы. При глубоком поражении пирамидной системы могут возникать спастические гемипарезы, монопарезы и параличи.
Характерны хореиформные гиперкинезы мышц лица, верхних конечностей; при тяжелом течении болезни могут развиваться клонические или тонические судороги, наблюдаются эпилептиформные припадки. У некоторой части больных отмечено возникновение стереотипии, состоящей в многократном повторении одного и того же движения, и каталепсии.
Изменения в двигательной сфере, возникающие в остром периоде болезни, нестойкие; они исчезают по мере улучшения состояния больного. Часто наблюдаются центральные парезы лицевого нерва с асимметрией носогубных складок.
В остром периоде во всех случаях заболевания отмечаются гиперемия диска зрительного нерва, реже кровоизлияние и отек. Нарушается свето– и цветоощущение, сужается поле зрения.
Возможно развитие бронхита и лобарных пневмоний. В гемограмме – нейтрофильный лейкоцитоз (до 15,0–20,0 * 10^9 /л), лимфопения, анэозинофилия, повышение СОЭ до 20–30 мм/ч.
Цереброспинальная жидкость прозрачна, давление ее повышено незначительно, увеличено содержание белка, характерен умеренный лимфоцитарный плеоцитоз.
В период реконвалесценции, продолжительностью 4–7 нед, температура обычно нормальная или субфебрильная. Сохраняются некоторые остаточные симптомы органического поражения головного мозга (гемипарез, нарушения координации движений, мышечная слабость, психические нарушения и др.). Встречаются также поздние осложнения: пневмонии, пиелоциститы, пролежни.
Наряду с тяжелыми наблюдаются и легкие формы японского энцефалита, протекающие без стойкой неврологической симптоматики.
Прогноз. Японский энцефалит – тяжелое заболевание, летальность 25–80 %. Смерть наступает чаще всего в первые 7 дней при коматозном состоянии, бульбарных явлениях, судорожных приступах.
У реконвалесцентов часто выявляются остаточные явления: психические нарушения в виде астенических состояний, снижения интеллекта, психозов, парезы, параличи, гиперкинезы.
Диагностика. Распознавание японского энцефалита основано на совокупности клинических, эпидемиологических и лабораторных данных. Необходимо учитывать острое начало заболевания, раннее появление психических расстройств, богатство симптомов диффузного поражения нервной системы у больных из очагов инфекции в сезон передачи вирусов.
Диагноз подтверждают путем выделения вируса из крови или цереброспинальной жидкости больных и головного мозга погибших (с использованием лабораторных животных или клеточных культур НеLа и др.), а также с помощью серологических тестов – РСК, РТГА, РИ, НРИФ и др.
Дифференциальная диагностика. Проводится с серозными менингитами, клещевым и другими энцефалитами.
Лечение. Больным проводят специфическую и патогенетическую терапию. Специфическую терапию осуществляют в лихорадочный период с помощью иммуноглобулина по 3–6 мл три раза в день ежедневно или сыворотки реконвалесцентов по 20–30 мл, а также гипериммунной лошадиной сыворотки по 15–20 мл внутримышечно или внутривенно в первые 5–7 дней болезни.
Патогенетическая терапия включает дезинтоксикационные и диуретические средства, кортикостероиды, седативные и противосудорожные средства. При нарушении дыхания, сердечно‑сосудистой деятельности и коматозном состоянии проводят реанимационные мероприятия.
Реконвалесценты подлежат длительной диспансеризации с участием невропатолога и психиатра.
Профилактика. В очагах японского энцефалита проводят комплекс противокомариных мероприятий, осуществляют меры по защите от нападения комаров и созданию активного иммунитета у населения.
Иммунизацию проводят по эпидемическим показаниям населению эндемических очагов с помощью формолвакцины. Для экстренной пассивной профилактики применяют однократно 10 мл гипериммунной лошадиной сыворотки или 6 мл иммуноглобулина.
Риккетсиозы
Риккетсиозы – группа острых трансмиссивных болезней человека, вызываемых риккетсиями. Протекают с развитием выраженной интоксикации и генерализованного васкулита, поражениями ЦНС, внутренних органов и характерными высыпаниями на коже.
Возбудители – риккетсии (названные в честь американского исследователя Г.Т.Риккетса, погибшего при изучении сыпного тифа), относятся к семейству Rickettsiасеае, включающему три рода: Rickettsia, Pochalimea, Сохiella.
Различают антропонозные риккетсиозы, возбудители которых циркулируют между человеком и его специфическими эктопаразитами – вшами (эпидемический сыпной тиф, волынская лихорадка), и зоонозные, возбудители которых циркулируют между домашними (в антропургических очагах) или дикими (в природных очагах) животными и кровососущими членистоногими, способными заражать риккетсиями и человека. В связи с трансовариальной передачей риккетсии у акариформных и иксодовых клещей последние являются не только переносчиками, но и стойкими резервуарами инфекции в природных условиях.
Выделяют 6 групп риккетсиозов, из них описаны у человека 5 групп: I – группа сыпного тифа: эпидемический сыпной тиф, эндемический (блошиный) сыпной тиф; II – группа клещевых пятнистых лихорадок: пятнистая лихорадка Скалистых гор, марсельская лихорадка (с нозогеографическими вариантами: южноафриканский и восточноафриканский риккетсиозы), совероазиатский клещевой риккетсиоз, североавстралийский сыпной тиф, осповидный (везикулезный) риккетсиоз; III – группа цуцугамуши: цуцугамуши; IV – группа Ку‑лихорадки: Ку‑лихорадка; V – группа пароксизмальных риккетсиозов: волынская (траншейная) лихорадка, пароксизмальный риккетсиоз.
Дата добавления: 2019-02-12; просмотров: 194; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
