Прогрессирующий краснушный панэнцефалит
Прогрессирующий, краснушный панэнцефалит (ПКПЭ) – медленная инфекция, вызванная вирусом краснухи и характеризующаяся прогрессирующими нарушениями интеллекта и двигательными расстройствами со смертельным исходом.
Впервые заболевание описано в 1974 г. П.Лебон и Ж.Лион, его этиология подтверждена выделением вируса краснухи из мозга больного [Кремер Н.Е. и др., 1975] и из крови [Таунсенд Ж.Ж. и др., 1975]. К настоящему времени описано несколько десятков случаев заболевания, все – у лиц мужского пола в возрасте 8– 19 лет.
В патогенезе ПКПЭ ведущее место занимает персистенция вируса с образованием лимфоцитарных и плазмоклеточных инфильтратов (муфт) вокруг сосудов, образованием глиальных узелков в коре, выпадением нейронов, выраженным астроцитозом в значительной площади серого вещества и особенно сильно выраженным в белом веществе [Браун П., Ашер Д.М., 1985]. Все эти изменения сопровождаются высокими титрами краснушных антител в РСК и РТГА (в цереброспинальной жидкости и сыворотке крови).
Клиническая картина. Постепенно появляются и медленно прогрессируют моторные и психические расстройства. Сенсорные нарушения не описаны. Развивается фасциальный парез, который может сопровождаться подергиванием челюсти, речь замедляется, становится невнятной. Повышается мышечный тонус, развивается клонус стоп, больной не может стоять.
Прогрессирует слабоумие. В терминальной стадии возникают приступы с утратой сознания.
|
|
|
На ЭЭГ видны нарушения во фронтальных проводящих путях [Зуев В.А., 1988].
У некоторых больных ПКПЭ имеются признаки врожденной краснухи, но описаны хорошо документированные случаи, когда больные переносили краснуху не внутриутробно, а в детские годы и до появления симптомов ПКПЭ были здоровы [Волынски Ж.С. и др., 1976].
Лечение. Как и при других медленных инфекциях, не разработано.
Инфекционный лимфоцитоз
Инфекционный лимфоцитоз – острая вирусная инфекция, характеризующаяся полиморфизмом клинической картины с генерализованным микрополилимфаденитом, лейкоцитозом и лимфоцитозом и благоприятным течением.
Исторические сведения. Первое сообщение о заболевании под названием «малосимптомный инфекционный лимфоцитоз» сделал И.А‑Кассирский в 1938 г. О массовой вспышке инфекции среди детей сообщил в 1940 г. А.И.Гаваш. В дальнейшем описания этого заболевания появились за рубежом.
Этиология. Считается, что возбудитель инфекции – лимфотропный вирус (не идентифицирован).
Эпидемиология. Инфекционный лимфоцитоз – антропоноз. Источник инфекции – человек с любой, в том числе бессимптомной, формой заболевания. Механизм передачи – аэрогенный, главный путь передачи – воздушно‑капельный. Чаще выявляется у детей, особенно из закрытых коллективов (детские сады и ясли, школы‑интернаты и пр.), где наблюдаются вспышки заболевания. Характерна весенняя и осенняя сезонность. Распространен повсеместно.
|
|
|
После перенесенного заболевания остается длительный иммунитет, однако описаны единичные случаи повторного заболевания через 2–3 года.
Патогенез и патологоанатомическая картина. Вирус проникает через носо– и ротоглотку, распространяется по лимфатическим путям в регионарные лимфатические узлы, затем в кровь. После вирусемии вирус локализуется в тройном ретикулоэндотелии синусов миндалин, лимфатических узлов, кишечника, печени, селезенки. В пунктате костного мозга лейкемической метаплазии лимфоидного типа не бывает. Соотношение эритронормобластного, мегакариобластного и миелобластного ростков нормальное. В селезенке и лимфатических узлах отмечается лимфатическая и макрофагально‑гистиоцитарная гиперплазия.
Клиническая картина. Инкубационный период составляет 2–3 нед, обычно 11–21 день. Клиническая картина крайне полиморфна. Выделяют следующие формы заболевания: 1) бессимптомная; 2) астеническая; 3) респираторная (ОРЗ‑подобная); 4) гриппоподобная; 5) артралгическая; 6) кожная (экзантемоподобная); 7) аденопатическая; 8) нервная; 9) смешанная.
|
|
|
Большая часть больных переносит заболевание в клинически бессимптомной форме; в таких случаях единственным проявлением инфекции служит гиперлейкоцитоз (от 20 до 140 * 10^9 /л и более) с преобладанием лимфоцитов (до 60–97 % в лейкоцитарной формуле). СОЭ нормальная или умеренно увеличена (15‑30 мм/ч).
Среди других форм чаще встречается смешанная, когда в клинической картине есть те или иные проявления других форм инфекции.
Заболевание начинается остро, с повышения температуры тела до субфебрильных цифр, реже до 38–40 °С. Лихорадочный период продолжается 1–7 дней. Возможны слабость, утомляемость, раздражительность, реже головная боль и головокружение, миалгия, иногда артралгии. В редких случаях больные жалуются на боли в области живота и расслабление стула. На 3–4‑й день болезни у некоторых больных, чаще у детей, появляется эфемерная скарлатиноподобная или кореподобная сыпь. У большинства больных с манифестными формами болезни развивается генерализованный вирусный микрополилимфаденит с увеличением шейных, медиастинальных, мезентериальных и других групп лимфатических узлов. Узлы подвижны, безболезненны, кожа над ними не изменена. Период разгара заболевания продолжается от нескольких дней (от семи) до 2–3 нед. Затем все симптомы постепенно угасают, и наступает выздоровление.
|
|
|
Самый яркий и постоянный признак заболевания – гиперлейкоцитоз и другие гематологические изменения. Они появляются с первых дней инфекционного лимфоцитоза, затем (в течение нескольких дней) нарастают. В последующем гемограмма очень медленно нормализуется – обычно в течение 4–8 нед, а иногда и 3–4 мес, в некоторых случаях до 6–12 мес.
Гиперлейкоцитоз обусловлен абсолютным и относительным лимфоцитозом с преобладанием зрелых узкоцитоплазменных лимфоцитов, наряду с которыми встречаются лимфоретикулярные клетки. При относительной нейтропении абсолютное число нейтрофильных лейкоцитов может оставаться нормальным и даже повышается. С первых дней выявляется эозинофилия – относительная (до 6–20 %) и абсолютная. Красная кровь обычно не изменена. Очень значительные изменения в гемограмме развиваются на фоне нормальной или слегка увеличенной СОЭ, что обращает на себя внимание и выступает как важный дифференциально‑диагностический признак.
Прогноз благоприятный.
Диагностика основывается на оценке картины периферической крови, эпидемиологических данных и полиморфной, обычно нетяжелой симптоматике заболевания, не соответствующей тяжести гематологических изменений. Специфическая диагностика не разработана.
Дифференциальная диагностика. Проводится с инфекционным мононуклеозом, коклюшем (при котором в катаральный период развивается лейкоцитоз с лимфоцитозом), ОРЗ, корью, краснухой, скарлатиной, лейкемоидными реакциями, лимфогранулематозом, острым лимфобластным лейкозом.
Лечение. Этиотропное лечение не разработано. При необходимости проводится патогенетическая (дезинтоксикационная), а также симптоматическая терапия. В крайне редких случаях энцефалитов и менингитов лечение больных проводится по общим правилам терапии этих симптомокомплексов.
Профилактика. Специфической профилактики нет. Выявленные больные подлежат изоляции до прекращения клинических признаков инфекции. За контактными лицами проводят наблюдение с периодическим контролем гемограммы.
В госпитализации необходимости нет. В очаге проводят текущую и заключительную дезинфекцию.
Эпидемический паротит
Син.: свинка, заушница
Эпидемический паротит (parotitis epidemica) – острое вирусное заболевание, характеризующееся лихорадкой, общей интоксикацией, увеличением одной или нескольких слюнных желез, нередко поражением других железистых органов и нервной системы.
Исторические сведения. Эпидемический паротит был описан еще Гиппократом в V в. до н.э. Гамильтон (1790) выделил симптомы поражения ЦНС и орхит как частые проявления заболевания. В конце XIX в. были обобщены данные об эпидемиологии, патогенезе и клинической картине паротита. Большой вклад в изучение этой проблемы внесли отечественные ученые И.В.Троицкий, А.Д.Романов, Н.Ф.Филатов.
В 1934 г. была доказана вирусная этиология заболевания.
Этиология. Возбудитель паротитной инфекции относится к семейству Paramyxoviridae, роду Paramyxovirus, имеет размер 120 х 300 нм. Вирус содержит РНК, обладает гемагглютинирующей, нейраминидазной и гемолитической активностью. Антигенная структура вируса стабильна.
В лабораторных условиях вирус культивируется на 7–8‑дневных куриных эмбрионах и клеточных культурах. Лабораторные животные малочувствительны к возбудителю паротита. В эксперименте только у обезьян удается воспроизвести заболевание, сходное с паротитом человека.
Вирус нестоек, инактивируется при нагревании (при температуре 70 °С в течение 10 мин), ультрафиолетовом облучении, воздействии растворов формалина и лизола малой концентрации. Хорошо сохраняется при низких температурах (–10–70 °С).
Эпидемиология. Источником инфекции является больной человек, в том числе стертой и бессимптомной формой паротита. Больной заразен в последние дни инкубационного периода, в продромальном периоде и в первые 5 дней разгара заболевания. Реконвалесценты не являются источниками инфекции.
Заражение происходит воздушно‑капельным путем, вирус выделяется со слюной. Допускается передача инфекции через инфицированные предметы обихода, игрушки. В отдельных случаях описано внутриутробное заражение вирусом эпидемического паротита – вертикальный путь передачи.
Болеют преимущественно дети в возрасте 1 года – 15 лет, мальчики в 1,5 раза чаще девочек. Лица, не болевшие эпидемическим паротитом, сохраняют восприимчивость к нему в течение всей жизни, что приводит к развитию заболевания в разных возрастных группах.
Типичен сезонный подъем заболеваемости в конце зимы – весной (март – апрель). Заболевание встречается как в виде спорадических случаев, так и эпидемических вспышек.
Паротитная инфекция одна из самых распространенных вирусных болезней, которая встречается во всех странах мира.
После перенесенного заболевания остается прочный специфический иммунитет.
Патогенез и патологоанатомическая картина. Входными воротами инфекции служат слизистые оболочки верхних дыхательных путей и, возможно, полости рта. После накопления в клетках эпителия вирус проникает в кровь (первичная вирусемия) и разносится с ее током в различные органы и ткани. Вирус, гематогенно занесенный в слюнные железы, находит здесь оптимальные условия для размножения и вызывает местную воспалительную реакцию. В других органах также происходит репродукция вируса, но существенно менее интенсивная. Как правило, поражение других железистых органов (яички, поджелудочная железа) и нервной системы развивается не с первых дней заболевания, что связано с медленной репликацией в них вируса, а также вторичной вирусемией, которая является следствием интенсивного размножения вируса и его выхода в кровь из воспаленных околоушных слюнных желез. В развитии осложнений имеют значение функциональное состояние органов (например, ослабление гематоэнцефалического барьера), а также иммунные механизмы (циркулирующие иммунные комплексы, аутоиммунные реакции).
Патологоанатомическая картина неосложненного эпидемического паротита изучена недостаточно в связи с доброкачественным течением заболевания. Ткань околоушной железы сохраняет ацинозное строение, но вокруг слюнных протоков отмечаются отек и инфильтрация лимфоцитами. Основные изменения локализуются в протоках слюнных желез – от незначительного отека эпителия до полной его десквамации и обтурации протока клеточным детритом. Нагноительные процессы встречаются исключительно редко.
Методом биопсии яичка при паротитном орхите установлены лимфоцитарная инфильтрация иитерстициальной ткани, очаги геморрагии. Нередко наблюдаются очаги некроза железистого эпителия с закупоркой канальцев клеточным детритом, фибрином и лейкоцитами. В тяжелых случаях, после воспаления может наступить атрофия яичника. Воспалительно‑дегенеративные процессы описаны в яичниках.
Изменения поджелудочной железы изучены недостаточно. Имеются данные о возможности развития некротического панкреатита с поражением как эндокринной, так и экзокринной ткани железы, в тяжелых случаях с последующей ее атрофией. Поражения ЦНС имеют неспецифический характер.
Клиническая картина. Продолжительность инкубационного периода колеблется от 11 до 23 дней (чаще 15–19 дней). Продромальный период встречается редко. В течение 1–2 дней больные жалуются на недомогание, общую слабость, разбитость, познабливание, головную боль, боли в мышцах и суставах, снижение аппетита.
В типичных случаях наблюдается острое начало заболевания с повышения температуры тела до 38–40 °С и развития признаков общей интоксикации. Лихорадка чаще достигает максимальной выраженности на 1–2‑й день болезни и продолжается 4–7 дней с последующим литическим снижением.
Поражение околоушных слюнных желез – первый и характерный признак болезни. Появляются припухлость и болезненность в области околоушных желез сначала с одной, затем – с другой стороны. В процесс могут вовлекаться и другие слюнные железы – субмаксиллярные и подъязычные. Область увеличенной железы болезненна при пальпации, мягковато‑тестоватой консистенции. Боль особенно выражена в некоторых точках: впереди и позади мочки уха (симптом Филатова) и в области сосцевидного отростка. Диагностическое значение имеет симптом Мурсу (Мурсона) – гиперемия, воспалительная реакция слизистой оболочки в области выводного протока пораженной околоушной железы. Возможны гиперемия и отечность миндалин. Припухлость может распространяться на шею, кожа становится напряженной, лоснится, гиперемии нет. Больных беспокоит болезненность при жевании. В некоторых случаях наступает рефлекторный тризм, который препятствует разговору и приему пищи. При одностороннем поражении слюнных желез больной нередко наклоняет голову в сторону пораженной железы. Увеличение слюнной железы быстро прогрессирует и достигает максимума в течение 3 дней. Припухлость держится 2–3 дня и затем постепенно (в течение 7–10 дней) уменьшается. На этом фоне могут развиться различные, нередко тяжелые, осложнения. Единого представления о том, как рассматривать поражения различных органов при паротите – как проявления или осложнения заболевания – нет. Отсутствует общепринятая классификация паротита. А.П.Казанцев (1988) предлагает выделять осложненные и неосложненные формы заболевания. По тяжести течения – легкую (включая стертые и атипичные), средней тяжести и тяжелую формы. Инаппарантная (бессимптомная) форма болезни имеет большое значение в эпидемиологии заболевания. Выделяют резидуальные явления эпидемического паротита, к которым относят такие его последствия, как глухота, атрофия яичка, бесплодие, сахарный диабет, нарушения функции ЦНС.
Форма тяжести заболевания определяется на основании выраженности синдрома интоксикаций. При тяжелой форме наряду с признаками интоксикации, гипертермией у больных появляются тошнота, рвота, диарея как следствие поражения поджелудочной железы; увеличение печени и селезенки менее характерно. Чем тяжелее течение заболевания, тем чаще оно сопровождается различными осложнениями.
Осложнения. Возможно развитие менингита, менингоэнцефалита, орхита, острого панкреатита, артрита, миокардита и др.
Серозный менингит – наиболее частое и характерное осложнение эпидемического паротита, которое наблюдается после воспаления слюнных желез или, реже, одновременно с ним, в разные сроки от начала болезни, но чаще через 4–10 дней. Менингит начинается остро, с появления озноба, повторного повышения температуры тела (до 39 °С и выше). Больных беспокоят сильная головная боль, рвота, развивается выраженный менингеальный синдром (ригидность затылочных мышц, положительный симптом Кернига, Брудзинского). Цереброспинальная жидкость прозрачная, бесцветная, вытекает под повышенным давлением. В ликворограмме обнаруживаются типичные признаки серозного менингита: лимфоцитарный плеоцитоз до 500 и реже 1000 в 1 мкл, незначительное увеличение содержания белка при нормальном уровне глюкозы и хлоридов. После угасания симптомов менингита и интоксикации сравнительно медленно происходит санация цереброспинальной жидкости (1,5–2 мес и более).
У части больных развиваются клинические признаки менингоэнцефалита: нарушение сознания, вялость, сонливость, неравномерность сухожильных рефлексов, парезы лицевого нерва, вялость зрачковых рефлексов, пирамидные знаки, гемипарезы и др. Течение менингоэнцефалита паротитной этиологии преимущественно благоприятное.
Орхит и эпидидимит наиболее часто встречаются у подростков и взрослых. Они могут развиваться как изолированно, так и совместно. Орхит наблюдается, как правило, через 5–8 дней от начала заболевания и характеризуется новым подъемом температуры тела, появлением сильных болей в области мошонки и яичка, иногда с иррадиацией в нижние отделы живота. Вовлечение в процесс правого яичка иногда стимулирует острый аппендицит. Пораженное яичко значительно увеличено, становится плотным, кожа над ним отекает и краснеет. Увеличение яичка сохраняется 5–8 дней, затем его размеры уменьшаются, боли проходят. В дальнейшем (через 1–2 мес) у части больных могут появиться признаки атрофии яичка.
Оофорит редко осложняет эпидемический паротит, сопровождается болями внизу живота и признаками аднексита.
Острые панкреатиты развиваются на 4–7‑й день болезни. Основные симптомы: резкие боли в области живота с локализацией в мезогастрии, чаще схваткообразного или опоясывающего характера, лихорадка, тошнота, повторная рвота, запор или диарея. В крови и моче повышается содержание амилазы.
Поражение органа слуха встречается редко, но может привести к глухоте. Отмечается преимущественно одностороннее поражение слухового нерва. Первые признаки – шум в ушах, затем присоединяются проявления лабиринтита: головокружение, нарушение координации движения, рвота. Слух обычно не восстанавливается.
К редким осложнениям относятся миокардиты, артриты, маститы, тиреоидиты, бартолиниты, нефриты и др.
Прогноз. Обычно благоприятный.
Диагностика. Основана на характерной клинической симптоматике. Важное значение имеет эпиданамнез – указание на предшествующий заболеванию контакт с больным. Данные клинических лабораторных исследований неспецифичны. Обычно в гемограмме выявляется лейкопения с относительным лимфоцитозом. При развитии осложнений может быть лейкоцитоз. У большинства больных в крови повышен уровень ами‑
лазы. У больных паротитным менингитом при исследовании цереброспинальной жидкости выявляют признаки серозного менингита.
Вирус паротита может быть выделен из слизи, крови, цереброспинальной жидкости в последние дни инкубационного периода и в первые 3–4 дня разгара болезни, однако в связи со сложностью культивирования этот метод для диагностики не используется.
В трудных случаях применяют методы серодиагностики: нарастание титра антител в парных сыворотках в реакциях РА, РСК, РТГА. Диагностическим считается нарастание титра в 4 раза.
Дифференциальная диагностика. Неосложненные формы эпидемического паротита необходимо дифференцировать от гнойного (вторичного) паротита, болезни Микулича; камней, туберкулеза, новообразований слюнных желез; острого воспаления височно‑нижнечелюстного сустава, глубокой флегмоны шейной клетчатки, инфекционного мононуклеоза, лимфогранулематоза, токсической дифтерии глотки.
Лечение. Этиотропной терапии нет. Для предупреждения осложнений заболевания рекомендуются соблюдение постельного режима в течение 7–10 дней, щадящая диета. Важное значение имеет гигиена слизистой оболочки полости рта. Широко используют симптоматические средства – жаропонижающие и обезболивающие. Показано сухое тепло на поврежденную железу (согревающие повязки). При выраженной интоксикации проводят дезинтоксикационную инфузионную терапию, при орхитах – общее и местное лечение. Используют глюкокортикостероидные препараты (преднизолон в таблетках), сухое тепло, суспензорий. При менингитах показана дезинтоксикационная и дегидратационная терапия, включающая глюкокортикостероиды.
При панкреатитах осуществляют общепринятую тактику лечения.
Профилактика. Больные эпидемическим паротитом не подлежат обязательной госпитализации. В очаге инфекции необходимо проводить текущую или заключительную дезинфекцию, заключающуюся в общесанитарных мероприятиях (проветривание, влажная уборка).
Активная профилактика эпидемического паротита заключается в использовании аттенуированной вирусной вакцины. Ее вводят детям в возрасте старше 15 мес подкожно. Вакцинация против эпидемического паротита входит в Календарь обязательных прививок.
Натуральная оспа
Натуральная оспа (variola vera) – острое высококонтагиозное вирусное заболевание, протекающее с тяжелой интоксикацией и развитием везикулезно‑пустулезных высыпаний на коже и слизистых оболочках.
Исторические сведения. С древнейших времен натуральная оспа была известна в Китае, Индии, Египте. В VI в. она проникла в Европу, а в XVI–XVII вв. распространилась по всему миру. Только в Европе в отдельные годы оспой болели около 10 млн человек, из них умерли 25–40 % заболевших.
В 1919 г. была введена всеобщая вакцинация населения в Советской России. В результате государственных мероприятий по борьбе с этим заболеванием к 1937 г. натуральная оспа в нашей стране была полностью ликвидирована.
На XI сессии Всемирной ассамблеи здравоохранения (ВАЗ) в 1958 г. советское правительство внесло предложение о проведении всемирной программы ликвидации оспы. В результате глобальных усилий международной и национальных систем здравоохранения по реализации этой программы заболеваемость натуральной оспой была полностью ликвидирована, в мае 1900 г. на XXXIII сессии ВОЗ был подписан сертификат о ликвидации оспы на Земле. С этого года обязательная вакцинация против этого заболевания прекращена.
Этиология. Возбудитель натуральной оспы – orthopoxvirus variola из рода orthopoxvirus, семейства Poxviridae – представлен двумя разновидностями: а) О. variola var. major – собственно возбудитель натуральной оспы; б) О. variola var. minor – возбудитель алястрима, доброкачественной формы оспы человека в странах Южной Америки и Африки.
Возбудитель натуральной оспы относится к ДНК‑содержащим вирусам размером 240–269 х 150 нм, вирус обнаруживается в световом микроскопе в виде телец Пашена. Возбудитель оспы устойчив к воздействию различных физических и химических факторов, при комнатной температуре он не утрачивает жизнеспособности даже через 17 мес.
Эпидемиология. Натуральная оспа относится к особо опасным инфекциям. Резервуар и источник вирусов – больной человек, который является заразным с последних дней периода инкубации до полного выздоровления и отпадения корочек. Максимальная заразность отмечается с 7–9‑го дня болезни. Заражение оспой происходит воздушно‑капельным, воздушно‑пылевым, контактно‑бытовым, инокуляционным и трансплацентарным путями. Наибольшее значение имеет воздушно‑капельный путь передачи возбудителей. Восприимчивость людей к натуральной оспе абсолютная. После перенесенного заболевания сохраняется стойкий иммунитет.
Патогенез и патологоанатомическая картина. После проникновения в организм человека вирус реплицируется в регионарных лимфатических узлах, затем кровью разносится во внутренние органы (первичная вирусемия), где реплицируется в элементах системы мононуклеарных фагоцитов (в течение 10 дней). В дальнейшем наступает генерализация инфекции (вторичная вирусемия), что соответствует началу клинической манифестации болезни.
Обладая выраженным тропизмом к тканям эктодермального происхождения, вирус вызывает в них отек, воспалительную инфильтрацию, баллонирующую и ретикулярную дегенерацию, что проявляется высыпаниями на коже и слизистых оболочках. При всех формах болезни развиваются паренхиматозные изменения во внутренних органах.
Клиническая картина. Различают следующие формы болезни: тяжелые – геморрагическая оспа (оспенная пурпура, пустулезно‑геморрагическая, или черная, оспа) и сливная оспа; средней тяжести – рассеянная оспа; легкие – вариолоид, оспа без сыпи, оспа без температуры.
Клиническое течение натуральной оспы можно разделить на ряд периодов. Инкубационный период продолжается в среднем 9–14 дней, но может составлять 5–7 дней или 17–22 дня. Продромальный период длится 3–4 дня и характеризуется внезапным повышением температуры тела, болями в поясничной области, миалгиями, головной болью, часто рвотой. В течение 2–3 сут у половины больных появляется продромальная кореподобная или скарлатиноподобная сыпь, локализующаяся преимущественно в области бедренного треугольника Симона и грудных треугольников. К концу продромального периода температура тела снижается: при этом на коже и слизистых оболочках возникает оспенная сыпь.
Период высыпания характеризуется повторным постепенным повышением температуры и этапным распространением оспенной сыпи: вначале она возникает на липе, затем на туловище, на конечностях, поражая ладонные и подошвенные поверхности, максимально сгущаясь па лице и конечностях. На одном участке кожи сыпь всегда мономорфна. Элементы сыпи имеют вид пятен розового цвета, быстро превращающихся в папулы, а спустя 2–3 дня в оспенные пузырьки, имеющие многокамерное строение с пупковидным птяжением в центре элемента и окруженные зоной гиперемии.
С 7–8‑го дня болезни развивается нагноение оспенных элементов, сопровождающееся значительным подъемом температуры, резким ухудшением состояния больного. Пустулы теряют многокамерное строение, спадаются при проколе, крайне болезненны. К 15–17‑му дню пустулы вскрываются, подсыхают с образованием корочек, при ;)том болевые ощущения уменьшаются, появляется нестерпимый кожный зуд.
В течение 4–5‑й недели болезни на фоне нормальной температуры тела отмечаются интенсивное шелушение, отпадение корочек, на месте которых остаются глубокие белесоватые рубчики, придающие коже шероховатый (рябой) вид. Длительность болезни при неосложненном течении 5–6 нед. Наиболее тяжело протекают геморрагические формы оспы, нередко сопровождающиеся развитием инфекционно‑токсического шока.
Прогноз. При неосложненном течении болезни летальность достигала 15 %, при геморрагических формах – 70–100 %.
Диагностика. Основывается на данных эпидемиологического анамнеза, результатах клинического обследования. Специфическая диагностика предполагает выделение вируса из элементов сыпи (электронная микроскопия), заражение куриных эмбрионов и обнаружение антител к вирусу оспы (с помощью РНГА, РТГА и метода флюоресцирующих антител).
Лечение. Применяется комплексная терапия, включающая использование противооспенного иммуноглобулина, метисазона, антибиотиков широкого спектра действия и дезинтоксикационных средств.
Профилактика. Следует изолировать больных, а также проводить в течение 14 дней обсервацию контактных лиц с вакцинацией их. В полном объеме осуществляются карантинные мероприятия.
Зоонозная оспа
Зоонозная оспа – группа вирусных зоонозов, вызываемых представителями семейства, протекающих с синдромом интоксикации и возникновением на коже и слизистых оболочках везикулезно‑пустулезной сыпи. Встречается в зоне лесов тропической Африки. Описаны оспа обезьян, оспа Таны, белая оспа.
Оспа обезьян ( Monkepox)
Исторические сведения. Заболевания обезьян с появлением у них везикулезной сыпи известны с XVIII в., позднее была установлена связь между спорадическими осповидными заболеваниями человека и обезьян. Вирусологически подтвержденный случай оспы обезьян у человека описан отечественным ученым И.Д.Ладным в Заире.
Этиология. Возбудитель относится к семейству Poxviridae, роду Оrthomyxvirus, по морфологическим, антигенным и культуральным свойствам близкий к вирусу натуральной оспы.
Эпидемиология. Естественный резервуар вируса не установлен. Механизм заражения – аэрогенный с воздушно‑капельным путем передачи возбудителя. Наибольшая восприимчивость наблюдается в возрасте до 4 лет. Инфицированный вирусом человек может быть источником инфекции, однако в отличие от натуральной оспы заразившиеся от него лица для окружающих людей эпидемиологически неопасны. В настоящее время болезнь встречается в Заире, Либерии, Камеруне, Нигерии, Кот‑д'Ивуаре, Сьерра‑Леоне (всего зарегистрировано около 100 случаев болезни).
Патогенез и патологоанатомическая картина. Изучены недостаточно ввиду небольшого числа наблюдений. В общих чертах патогенез заболевания сходен с таковым при натуральной оспе.
Клиническая картина. Клинические проявления оспы обезьян напоминают симптоматику натуральной оспы и могут колебаться от стертых и легких до тяжелых, прогностически неблагоприятных форм болезни.
Начало болезни острое: наблюдаются озноб и быстрое повышение температуры тела до 39–40 °С, астенизация, понижение аппетита, миалгии и артралгии. С 3–4‑го дня болезни на фоне температурной ремиссии на коже и слизистых оболочках, вначале на лице, руках, а затем на туловище появляется сыпь, развивающаяся стадийно от макулы до везикулы, пустулы, корочки и рубца. Характерна центробежная локализация элементов, их мономорфность. На слизистых оболочках везикулы быстро мацерируются с образованием болезненных язв. Пустулизация сыпи наблюдается на 7–8‑й день болезни и характеризуется высокой лихорадкой и усилением других симптомов интоксикации. Образование корочек с 9–10‑го дня сопровождается улучшением состояния больных и свидетельствует о начинающемся выздоровлении.
Прогноз в большинстве случаев благоприятный. Среди описанных случаев – 10 % с летальным исходом.
Диагностика и лечение. Такие же, как при натуральной оспе.
Профилактика. В эндемичных районах проводится плановая вакцинация и по эпидемиологическим показаниям. Контактные лица подлежат изоляции на 17 дней.
Оспа Таны
Вспышки болезни, наблюдавшиеся в 1957 и 1962 гг. в период наводнений реки Тана в Кении, описаны Дауни (1971). Заболевание протекало с 3–4‑дневной лихорадкой, сильной головной болью, болями в поясничной области, выраженной астенией. В лихорадочный период возникали единичные осповидные с пупковидным втяжением элементы сыпи, расположенные преимущественно на открытых участках тела, на верхних конечностях, шее, туловище, обычно отсутствовавшие на кистях и стопах. Из элементов сыпи были изолированы вирусы, отнесенные к поксвирусам, однако они не нейтрализуются антителами к другим вирусам этой группы.
Случаи болезни протекали благоприятно.
Предполагается возможность передачи вируса от обезьян человеку при прямом контакте или через комаров Mansonia. Эпидемиологическая роль больного человека не установлена.
Сходные черты имеет белая оспа, встречающаяся в районах Западной Африки.
Легионеллезы
Син.: болезнь легионеров, питтсбургская пневмония, лихорадка Понтиак, лихорадка Форт‑Брагг, легионелла‑инфекция
Легионеллезы (legionellesis) – группа заболеваний бактериальной этиологии, клинически проявляющихся интоксикацией, респираторным синдромом, тяжелой пневмонией, поражением ЦНС и почек.
Исторические сведения. Открытие этиологии и описание клинической картины заболевания связаны с конгрессом организации «Американский легион», который проходил в Филадельфии в 1976 г. Из 4400 участников конгресса у 182 возникло острое респираторное заболевание с тяжелой пневмонией, 29 больных умерли. В 1977 г. Дж.Е.Макдейд и К.К.Шепард (США) выделили из легочной ткани человека, умершего во время вспышки болезни в Филадельфии, неизвестную ранее грамотрицательную палочку, этиологическая роль которой была доказана наличием специфических антител к микроорганизму.
Вспышка болезни легионеров во многом напоминала вспышки лихорадочных заболеваний в 1965 г. в Вашингтоне (округ Колумбия, США), в 1968 г. в городе Понтиак (Мичиган, США), в 1973 г. в курортном городе Бенидорм (Испания). Ретроспективное изучение сывороток больных, хранившихся в Центре борьбы с болезнями в городе Атланта (США), позволило доказать, что возбудителями этих вспышек были различные виды легионелл.
В 1978 г. на Международном симпозиуме по болезни легионеров возбудитель нового заболевания был назван Legionella pneumophilia.
В 1982 г., согласно рекомендациям ВОЗ, термин «болезнь легионеров» решено было сохранить лишь за эпидемическими заболеваниями, вызванными L. pneumophiliа, а заболевания, вызываемые другими видами легионелл, называть «легионелла‑инфекция», или «легионелла‑пневмония». Термин «легионеллез» объединяет все формы заболеваний, обусловленные микроорганизмами из семейства Legionellасеае.
Этиология. Возбудители легионеллеза относятся к семейству Legionellасеае, роду Legionella. Известно 8 видов легионелл. Наибольшее количество штаммов относится к виду L. pneumophilia. Легионелла – грамотрицательная, подвижная вследствие наличия жгутиков, палочка размером (2,0–3,0) х (0,5–0,7) мкм. Для культивирования возбудителя используют куриные эмбрионы и организм морской свинки. Фактором патогенности и вирулентности легионелл является термостабильный эндотоксин. Есть данные, подтверждающие наличие у бактерий сильнодействующего экзотоксина.
Легионеллы довольно устойчивы в водной среде: в речной воде они сохраняются до 3 нед, в водопроводной – более года, в дистиллированной – до 140 дней. Дезинфицирующие растворы (70 % раствор спирта, 5 % раствор йода, 1 % раствор формалина, 5 % раствор фенола, гипохлорид кальция и др.) быстро инактивируют возбудителя.
Эпидемиология. Предполагается, что легионеллез является сапронозной (или сапрозоонозной) инфекцией. Источники инфекции пока не установлены. Возбудитель способен размножаться во внешней среде, в воде различных водоемов, почве. Оптимальные места обитания легионелл – теплая вода открытых водоемов (25–30 °С).
Механизм передачи инфекции – аспирационный (аэрогенный). Основными факторами передачи являются воздух, вода (в виде водного аэрозоля) и почва (пыль).
Использование воды в системе кондиционера, душевых, сбрасываемой электростанциями и другими объектами, создает условия для накопления и передачи большой инфицирующей дозы возбудителя человеку.
Легионеллез нередко протекает как нозокомиальная инфекция, с чем связаны вспышки заболеваний в психиатрических больницах, центрах гемодиализа, отделениях реанимации, центрах по трансплантации почек и других специализированных клиниках.
Наиболее подвержены заболеванию легионеллезом лица пожилого возраста, курильщики, хронические алкоголики, наркоманы, а также лица с первичными и вторичными иммунодефицитами. Нередко болезнь возникает у людей, участвующих в земляных и строительных работах. Чаще болеют мужчины.
Максимальное число случаев болезни приходится на летне‑осенние месяцы.
Вспышки заболеваний легионеллезом зарегистрированы в США, Великобритании, Испании, Италии, Франции. Спорадические случаи болезни выявлены во всех странах мира, в том числе и в России.
Болезнь выявляют повсеместно и более всего там, где есть условия и возможность для специфической лабораторной диагностики.
Патогенез и патологоанатомическая картина. Входные ворота инфекции – дыхательные пути. Легионеллы могут обнаруживаться в крови и, поступая в различные органы, вовлекать их в патологический процесс. Возбудитель, вызывая воспалительно‑геморрагические и некробиотические изменения, гибнет, освобождая эндотоксин.
Эндотоксин вызывает системные поражения, а в тяжелых случаях – развитие инфекционно‑токсического шока с острой полиорганной и прежде всего дыхательной и почечной недостаточностью, энцефалопатией, синдромом диссеминированного внутрисосудистого свертывания крови. Инфекционно‑токсический шок может стать непосредственной причиной смерти больных.
При патологоанатомическом вскрытии выявляют очаговые и сливные участки консолидации легких, нередко с абсцессом, плевральным выпотом. Лобарные абсцедирующие пневмонии и фибринозный плеврит характерны для тяжелых форм легионеллеза. Методами импрегнации серебром и прямой иммунофлюоресценции показано присутствие легионелл в ткани легкого, медиастинальных лимфатических узлах, а также в селезенке, костном мозге, печени, почках. Гистоморфологическими исследованиями установлено наличие в органах лимфоплазмоцитарной инфильтрации. В печени обнаруживается лобулярный некроз.
Клиническая картина. Инкубационный период колеблется от 2 до 10 сут, чаще составляя 4–7 дней. Выделяют следующие клинические формы легионеллеза: 1) болезнь легионеров, протекающую с тяжелой пневмонией; 2) острое респираторное заболевание без пневмонии (лихорадка Понтиак); 3) острое лихорадочное заболевание с экзантемой (лихорадка Форт‑Брагг).
Болезнь легионеров начинается остро с озноба, повышения температуры, головной боли, миалгий и артралгий. В тяжелых случаях наблюдаются нарушение походки, атаксия, затруднение речи, обмороки, галлюцинации. Со 2–4‑го дня болезни присоединяются кашель со слизисто‑гнойной или кровянистой мокротой, одышка, боли в груди. Перкуторно и аускультативно выявляются очаги притупления над легкими, влажные мелкопузырчатые хрипы, шум трения плевры. Пневмония может быть односторонней или двусторонней, чаще имеет долевой, реже очаговый характер. Обычно поражаются нижние доли легких, особенно правая. В тяжелых случаях наблюдаются абсцедирующая пневмония, экссудативный плеврит. Возможно течение болезни с картиной диффузного бронхиолита или альвеолита.
Язык сухой, обложен коричневым налетом. Живот мягкий, болезненный в эпигастральной области. При пальпации кишечника отмечаются болезненность и урчание. У 1 /3 больных с первых дней болезни возникает диарея, что может вызывать ошибки в диагностике. Печень и селезенка не увеличены.
При тяжелом течения легионеллеза нередко развивается инфекционно‑токсический шок со смертельным исходом в первую неделю заболевания. При благоприятном течении болезни признаки интоксикации постепенно исчезают, воспалительные же очаги в легких рассасываются медленно в течение 4–6 нед и более. Летальность при этой форме достигает 20 %. Возможны легкое и средней тяжести течение болезни, которое не отличается от других бактериальных пневмоний.
Острое респираторное заболевание (лихорадка Понтиак) протекает без пневмонии с клинической картиной бронхита и ринита. И при этой форме легионеллеза наблюдаются мышечные боли, неврологические симптомы, рвота, жидкий стул. Летальных исходов не описано.
Острое лихорадочное заболевание с экзантемой (лихорадка Форт‑Браг г) не имеет каких‑либо характерных, специфических лишь для него проявлений. Экзантема может быть крупнопятнистой, кореподобной, петехиальной с различной локализацией. Шелушение кожи после исчезновения сыпи, как правило, не наблюдается. При этой форме возникают бронхит и общетоксические симптомы.
У больных легионеллезом отмечают нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы крови влево, тромбоцитопению. В моче выявляются токсическая альбуминурия, цилиндры, лейкоциты, эритроциты. При биохимическом исследовании крови определяются повышение уровня активности аланинаминотрансферазы, содержания мочевины и креатинина, выявляется метаболический и дыхательный ацидоз.
Прогноз. Наиболее серьезный при болезни легионеров. Во время эпидемических вспышек летальность может достигать 20 %. Остальные формы легионеллеза протекают более благоприятно.
Диагностика. Клиническая диагностика легионеллеза сложна. Лишь при наличии эпидемиологических данных о групповых заболеваниях, чаще возникающих у лиц, отягощенных интеркуррентными заболеваниями, с иммунодефицитами различной природы, можно заподозрить эту инфекцию. Следует учитывать наличие свойственного легионеллезу симптомокомплекса: поражение дыхательных путей, нарушение функции ЦНС, печени, гематурия, диарея. Важно принимать во внимание при клинической диагностике отсутствие эффекта от лечения общепринятыми при пневмонии антибиотиками (тетрациклин, пенициллин, стрептомицин, цефалоспорины).
Лабораторная диагностика легионеллеза проводится путем выявления возбудителя иммунофлюоресцентным методом, получения культуры возбудителя и серологического анализа, направленного на обнаружение специфических антител. Наиболее перспективен метод прямой иммунофлюоресценции, позволяющий выявить возбудителя в мокроте, моче, плевральной жидкости, аутопсийном материале и объектах внешней среды. Быстрое определение бактерий в исследуемых субстратах с использованием метода флюоресцирующих антител может иметь решающее клиническое и эпидемиологическое значение, позволяя своевременно назначить этиотропную терапию.
Бактериологический метод, направленный на выделение культуры возбудителя, сложен и доступен лишь специализированным лабораториям. Для культивирования бактерий используется среда Мюллера – Хинтона.
Внедряются в практику иммуноферментные и радиоиммунные методы обнаружения растворимых антигенов легионелл с применением моноклональных антител. Этими методами выявляют антигены в крови, мокроте и моче.
Широкое применение нашел серологический метод диагностики легионеллеза (реакции микроагглютинации и непрямой иммунофлюоресценции). Антитела в сыворотке крови появляются с 6–7‑го дня болезни, титр их нарастает на 2–3‑й неделе заболевания. Диагностическим считается нарастание титра антител в 4 раза и более, а при однократном исследовании – высокий уровень содержания специфических антител (титры не менее 1:128).
Дифференциальная диагностика. Ее следует проводить с бактермальными пневмониями стафилококковой и пневмококковой этиологии, орнитозом, Ку‑лихорадкой, микоплазмозом и другими заболеваниями, протекающими с поражением легких. Ведущее значение в этих случаях имеет лабораторная диагностика.
Лечение. Наиболее эффективным этиотропным средством является эритромицин. Препарат назначают перорально в суточной дозе 2 г в 4 приема. В тяжелых случаях, когда прием препарата внутрь малоэффективен или невозможен, прибегают к внутривенному введению растворимой формы – эритромицина фосфата по 0,2 г 3–4 раза в день. При улучшении состояния переходят на пероральный прием препарата. В случае очень тяжелых форм заболевания эритромицин рекомендуют вводить внутривенно в суточной дозе 2–4 г. Лечение эритромицином продолжают не менее 3 нед, так как при ранней отмене антибиотика возможны рецидивы.
Целесообразно дополнительно с эритромицином применять рифампицин в суточной дозе 0,6–1,2 г. Левомицетин может быть также использован в комплексной терапии легионеллеза в дозе 4 г в сутки парентерально в виде левомицетина сукцината. Наряду с этиотропной терапией используют комплекс патогенетических средств, направленных на коррекцию водноэлектролитных расстройств, кислотно‑основного состояния, газообмена.
При развитии инфекционно‑токсического шока вводят коллоидные (реополиглюкин) и кристаллоидные (раствор Рингера и др.) растворы, кортикостероиды. Назначают диуретики – фуросемид (лазикс). При наличии признаков острой почечной недостаточности проводят гемосорбцию, гемодиализ. При прогрессирующей острой дыхательной недостаточности прибегают к искусственной вентиляции легких. Необходимы массаж грудной клетки, меры, направленные на разжижение и эвакуацию мокроты.
Профилактика. Необходимы санитарная охрана водоисточников к обеззараживание воды, используемой для душевых установок и кондиционеров, дезинфекция систем кондиционирования, душевых помещений и установок.
Для профилактики внутрибольничных вспышек инфекции целесообразна тщательная стерилизация больничного оборудования, особенно приборов, используемых в терапии органов дыхания. При возникновении вспышек легионеллеза в лечебных учреждениях временно приостанавливают плановые операции, гемодиализ, пересадку органов.
Больных легионеллезом размещают в отдельных палатах, боксах, полубоксах. Работу с материалом от больных проводят в перчатках, масках. Персонал лабораторий по выделению возбудителя работает в защитном костюме второго типа.
Специфическая профилактика легионеллеза не разработана.
Менингококковая инфекция
Менингококковая инфекция – острое инфекционное заболевание, характеризующееся значительным клиническим полиморфизмом и протекающее в виде назофарингита, менингита и(или) менингококкового сепсиса.
Исторические сведения. Менингококковая инфекция в своей наиболее яркой клинической форме – эпидемического цереброспинального менингита – известна с древних времен. Описания вспышек этой инфекции содержатся в трудах Аретея (II в. до н.э.), Цельса (I в н.э.), Павла Эгинского (VII в.). В качестве самостоятельного заболевания эпидемический цереброспинальный менингит был выделен и подробно описан М.Вьесо в 1805 г. после вспышки в Женеве. Новый этап в изучении менингококковой инфекции начался в 1887 г., когда А.Вейксельбаум обнаружил и подробно описал возбудителя.
Важное значение имело выделение В.Ослером в 1899 г. возбудителя из крови. Оно во многом прояснило вопросы патогенеза заболевания и, главное, послужило доказательством того, что менингит – не единственное проявление менингококковой инфекции. В первые десятилетия XX в. начинается изучение структуры менингококков. Тогда же были сделаны попытки применить специфические сыворотки для лечения менингококковой инфекции. В 30‑х годах в терапии стали использовать сульфаниламидные препараты, а в 40–50‑х годах – антибиотики.
Этиология. Возбудитель менингококковой инфекции – neisseria meningitides относится к роду Neisseria семейства Nеisseriасеае. Средние размеры менингококка – 0,6–1 мкм. В мазках цереброспинальной жидкости и крови менингококки выявляются в форме кофейного или бобового зерна, располагаются в типичных случаях попарно, выпуклыми краями наружу и находятся внутриклеточно. Встречаются и внеклеточно расположенные микроорганизмы.
Менингококки исключительно требовательны к составу питательных сред, размножаются только в присутствии человеческого или животного белка либо специального набора аминокислот. Экзотоксина не образуют, при гибели микробной клетки высвобождается эндотоксин липополисахаридной природы.
По антигенной структуре менингококки подразделяются на ряд серологических групп: А, В, С, D, X, Y, X и др.
Возбудитель менингококковой инфекции характеризуется низкой устойчивостью во внешней среде: при температуре +50 °С погибает через 5 мин, при +100 °С – за 30 с. Менингококк малоустойчив и к низким температурам: при –10 °С погибает через 2 ч. Прямой солнечный свет убивает менингококки за 2–8 ч, под действием ультрафиолетовых лучей возбудитель погибает практически мгновенно. Менингококки очень чувствительны ко всем дезинфектантам.
Эпидемиология. Менингококковая инфекция – строгий антропоноз. Источником инфекции может быть только человек. Выделяет 3 группы источников менингококковой инфекции: 1) больные генерализованными формами болезни; 2) больные менингококковым назофарингитом; 3) носители менингококков.
Наибольшую заразительность имеют больные с манифестными формами инфекции. Показано, что за один и тот же промежуток времени один больной способен заразить в 6 раз больше людей, чем один носитель. Тем не менее основным источником менингококковой инфекции справедливо считаются носители. Это связано с тем, что на одного больного с клинически выраженными признаками заболевания приходится 1800–2000 носителей менингококка (по данным некоторых авторов, до 50 000). В итоге больные генерализованными формами инфекции являются источником заражения не более чем для 1–3 % от общего числа инфицированных, больные назофарингитом – для 10‑30 %, а носители – для 70‑80 %.
Механизм передачи инфекции – аэрогенный. Передача возбудителя происходит воздушно‑капельным путем во время экспираторных актов: при разговоре, чиханье, громком крике. Рассеиванию возбудителей и интенсификации механизма передачи способствует сочетание менингококковой инфекции (в том числе и носительства) с острыми респираторными заболеваниями.
Восприимчивость к менингококковой инфекции всеобщая. Ее особенностью является то, что у большинства инфицированных лиц заболевание протекает в виде бессимптомного носительства.
Около 80 % случаев болезни приходится на детей и подростков, из них 50 % составляют дети в возрасте 1 года – 5 лет. Среди взрослых наибольшее число случаев болезни падает на молодой возраст (15–30 лет). По‑видимому, это связано с социальными факторами и особенностями образа жизни молодых людей (служба в армии, обучение в учебных заведениях, проживание в общежитиях и т.д.). С этими же обстоятельствами связано преобладание в структуре заболеваемости менингококковой инфекцией лиц мужского пола.
Возрастная структура носительства менингококков существенно отличается от структуры заболеваемости. Большая часть носителей выявляется среди взрослых, доля детей среди носителей менингококка невелика.
Заболеваемость менингококковой инфекцией в городах обычно выше, чем в сельской местности. Описаны значительные вспышки заболевания в учебных заведениях закрытого типа и особенно среди военнослужащих.
В результате перенесенной менингококковой инфекции формируется довольно стойкий иммунитет. В последние годы доказано развитие иммунитета и в результате носительства менингококков, что, по‑видимому, определяет общие закономерности иммунитета к этой инфекции.
Распространение менингококковой инфекции повсеместное. Периодически, каждые 10–15 лет, наблюдаются подъемы заболеваемости. Для менингококковой инфекции характерна зимне‑весенняя сезонность с максимальным числом заболеваний в феврале – апреле.
Патогенез и патологоанатомическая картина. Входными воротами инфекции являются верхние дыхательные пути, чаще всего носоглотка. В месте внедрения возбудителя развивается воспалительный процесс. В случае преодоления защитного барьера слизистых оболочек менингококк проникает в кровь, развивается менингококкемия, которая сопровождается массивной гибелью возбудителей и токсинемией. Циркуляция возбудителя и токсинов в крови приводит к повреждению эндотелия сосудов и развитию множественных кровоизлияний в различные ткани и внутренние органы. В ряде случаев менингококкемия протекает в виде септикопиемии, тогда во внутренних органах формируются вторичные метастатические очаги (менингококковые эндокардиты, артриты, иридоциклиты и др.).
Проникновение менингококков в полость черепа в подавляющем большинстве случаев происходит гематогенным путем в результате преодоления гематоэнцефалического барьера. В редких случаях возбудитель может попадать в субарахноидальное пространство сквозь решетчатую кость по периваскулярным и периневральным лимфатическим путям, минуя общий кровоток.
В результате попадания менингококков в субарахноидальное пространство и размножения возбудителей возникает серозно‑гнойное, а затем гнойное воспаление мягких мозговых оболочек.
Воспалительный процесс локализуется чаще всего на поверхности больших полушарий и основании головного мозга, но нередко распространяется и на спинной мозг. Возможно распространение патологического процесса на эпендиму желудочков мозга с развитием гнойного эпендиматита. Макроскопически головной мозг выглядит покрытым гнойной шапочкой или чепчиком, мягкая мозговая оболочка в свободных от скопления гноя местах представляется отечной, гиперемированной и мутной.
При тяжелых формах воспалительный процесс может захватить мозговое вещество с инъекцией и расширением сосудов, мелкими кровоизлияниями, воспалительными фокусами. Описаны случаи распространения патологического процесса на корешки черепных нервов (чаще всего VII и VIII пар, но также и V, VI, III, XII и др.).
В процессе обратного развития гнойного экссудата при не– благоприятных условиях (затяжное течение менингита, неполноценное лечение) может происходить соединительнотканная организация его. В результате спаечного процесса возникает окклюзия отверстий Мажанди, Лушке, Кея, Ретциуса, водопровода среднего мозга (сильвиева водопровода), очаговое или тотальное запустевание подпаутинных пространств, облитерация периваскулярных путей. Это в свою очередь является основой для возникновения гидроцефалии.
В патогенезе особо тяжелых форм менингококковой инфекции на первый план выходят токсический и аллергический (аутоаллергический) компоненты.
Так, центральное место в патогенезе молниеносной менингококкемии современные исследователи отводят инфекционно‑токсическому шоку. При этом у больных развиваются расстройства гемостаза (по типу коагулопатии потребления), гемодинамические расстройства и нарушения микроциркуляции в органах и тканях, резкие сдвиги в электролитном и гормональном гомеостазе. Патологоанатомически у погибших людей выявляются типичные изменения в сосудах, тромбозы, кровоизлияния в различные органы, в том числе в надпочечники, некрозы.
При гистологическом исследовании элементов экзантемы наблюдаются поражения сосудов кожи и перифокальные воспалительные изменения. В сосудах обнаруживаются лейкоцитарно‑фибринозные тромбы, содержащие менингококки. Следовательно, кожные высыпания при менингококкемии по существу становятся вторичными метастатическими очагами инфекции.
Выраженный токсикоз является основной причиной очень тяжелого, нередко смертельного осложнения менингококковой инфекции – церебральной гипертензии. Этот синдром возникает в результате острого набухания и отека головного мозга, которые развиваются одновременно с гиперпродукцией и нарушением оттока цереброспинальной жидкости (ликвора). Увеличение объема головного мозга вследствие отека и набухания приводит к его смещению и вклинению миндалин мозжечка в большое затылочное отверстие. Происходит сдавливание продолговатого мозга с быстрым развитием паралича дыхания, а затем и сосудистого паралича.
Иногда при тяжелом течении менингококковой инфекции, особенно у детей раннего возраста, развивается не гипертензия, а, напротив, церебральная гипотензия (церебральный коллапс). В генезе этого осложнения имеет значение сочетание резкого токсикоза с тяжелыми расстройствами водно‑солевого обмена. Церебральный коллапс в свою очередь является центральным звеном патогенеза субдурального выпота.
Клиническая картина. Длительность инкубационного периода при менингококковой инфекции колеблется от 1 до 10 дней, чаще составляя 5–7 дней.
В соответствии с клинической классификацией менингококковой инфекции выделяют следующие ее формы:
I. Первично‑локализованные:
1) менингококковыделительство;
2) острый назофарингит;
3) пневмония.
II. Гематогенно‑генерализованные:
1) менингококкемия: типичная, молниеносная, хроническая;
2) менингит;
3) менингоэнцефалит;
4) смешанная (менингококкемия +менингит);
5) редкие формы (эндокардит, артрит, иридоциклит).
Менингококковыделительство не имеет никаких клинических проявлений.
Острый назофарингит. Наиболее постоянными являются жалобы больных на головную боль, преимущественно в лобно‑теменной области, першение и боли в горле, сухой кашель, заложенность носа. Эти симптомы чаще всего сочетаются с ухудшением общего самочувствия больных: недомоганием, вялостью, слабостью, снижением аппетита, нарушением сна. У большинства больных температура тела повышается до субфебрильных цифр. Продолжительность лихорадки, как правило, не превышает 1–3 дней, лишь в редких случаях она сохраняется 5–7 дней. Кожные покровы у больных бледные, сосуды конъюнктивы и склер инъецированы. Слизистые оболочки носа гиперемированы, отечны.
Гиперемия миндалин, мягкого неба и небных дужек выражена незначительно, иногда отсутствует. На этом фоне особенно заметны яркая гиперемия и отек задней стенки глотки, а также гиперплазия ее лимфоидных фолликулов. У многих больных задняя стенка глотки покрыта слизистым или слизисто‑гнойным экссудатом.
Воспалительные изменения в носоглотке определяются в течение 5–7 дней, гиперплазия лимфоидных фолликулов держится обычно дольше (до 14–16 дней).
В периферической крови можно выявить умеренный лейкоцитоз с нейтрофилезом и сдвигом лейкоцитарной формулы влево, повышение СОЭ.
У 30–50 % больных назофарингит сочетается с другими проявлениями менингококковой инфекции и предшествует развитию генерализованных форм заболевания.
Пневмония. В некоторых случаях менингококки вызывают первичную пневмонию, протекающую без каких‑либо проявлений данной инфекции. Менингококковая пневмония может иметь очаговый или лобарный характер. В том и другом случае ее отличает довольно тяжелое и продолжительное течение.
Менингококкемия. Это менингококковый сепсис, протекающий бурно, с выраженными симптомами токсикоза и развитием вторичных метастатических очагов.
Заболевание начинается, как правило, остро. Температура тела с ознобом повышается до 39–41 °С. В дальнейшем лихорадка может носить постоянный характер, быть интермиттирующей, гектической, волнообразной. Возможно безлихорадочное течение менингококкового сепсиса. Степень повышения температуры тела не соответствует тяжести течения заболевания. При развитии инфекционно‑токсического шока температура обычно снижается до субфебрильной или нормальной.
Одновременно с лихорадкой возникают другие симптомы интоксикации: головная боль, снижение или отсутствие аппетита, общая слабость, боли в мышцах спины и конечностей, жажда, сухость во рту, бледность и цианоз кожных покровов.
Наблюдаются тахикардия, снижение артериального давления, тахипноэ и нередко одышка. Уменьшается мочеотделение. У большинства больных заметна тенденция к задержке стула, у некоторых, напротив, развиваются поносы. Последние более характерны для детей младшего возраста.
Наиболее ярким, постоянным и диагностически ценным признаком менингококкемии является экзантема. Кожные высыпания возникают через 5–15 ч, иногда на 2‑е сутки от начала заболевания. Сыпь при менингококковой инфекции может быть разнообразной по характеру и величине высыпных элементов, а также по локализации. Наиболее типичной является геморрагическая сыпь (петехии, пурпура, экхимозы). Элементы сыпи имеют неправильную (звездчатую) форму, плотны на ощупь, иногда выступают над уровнем кожи. Нередко геморрагическая сыпь сочетается с розеолезной или розеолезно‑папулезной. Изредка встречаются везикулезные, буллезные высыпания, сыпь в форме узловатой эритемы. Как правило, сыпь при менингококкемии обильная. Она преимущественно локализуется на конечностях, туловище, ягодичных областях, а реже – на лице. Не являются редкостью случаи болезни, когда экзантема бывает скудной.
Часто встречаются энантема на переходной складке конъюнктивы, кровоизлияния в склеры, описана энантема на слизистой оболочке рта.
Обратное развитие сыпи зависит от характера и величины ее элементов, а также глубины поражения кожи. Глубокие и обширные кровоизлияния могут некротизироваться.
В дальнейшем участки некроза отторгаются и образуются медленно заживающие язвы. На конечностях иногда наблюдаются глубокие некрозы всех мягких тканей с обнажением костей. Нередки случаи некрозов ушных раковин, кончика носа, концевых фаланг пальцев рук и ног.
В соскобах и биоптатах элементов сыпи у нелеченых больных с большим постоянством обнаруживаются менингококки.
Метастазы возбудителя в суставы наблюдаются значительно реже, чем в кожу. Чаще поражаются мелкие суставы. Тяжесть артритов может быть различной – от гнойных поражений до легких изменений с болезненностью при движениях, небольшой гиперемией и отеком кожи над пораженным суставом. Из полости сустава можно получать культуру менингококка.
Артриты возникают позже, чем сыпь, к концу 1‑й – началу 2‑й недели болезни. Прогноз их благоприятный, при выздоровлении функции суставов полностью восстанавливаются.
Вторичные метастатические очаги инфекции могут возникать в сосудистой оболочке глаза, в пери‑, мио– и эндокарде, легких, плевре, что в современных условиях встречается редко. Еще реже подобные очаги возникают в почках, печени, костном мозге.
В гемофамме при менингококкемии обнаруживается умеренный или высокий нейтрофильный лейкоцитоз (20,0–40,0 * 10^9 /л и более) со сдвигом лейкоцитарной формулы влево до юных и миелоцитов, анэозинофилия, повышение СОЭ. Нередко развивается тромбоцитопения.
В моче имеются изменения, свойственные синдрому инфекционно‑токсической почки, – протеинурия, цилиндрурия, микрогематурия.
В подавляющем большинстве случаев менингококковый сепсис протекает в сочетании с менингитом. Однако у 4–10 % госпитализированных по поводу менингококковой инфекции больных менингококкемия встречается в «чистом» виде, без поражения мягкой мозговой оболочки. Частота менингококкового сепсиса обычно выше в периоды эпидемий.
Менингококкемия может протекать в легкой, среднетяжелой и тяжелой формах.
Молниеносная менингококкемия (Синонимы: сверхострый менингококковый сепсис, молниеносная пурпура, фульминантная менингококкемия, синдром Уотерхауза – Фридериксена). Это наиболее тяжелая, прогностически крайне неблагоприятная форма менингококковой инфекции. По существу она представляет собой инфекционно‑токсический шок. Клинически характеризуется острейшим, внезапным началом и бурным течением. Те пература тела с ознобом быстро повышается до 40–41 °С, однако через несколько часов она может смениться гипотермией. Уже в первые часы болезни возникает обильная геморрагическая сыпь с тенденцией к слиянию и образованию обширных кровоизлияний, которые могут быстро некротизироваться. На коже появляются багрово‑цианотичные пятна, перемещающиеся при перемене положения тела (они получили название «трупные пятна» – «livors mortalis»). Кожные покровы бледные, но с тотальным цианозом, влажные, покрыты холодным липким потом, черты лица заостряются. Больные беспокойны, возбуждены, у них нередко появляются судороги, особенно у детей. В первые часы болезни сознание сохранено, при этом больные жалуются на сильные мышечные боли, артралгии, боли в области живота, гиперестезии. Нередко возникает повторная рвота (часто «кофейной гущей»), возможен кровавый понос. Постепенно нарастает прострация, наступает потеря сознания.
Параллельно катастрофически ослабевает сердечная деятельность. Развивается анурия («шоковая почка»). Часто выявляется гепатоспленомегалия. Менингеальный синдром непостоянен, но может быть и резко выраженным.
В гемограмме гиперлейкоцитоз (до 60 *10^9 /л), нейтрофилез, резкий сдвиг лейкоцитарной формулы влево, тромбоцитопения, повышение СОЭ (50–70 мм/ч). Выявляются резкие расстройства гомеостаза – метаболический ацидоз, коагулопатия потребления, снижение фибринолитической активности крови и др.
В отсутствие рациональной терапии больные погибают в первые часы и сутки болезни от острой сердечно‑сосудистой или острой почечной недостаточности.
Менингококкемия хроническая. Редкая форма менингококковой инфекции. Продолжительность заболевания различная – от нескольких недель до нескольких лет. Лихорадка обычно интермиттирующая, но встречается и постоянная; сопровождается высыпаниями по типу полиморфной экссудативной эритемы. В периоды ремиссий температура тела может быть нормальной, сыпь бледнеет и даже исчезает, самочувствие больных заметно улучшается. При хронической менингококкемии возможны артриты и полиартриты, нередко наблюдается гепатоспленомегалия.
В периферической крови – лейкоцитоз, нейтрофилез, увеличение СОЭ. В моче – умеренная или небольшая протеинурия, а при развитии специфического гломерулонефрита – соответствующий мочевой синдром. Описаны эндокардиты (панкардиты), а также возникновение менингита через несколько недель или месяцев от начала заболевания.
Прогноз хронического менингококкового сепсиса относительно благоприятный, при правильном лечении – хороший.
Менингит. Может начинаться вслед за менингококковым назофарингитом, но иногда первые признаки заболевания возникают внезапно, среди полного здоровья.
При менингите с большим постоянством обнаруживается следующая триада симптомов: лихорадка, головная боль и рвота. Температура тела обычно повышается быстро, с сильнейшим ознобом и может достигать 40–42 °С в течение нескольких часов. Температурная кривая характерных черт не имеет, встречаются интермиттирующий, ремиттирующий, постоянный, двухволновой типы кривых.
Головные боли при менингите исключительно сильные, мучительные, чаще без определенной локализации, диффузные, в большинстве своем имеют пульсирующий характер. Особой интенсивности они достигают по ночам, усиливаются при перемене положения тела, резком звуке, ярком свете. Нередко больные стонут от болей. Рвота при менингите возникает без предшествующей тошноты, вне связи с приемом пищи, внезапно, не приносит облегчения больному.
Весьма часто при менингите встречаются резкая кожная гиперестезия и повышение чувствительности к слуховым (гиперакузия), световым (фотофобия), болевым (гипералгезия) раздражителям, запахам (гиперосмия). У многих больных уже в первые часы болезни возникают тяжелые судороги: клонические, тонические или смешанные.
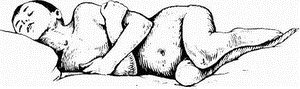
Рис. Характерная поза больного менингитом (по А.Соколову).
Большое место в клинической картине менингококкового менингита занимают расстройства сознания вплоть до его потери (от сопора до комы). Нередко потеря сознания следует за психомоторным возбуждением. Выключение сознания в первые часы болезни является прогностически неблагоприятным признаком. Возможно течение менингита при ясном сознании.
При объективном обследовании на первое место выступают менингеальные симптомы. Они появляются уже в 1 –е сутки болезни, в дальнейшем быстро прогрессируют. Описано около 30 менингеальных знаков. В практической деятельности используются некоторые из них, наиболее постоянные: ригидность затылочных мышц, симптомы Кернига, Брудзинского (нижний, средний, верхний), а также Гийона, Бехтерева, Мейтуса и др.
Выраженность менингеального синдрома может не соответствовать тяжести заболевания, а выраженность различных симптомов не всегда одинакова у одного и того же больного.
В самых тяжелых запущенных случаях больной принимает характерную вынужденную позу – лежит на боку с запрокинутой головой, ноги согнуты в коленных и тазобедренных су– ставах, притянуты к животу (положение взведенного курка – «chien en fusil» . Как правило, у больных менингитом наблюдаются асимметрия и повышение сухожильных периостальных и кожных рефлексов, которые в дальнейшем, по мере углубления интоксикации, могут снижаться и исчезать совсем. В ряде случаев можно выявить патологические рефлексы (Бабинского, Гордона, Россолимо, Оппенгеймера, клонус стоп), а также симптомы поражения некоторых черепных нервов (чаще всего III, IV, VII, VIII пар). Страдает вегетативная нервная система, что проявляется наличием стойкого красного дермографизма.
Многочисленные симптомы поражения других органов и систем обусловлены интоксикацией. В первые часы развивается тахикардия, затем появляется относительная брадикардия. Артериальное давление снижается. Тоны сердца приглушены, нередко аритмичны. Может быть умеренно выраженное тахипноэ. Язык обложен грязно‑коричневым налетом, сухой. Живот втянут, мышцы брюшного пресса у некоторых больных напряжены.
У большинства заболевших развиваются запор, иногда рефлекторная задержка мочеиспускания.
Весьма характерен внешний вид больных менингитом. В первые дни лицо и шея гиперемированы, сосуды склер инъецированы. Как и при некоторых других тяжелых заболеваниях, при менингите оживляется латентная герпетическая инфекция и появляются пузырьковые высыпания на губах, крыльях носа, слизистых оболочках рта.
В гемограмме – высокий нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево, увеличение СОЭ. В моче – небольшая протеинурия, микрогематурия, цилиндрурия.
Осложнения менингококкового менингита. У части больных развиваются осложненные варианты заболевания.
Молниеносное течение менингита с синдромом набухания и отека головного мозга – крайне неблагоприятный вариант, протекающий с гипертоксикозом и высокой летальностью. Главные симптомы являются следствием вклинения головного мозга в большое затылочное отверстие и ущемления продолговатого мозга миндалинами мозжечка.
Быстро развиваются угрожающие симптомы нарушения деятельности сердечно‑сосудистой и дыхательной систем. Появляется брадикардия, которая сменяется тахикардией, артериальное давление лабильно, может катастрофически падать, но чаще повышается до предельно высоких цифр. Возникают тахипноэ (до 40–60 в 1 мин) с участием вспомогательной дыхательной мускулатуры, резкая одышка, затем возможна аритмия дыхания типа Чейна – Стокса. Расстройства дыхания приводят к внезапной остановке его.
Указанные симптомы разворачиваются при нарастающей гипертермии, клонических судорогах и потере сознания.
У больных отмечается резкая потливость, кожные покровы цианотичны, лицо гиперемировано. Определяются пирамидальные знаки, иногда симптомы поражения черепных нервов, угасание корнеальных рефлексов, сужение зрачков и снижение их реакции на свет.
Больные погибают при этом варианте течения менингококкового менингита, как правило, от остановки дыхания. Смерть может наступить в первые часы болезни, но иногда – на 2–3‑й и даже 5–7‑й день.
Менингит с синдромом церебральной гипотензии – редкий вариант течения менингококкового менингита, диагностируемый преимущественно у детей младшего возраста.
Заболевание развивается бурно, протекает с резкими токсикозом и эксикозом. Быстро развивается ступор, возможны судороги, менингеальные знаки не выражены, что затрудняет диагностику. Внутричерепное давление резко падает, при этом уменьшается объем жидкости в желудочках головного мозга, развивается вентрикулярный коллапс. Большой родничок у грудных детей западает. У старших детей и взрослых опорными моментами в диагностике являются клинические признаки обезвоживания и низкое давление цереброспинальной жидкости, которая при люмбальном проколе вытекает редкими каплями. Падение внутричерепного давления при менингите может привести к развитию крайне тяжелого осложнения – субдуральной гематомы (выпота).
Менингит с синдромом эпендиматита (вентрикулита) – в современных условиях редкая форма менингита, которая развивается главным образом при запоздалом или недостаточном лечении больных. Особая тяжесть заболевания обусловлена распространением воспаления на оболочку, выстилающую желудочки мозга (эпендиму), а также вовлечением в патологический процесс вещества головного мозга (субэпендимарный энцефалит).
Основные клинические симптомы: тотальная ригидность (больные принимают вынужденную позу – ноги вытянуты и перекрещиваются в нижних отделах голеней, кисти рук сжаты в кулаки), расстройства психики, сонливость, мощные тонические и клонические судороги. Температура тела нормальная или субфебрильная при общем тяжелом состоянии больного. Постоянным симптомом является рвота, нередко упорная. Возможны парезы сфинктеров с непроизвольным отхождением кала и недержанием мечи. При длительном течении и(или) безуспешной терапии эпендиматита развиваются гидроцефалия, кахексия и наступает смерть. В случае изолированного или преимущественного поражения эпендимы IV желудочка главными в клинической картине будут расстройства дыхания, сердечно‑сосудистой деятельности и другие симптомы повреждения ядер черепных нервов ромбовидной ямки (дно IV желудочка).
Менингоэнцефалит. Относительно редкая форма менингококковой инфекции, при которой преобладают симптомы энцефалита, а менингеальный синдром выражен слабо.
Для менингококковых энцефалитов характерно быстрое начало и бурное развитие нарушений психики, судорог, парезов, параличей. Прогноз неблагоприятный, даже в современных условиях летальность остается высокой, а выздоровление неполным.
Смешанная форма (менингококковая + менингит). Встречается в 25–50 % случаев генерализованной менингококковой инфекции, причем в последние годы определилась тенденция к нарастанию частоты смешанной формы в общей структуре заболеваемости, особенно в периоды эпидемических вспышек. Клинически характеризуется сочетанием симптомов менингококкового сепсиса и поражением мозговых оболочек.
Редкие формы. Редкие формы менингококковой инфекции (артриты и полиартриты, эндокардит, иридоциклиты) в подавляющем большинстве случаев, по‑видимому, являются следствием менингококкемии. Прогноз их при своевременной и достаточной терапии благоприятный.
Диагностика. Диагноз всех форм менингококковой инфекции базируется на комплексе данных, полученных эпидемиологическим, анамнестическим и клиническим методами, и окончательно устанавливается с помощью лабораторных исследований. Отдельные методы имеют неодинаковую диагностическую ценность при различных клинических формах менингококковой инфекции. Так, диагноз менингококковыделительства возможен лишь при использовании бактериологического метода, когда материалом для изучения является слизь проксимальных отделов верхних дыхательных путей.
В диагностике менингококкового назофарингита главное место занимают эпидемиологический и бактериологический методы, так как клинически разграничить менингококковый назофарингит от другого генеза невозможно или крайне трудно.
В распознавании генерализованных форм реальную диагностическую ценность приобретает анамнестический и клинический методы диагностики, особенно при сочетании менингококкемии и менингита. В диагностике менингита большое значение имеет исследование цереброспинальной жидкости.
При генерализованных формах менингококковой инфекции окончательный диагноз верифицируется бактериологическим методом.
Из иммунологических методов наиболее чувствительны и информативны РНГА, ИФА.
Лечение. Терапевтическая тактика при менингококковой инфекции зависит от клинической формы, тяжести течения заболевания, наличия осложнений, преморбидного фона.
Этиологическая терапия. Лечение менингококкового назофарингита. При назофарингите средней тяжести показаны антибактериальные препараты. Чаще всего применяют пероральные антибиотики: ампиокс, оксациллин, левомицетин, тетрациклин, эритромицин и другие макролиды, в соответствии с результатами изучения чувствительности выделенного возбудителя. Применяемые дозы антибиотиков – среднетерапевтические, возрастные. Продолжительность терапии – 3–5 дней и более. Используют также сульфаниламидные препараты пролонгированного действия в обычных дозах. При легком течении назофарингита назначение антибиотиков и сульфаниламидов необязательно.
Всем больным следует рекомендовать частые полоскания горла растворами антисептиков. При наличии интоксикации – обильное и частое питье.
Лечение генерализованных форм менингококковой инфекции. Центральное место в терапии принадлежит антибиотикам, в первую очередь солям бензилпенициллина. Применяют бензил– пенициллин в суточной дозе 200 000–500 000 ЕД на 1 кг массы больного.
В запущенных случаях менингита, при поступлении больного в стационар в бессознательном состоянии, а также при наличии эпендиматита (вентрикулита) или признаков консолидации гноя доза вводимого пенициллина повышается до 800 000–1 000 000 ЕД/кг в сутки. В подобных обстоятельствах прибегают к внутривенному введению натриевой соли бензил– пенициллина (введение в вену больших доз калиевой соли недопустимо из‑за опасности гиперкалиемии) в дозе 2 000 000–12 000 000 ЕД в сутки, сохраняя внутримышечную дозу препарата. Внутривенную дозу пенициллина лучше вводить капельным способом. Эндолюмбальное введение пенициллина в последние годы практически не применяется.
Суточная доза пенициллина вводится больному через каждые 3 ч. В некоторых случаях допустимо увеличение интервалов между инъекциями до 4 ч. Продолжительность пенициллинотерапии устанавливается каждый раз индивидуально, исходя из клинических и ликворологических данных. Опыт свидетельствует, что необходимая и достаточная продолжительность терапии пенициллином составляет обычно 5–8 дней.
Достаточно высокой эффективностью при менингококковой инфекции обладают полусинтетические пенициллины. Это наиболее надежные и предпочтительные препараты для «старт‑терапии» больных с гнойным менингитом до установления
этиологического диагноза.
Наиболее эффективен при терапии менингококковой инфекции ампициллин, который назначают в суточной дозе 200–300 мг/кг, внутримышечно через каждые 4 ч. В самых тяжелых случаях часть ампициллина вводят внутривенно, а суточную дозу повышают до 400 мг/кг. Оксациллин применяют в дозе не менее 300 мг/кг в сутки с интервалами между инъекциями 3 ч. Метициллин вводят через каждые 4 ч в суточной дозе 200–300 мг/кг.
Высокоэффективен при менингококковой инфекции левомицетин. Он является препаратом выбора при молниеносной менингококкемии. Показано, что при лечении левомицетином эндотоксические реакции у больных возникают значительно реже, чем при пенициллинотерапии. В случае менингоэнцефалитов, напротив, левомицетин не показан из‑за токсического действия на клетки головного мозга. Левомицетин для парентерального введения (левомицетина сукцинат растворимый) применяют внутримышечно по 50–100 мг/кг в сутки в 3–4 приема (через каждые 6–8 ч). При молниеносной менингококкемии левомицетин применяют внутривенно через каждые 4 ч до стабилизации артериального давления, после чего продолжают введение внутримышечно. Средняя продолжительность лечения больных этим антибиотиком составляет 6–10 дней.
Ряд авторов отмечают удовлетворительные результаты терапии при менингококковой инфекции препаратами из группы тетрациклинов. Тетрациклин можно вводить в дозе 25 мг/кг в сутки внутривенно и внутримышечно в тех случаях, когда имеется устойчивость возбудителя к другим антибиотикам.
В терапии генерализованных форм менингококковой инфекции, протекающих легко, применяют также сульфаниламидные препараты пролонгированного действия, в том числе для парентерального введения.
Патогенетическая терапия. Исключительное значение в системе терапевтических мероприятий при менингококковой инфекции имеют средства патогенетического лечения.
Патогенетическая терапия проводится одновременно с этиотропной. Ее основой является борьба с токсикозом. Используют кристаллоидные растворы (Рингера, 5 % раствор глюкозы и др.), макромолекулярные коллоидные растворы (препараты поливинилалкоголя, поливинилпирролидона, декстрана, желатиноль), плазму, альбумин и др. Обычно вводят 40–50 мл жидкости на 1 кг массы тела в сутки под контролем диуреза. При сохраненном сознании часть кристаллоидных растворов можно вводить перорально.
Одновременно проводят профилактику гипергидратации головного мозга путем введения мочегонных средств (фуросемид, или лазикс, этакриновая кислота, или урегит), маннитола. Мочевина применяется с осторожностью из‑за вероятности развития «феномена отдачи» (усиление отека после прекращения действия препарата).
Вместе с инфузионными растворами вводят витамины С, В1 , В2 , В6 глутаминовую кислоту, кокарбоксилазу, АТФ.
В тяжелых случаях менингококковой инфекции показаны глюкокортикостероидные гормоны. Полная доза устанавливается индивидуально, она зависит от динамики основных симптомов и наличия осложнений. Обычно применяют гидрокортизон в дозе 3–7 мг/кг в сутки, преднизолон в дозе 1–2 мг/кг в сутки или другие кортикостероиды в соответствующей дозировке.
Большое значение в лечении больных имеют оксигенотерапия, ультрафиолетовое облучение крови.
Лечение молниеносной менингококкемии заключается в мероприятиях по выведению больного из шока. Как правило, необходима закрытая катетеризация подключичной или другой вены или венесекция и катетеризация открытым способом вены достаточного диаметра. Иногда приходится начинать реанимационные мероприятия с внутриартериального введения жидкостей. Использование адреналина и адреномиметиков не показано из‑за возможности капилляроспазма, усугубления гипоксии мозга и почек и развития острой почечной недостаточности. Применение этих препаратов возможно лишь при отсутствии эффекта в качестве «терапии отчаяния».
В случае возникновения острой почечной недостаточности в результате токсемии и шока показан ранний гемодиализ.
Профилактика. Мероприятия, направленные на источники менингококковой инфекции, включают в себя раннее и исчерпывающее выявление больных, санацию носителей менингококков, изоляцию и лечение больных. В очаге инфекции устанавливается медицинское наблюдение за контактными лицами в течение 10 дней.
Меры, направленные на разрыв механизма передачи инфекции, заключаются в проведении санитарно‑гигиенических мероприятий и дезинфекции. Необходимо по возможности ликвидировать скученность, особенно в закрытых учреждениях (детские сады, казармы и т.п.). В помещениях проводятся влажная уборка с использованием хлорсодержащих дезинфектантов, частое проветривание, ультрафиолетовое облучение воздуха и т.д.
Мероприятия, направленные на восприимчивые контингента, включают в себя повышение неспецифической устойчивости людей (закаливание, своевременное лечение заболеваний верхних дыхательных путей, миндалин) и формирование специфической защиты от менингококковой инфекции. Наиболее перспективна активная иммунизация с помощью менингококковых вакцин.
К настоящему времени создано несколько вакцин, в частности полисахаридные вакцины А и С. Получена также вакцина из менингококков группы В.
Дифтерия
Дифтерия (diphteria) – острое инфекционное заболевание, вызываемое токсигенными коринебактериями, которое характеризуется фибринозным воспалением в месте входных ворот инфекции и токсическим поражением преимущественно сердечно‑сосудистой и нервной систем.
Исторические сведения. Упоминания о дифтерии имеются в трудах Гиппократа, Гомера, Галена. Под названием «смертельная язва глотки», «удушающая болезнь» ее описывали врачи I–II вв. н.э. В начале XIX в. дифтерия была выделена в качестве самостоятельного заболевания французским ученым П.Ф.Бретонно, который предложил название «дифтерит» (от греч. diphthera– пленка, перепонка). В конце XIX в. его ученик А.Труссо анатомический термин «дифтерит» заменил на термин «дифтерия».
Возбудитель инфекции был открыт Т.А.Клебсом в 1883 г. и Ф.Леффлером в 1884 г. Спустя несколько лет Э.Берингом и Э.Ру была получена противодифтерийная сыворотка, позволившая снизить летальность заболевания. В 1923 г. Г.Рамон предложил иммунизацию анатоксином, что явилось основанием для активной профилактики болезни. В результате вакцинации заболеваемость во многих странах мира, в том числе и в нашей стране, резко снизилась. Однако, начиная с 1990г., в крупных городах России, прежде всего в С.‑Петербурге и Москве, из‑за дефектов в проведении вакцинопрофилактики стали регистрироваться эпидемические вспышки дифтерии преимущественно у взрослых. При этом уровень заболеваемости составил до 10–20 человек на 100 000 населения с летальностью 2–4 %.
Этиология. Возбудитель заболевания – corinebacterium diphtheriae, или палочка Леффлера. Дифтерийные коринебактерии – грамположительны, неподвижны, спор не образуют, их концы булавовидно утолщены за счет скоплений полифосфата (так называемые зерна волютина, зерна Бабеша – Эрнста). В мазках располагаются попарно, часто, вследствие деления в виде излома – в виде римской цифры V. При окраске по Нейссеру тело бактерий окрашивается в коричнево‑желтый, а скопления полифосфата – в синий цвет.
Коринебактерии хорошо растут на средах, содержащих сыворотку и кровь (среды Ру и Леффлера). Оптимальные условия роста имеются в среде Клауберга (кровяной агар с добавлением соли теллура). Выделяют три культурально‑биохимических типа С. Diphtheriae: mitis, gravis intermedius, из них наибольшей вирулентностью обладает тип gravis.
Существуют токсигенные и нетоксигенные штаммы С. diphtheriae. Дифтерию вызывают лишь токсигенные штаммы, т.е. коринебактерии, продуцирующие экзотоксины. Токсигенность свойственна лизогенным штаммам С. diphtheriae, несущим умеренные фаги (в частности, β‑фаг), в хромосому которых включен ген, детерминирующий токсикогенез.
Степень токсигенности различных штаммов может колебаться. Единицей измерения силы экзотоксина служит минимальная смертельная доза (Dosis letalis minima – DLМ) – наименьшее количество токсина С. diphtheriae, убивающее морскую свинку массой 250 г в течение 3–4 сут.
В составе экзотоксина С. diphtheriae различают дермонекротоксин, гемолизин, нейраминидазу и гиалуронидазу.
С. diphtheriae устойчивы к низким температурам, длительно сохраняются на поверхности сухих предметов. В присутствии влаги и света они быстро инактивируются. При воздействии дезинфицирующих препаратов в рабочих концентрациях гибнут в течение 1–2 мин, а при кипячении – мгновенно.
Эпидемиология. Источник инфекции – больной человек или носитель токсигенного штамма возбудителя. Больной заразен с последнего дня инкубации до полной санации организма, которая возможна в различные сроки.
Бактерионосители представляют серьезную эпидемиологическую угрозу, особенно в неиммунных организованных коллективах. Необходимо отметить, что число случаев носительства токсигенных штаммов дифтерийных бактерий в сотни раз превышает число больных дифтерией. В очагах дифтерии количество носителей может достигать 10 % и более от числа здоровых лиц.
С практической точки зрения различают транзиторное носительство, когда токсигенные дифтерийные микроорганизмы выделяются во внешнюю среду в течение 1–7 дней, кратковременное – в течение 7–15 дней, средней продолжительности – в течение 15–30 дней и затяжное – более 1 мес. Наблюдается также более продолжительное носительство коринебактерии дифтерии у лиц, которые находятся в тесном контакте с больными дифтерией и у больных хроническими инфекциями верхних дыхательных путей.
Сезонные подъемы заболеваемости приходятся на осенне‑зимний период. Основными путями передачи инфекции являются воздушно‑капельный и воздушно‑пылевой. Возможно заражение дифтерией через предметы – игрушки, белье и др. Не исключается пищевой путь передачи при инфицировании продуктов (молоко, крем и др.)
Восприимчивость к дифтерии зависит от уровня антитоксического иммунитета. В настоящее время в связи с активной вакцинопрофилактикой детей младшего возраста болеют преимущественно взрослые и дети старшего возраста, утратившие иммунитет.
Патогенез и патологоанатомическая картина. Дифтерия – циклическая локализованная форма инфекционного процесса, характеризующегося развитием фибринозного воспаления в месте входных ворот инфекции и токсическим поражением сердечно‑сосудистой, нервной и других систем.
Входными воротами инфекции обычно являются глотка, полость носа, гортань, изредка слизистые оболочки глаз, половых органов и кожа (рана, уши и др.). Проникнув в организм человека, возбудитель поселяется в области входных ворот (слизистая оболочка ротоглотки, носа и др.), продуцируя экзотоксин. В отдельных случаях отмечается кратковременная бактериемия, но ее роль в патогенезе болезни невелика.
Клинические проявления дифтерии обусловлены воздействием экзотоксина, состоящего из фракций. Первая фракция – некротоксин – вызывает в месте входных ворот некроз эпителиального слоя, повышение проницаемости сосудов, их паретическую дилатацию, повышенную ломкость и стаз крови. В результате происходит пропотевание плазмы крови в окружающие ткани. Содержащийся в плазме фибриноген при контакте с тромбопластином некротизированного эпителия превращается в фибрин, который образует на слизистой оболочке фибриновую пленку.
В слизистой оболочке ротоглотки, покрытой многослойным плоским эпителием, развивается дифтеритическое воспаление с повреждением эпителиального слоя и подлежащей соединительной ткани, поэтому фибриновая пленка спаяна с подлежащими тканями и снимается с трудом. В слизистой оболочке, покрытой однослойным цилиндрическим эпителием (гортань, трахея, бронхи), возникает крупозное воспаление с повреждением лишь эпителиального слоя, при этом фибриновая пленка легко отделяется от подлежащих тканей.
Результатом действия некротоксина являются снижение болевой чувствительности и отек тканей в области входных ворот, регионарных лимфатических узлов и подкожной клетчатки шеи.
Вторая фракция дифтерийного токсина, сходная по структуре с цитохромом В, проникнув в клетки, замещает указанный дыхательный фермент, что вызывает блокаду клеточного дыхания и гибель клеток, обусловливает нарушение функции и структуры жизненно важных систем (сердечно‑сосудистой, центральной и периферической нервной систем, надпочечников, почек и др.).
Третья фракция токсина – гиалуронидаза – обусловливает повышение проницаемости сосудов и тканей, усугубляя тканевый отек.
Четвертая фракция токсина является гемолизирующим фактором и обусловливает развитие геморрагического синдрома при дифтерии.
Таким образом, клинические проявления дифтерии определяются местным и общим действием дифтерийного экзотоксина на организм человека. В генезе токсических и гипертоксической форм болезни важное значение придается сенсибилизации организма.
Сердечно‑сосудистые нарушения в раннем периоде обусловлены гемодинамическими расстройствами (стазы, очаги отека, кровоизлияния), а с конца 1‑й – начала 2‑й недели воспалительно‑дегенеративными и иногда некротическими процессами в миокарде.
В периферической нервной системе отмечаются признаки неврита с вовлечением в процесс миелиновой и шванновской оболочек, в поздние сроки болезни развиваются иммунопатологические процессы. Наблюдаются расстройства гемодинамики и деструкция клеток в корковом и мозговом веществе надпочечников; дистрофия почечного эпителия.
В ответ на воздействие дифтерийного токсина в организме человека вырабатываются антимикробные и антитоксические антитела – антитоксины, которые вместе обеспечивают нейтрализацию экзотоксина, элиминацию возбудителя с последующим выздоровлением. У реконвалесцентов формируется антитоксический иммунитет, однако возможны повторные заболевания.
Функциональные расстройства и деструктивные изменения в сердечно‑сосудистой и нервной системах, в почках и других органах, в особенности при неадекватном лечении больных токсическими формами дифтерии, при гипертоксической и геморрагической формах болезни могут стать необратимыми и обусловить гибель больных в различные сроки заболевания.
У большей части инфицированных токсигенными штаммами С. diphtheriae людей развивается инаппарантная форма болезни – бактерионосительство.
Клиническая картина. Инкубационный период колеблется от 2 до 10 дней. Различают ряд форм болезни: по локализации – дифтерия глотки, носа, гортани, дыхательных путей (трахеи, бронхов) и редких локализаций (глаза, кожи, раны, половых органов, уха); по характеру течения – типичные (пленчатые) и атипичные – катаральная, гипертоксическая (фульминантная) и геморрагическая; по степени тяжести – легкая, средней тяжести и тяжелая. При поражении нескольких органов выделяют комбинированную форму болезни. Преобладающей является дифтерия глотки (90–95 % всех случаев болезни).
Дифтерия глотки. Различают локализованную, распространенную, субтоксическую и токсическую формы.
Локализованная форма. При этой форме налеты располагаются только на миндалинах. Болезнь начинается с общего недомогания, снижения аппетита, головной боли, незначительных (у взрослых более выраженных) болей при глотании. Температура повышается до 38°С, реже до 39 °С, держится от нескольких часов до 2–3 сут и нормализуется даже без лечения при сохранении местных изменений. У больных выявляется небольшое увеличение регионарных лимфатических узлов, чаще с обеих сторон. Они умеренно болезненны, подвижны.
Различают пленчатую, островчатую и катаральную формы локализованной дифтерии глотки. Типична пленчатая (сплошная) форма, при которой пленка сероватого цвета, гладкая с перламутровым блеском, четко очерченными краями покрывает всю шарообразную и отечную миндалину. Пленка с трудом снимается, обнажая кровоточащую поверхность. Образование нового налета на месте снятого – важный диагностический признак. Пленка не растирается между предметными стеклами и тонет при погружении в воду. В поздние сроки налеты становятся грубыми, рыхлыми и легче снимаются. На фоне серотерапии они исчезают в течение 3–4 дней. Миндалины умеренно отечны. Отмечается неяркая гиперемия с цианотичным оттенком.
Островчатая форма характеризуется наличием на миндалинах плотно сидящих островков белого или серовато‑белого цвета. Интоксикация слабо выражена или совсем отсутствует, реакция лимфатических узлов незначительная.
Катаральная форма. Относится к атипичному варианту течения дифтерии, при котором отмечается только небольшая гиперемия и отечность миндалин. Температурная реакция и интоксикация могут отсутствовать. В установлении диагноза помогают эпидемиологические данные и бактериологические исследования. Локализованные формы дифтерии глотки без специфического лечения могут прогрессировать и переходить в распространенную.
Распространенная дифтерия глотки. Встречается в 15–18 %. При этой форме налет выходит за миндалины на слизистую оболочку небных дужек, язычка, а иногда и стенки глотки. Симптоматика распространенной формы может быть такой же, как локализованной дифтерии, однако нередко интоксикация и отек миндалин более выражены, лимфатические узлы больших размеров и более болезненны. Отек шейной клетчатки отсутствует.
Токсическая форма. Часто начинается бурно. Температура в первые часы повышается до 40 °С. Больные бледные, вялые, сонливые, жалуются на сильную слабость, головную боль и боли в горле, иногда в области живота, шее. С первых часов в глотке отмечаются гиперемия и отек миндалин, язычка, дужек, который предшествует появлению налетов. При резко выраженном отеке миндалины соприкасаются, почти не оставляя просвета. Налеты вначале в виде нежной паутинообразной сети или желеобразной пленки, легко снимаются, но на этом же месте быстро возникают вновь. На 2–3‑й день болезни налеты толстые, грязно‑серого цвета, полностью покрывают поверхность миндалин, переходят на дужки, маленький язычок, мягкое и твердое небо. Гиперемия глотки к этому времени уменьшается, имеет синюшный оттенок, а отек увеличивается. Язык обложен, губы сухие, потрескавшиеся, изо рта специфический сладковато‑приторный запах, дыхание затруднено, шумное, хрипящее, голос с носовым оттенком. Все шейные лимфатические узлы увеличены, эластичны и болезненны. Развивается отек шейной клетчатки. Выраженность и распространенность отека шейной клетчатки адекватны общетоксическим проявлениям и лежат в основе подразделения токсической дифтерии. Отек шейной клетчатки I степени достигает середины шеи, II степени – распространяется до ключицы, III степени – ниже ключицы.
Особенностью современного течения токсических форм дифтерии у взрослых является частое развитие комбинированных форм с поражением ротоглотки, гортани и носа. Такие формы имеют быстро прогрессирующее злокачественное течение и плохо поддаются терапии.
Субтоксическая форма дифтерии глотки. При этой форме в отличие от токсической интоксикация и изменения в глотке менее выражены, отечность или пастозность шейной клетчатки незначительные. Более выраженный отек шейной клетчатки может быть только с одной стороны.
Гипертоксическая и геморрагическая формы. Относятся к наиболее тяжелым проявлениям дифтерии. При гипертоксической форме резко выражены, симптомы интоксикации: гипертермия, судороги, коллапс, бессознательное состояние. Пленки обширные; характерен прогрессирующий отек ротоглотки и шейной клетчатки. Течение болезни молниеносное. Летальный исход наступает на 2–3‑и день болезни вследствие развития инфекционно‑токсического шока и(или) асфиксии. При геморрагической форме налеты пропитываются кровью, отмечаются множественные кровоизлияния на коже, кровотечения из носа, глотки, десен, желудочно‑кишечного тракта.
Дифтерия гортани, или дифтерийный (истинный) круп. Поражение гортани может быть изолированным и комбинированным (дыхательные пути, глотка и/или нос). В зависимости от распространения процесса различают дифтерийный круп локализованный (дифтерия гортани); дифтерийный круп распространенный: дифтерия гортани и трахеи, дифтерия гортани, трахеи и бронхов – дифтерийный ларинготрахеобронхит.
В клинической картине крупа выделяют три стадии: катаральную, или дисфоническую, стенотическую и асфиксическую.
Дисфоническая стадия начинается постепенно с повышения температуры тела до 38 °С, умеренной интоксикации (недомогание, снижение аппетита), грубого лающего кашля и осиплости голоса. Продолжается она 1–3 сут и в дальнейшем переходит во вторую – стенотическую стадию. Появляются шумное дыхание с затрудненным вздохом, втяжение межреберий, над– и подключичных впадин, яремной ямки, напряжение вспомогательной дыхательной мускулатуры (грудино‑ключично‑сосцевидной, трапециевидной мышц и др.). Голос осиплый или афоничный, кашель постепенно становится беззвучным. Стенотический период продолжается от нескольких часов до 2–3 сут. В переходный период от стадии стеноза в стадию асфиксии присоединяются сильное беспокойство, чувство страха, потливость, цианоз губ и носогубного треугольника, выпадение пульса на входе («парадоксальный пульс»). При отсутствии своевременной помощи наступает асфиксическая стадия. Дыхание становится частым, поверхностным, аритмичным, но менее шумным, уменьшается втяжение податливых мест грудной клетки. Состояние больных прогрессивно ухудшается. Кожные покровы бледно‑серого цвета, цианоз не только носогубного треугольника, но и кончика носа и губ, пальцев рук и ног. Тонус мышц резко снижен, конечности холодные. Пульс частый, нитевидный, артериальное давление падает, зрачки расширены. В дальнейшем нарушается сознание, развиваются судороги, наблюдается непроизвольное отхождение кала и мочи. Смерть наступает от асфиксии.
Своевременное проведение специфической терапии предотвращает последовательное развитие всех стадий дифтерийного крупа. Через 18–24 ч после введения противодифтерийной сыворотки клинические проявления болезни начинают купироваться.
Дифтерия гортани у взрослых имеет ряд особенностей. Классические симптомы крупа такие же, как у детей: сиплый голос, шумное стенотическое дыхание, афония, участие в акте дыхания вспомогательной мускулатуры, однако втяжение при вдохе податливых участков грудной клетки нередко отсутствует. У части больных единственным симптомом поражения гортани является осиплость голоса (даже при нисходящем крупе). О развитии дыхательной и сердечно‑сосудистой недостаточности можно предполагать по бледности кожи, цианозу носогубного треугольника, ослаблению дыхания, тахикардии и экстрасистолии. Эти симптомы служат показанием для оперативного лечения (трахеостомии).
Дифтерия носа. Начало болезни постепенное, с незначительных симптомов интоксикации. Температура тела умеренно повышена или нормальная. Из носа, чаще из одной ноздри, появляются серозные, а затем серозно‑гнойные, сукровичные выделения (катаральная форма), вызывающие мокнутие, образование трещин, корочек в преддверии носа и на верхней губе. Носовые ходы при осмотре сужены из‑за отечности слизистой оболочки, на носовой перегородке обнаруживаются эрозии, язвочки, корочки и кровянистые выделения (катарально‑язвенная форма) или белесоватый пленчатый налет, плотно сидящий на слизистой оболочке (пленчатая форма). Иногда процесс выходит за пределы слизистой оболочки носа, приобретая черты распространенной или токсической формы.
Течение дифтерии носа длительное, упорное. Своевременное введение антитоксической сыворотки приводит к быстрому выздоровлению.
Дифтерия глаз, кожи, ран, уха, наружных половых органов наблюдается редко.
Дифтерия глаз. Фибриновый налет находится на конъюнктиве и может распространяться на глазное яблоко; процесс чаще односторонний. На пораженной стороне веки отечны, уплотнены, из конъюнктивального мешка появляется незначительное гнойное отделяемое с примесью крови. Общее состояние больных нарушается незначительно.
Дифтерия кожи. Развивается при повреждении эпителиального покрова. Образуется плотная фибриновая пленка, наблюдается отечность кожи или слизистых оболочек в месте трещин, царапин, ран, опрелостей, экзематозных участков. Воспалительный процесс у девочек локализуется на слизистых оболочках наружных половых органов. Дифтерия пупочной раны может встречаться у новорожденных.
Клиническая картина дифтерии у привитых. Несоблюдение сроков вакцинации и ревакцинации, а также перенесенные другие заболевания, неблагоприятные экологические и социальные факторы снижают напряженность противодифтерийного иммунитета и создают предпосылки для возникновения дифтерии. Течение дифтерии у привитых обычно достаточно гладкое, реже встречаются осложнения. Интоксикация уменьшается на 2–3‑й день болезни, отек незначительный, пленки чаще всего островчатые, неплотно спаяны с подлежащей тканью, могут самопроизвольно расплавляться, глотка очищается к 3–5‑му дню заболевания. Такая клиническая картина отмечается обычно в тех случаях, когда болезнь возникает на фоне остаточного противодифтерийного иммунитета. При полном отсутствии прививочного иммунитета симптоматика дифтерии не отличается от таковой у непривитых.
Осложнения. Выделяют специфические (токсические) и неспецифические осложнения дифтерии.
Специфические осложнения. Могут развиваться при любой форме заболевания, но чаще наблюдаются при токсических формах дифтерии. К ним относятся миокардит, моно– и поли невриты, нефротический синдром.
Поражения сердечно‑сосудистой системы в раннем периоде токсических и гипертоксических форм обусловлены прежде всего сосудистой недостаточностью и в меньшей степени токсическим поражением миокарда (синдром «инфекционного сердца»). Кожные покровы бледны, цианотичны, пульс слабый, нитевидный, артериальное давление быстро падает. Развивающийся шок может быть причиной смерти.
Миокардиты могут быть ранними и поздними. Ранний миокардит возникает в конце 1‑й – начале 2‑й недели болезни и протекает тяжело с прогрессирующей сердечной недостаточностью. Больные адинамичны, жалуются на боли в области живота, рвоту. Пульс частый, аритмичный, границы сердца расширены, выслушивается систолический шум. Характерны выраженные нарушения ритма (экстрасистолия, синусовая аритмия, ритм галопа). Артериальное давление резко снижается. Печень обычно увеличена, чувствительна.
Поздний миокардит, развивающийся на 3–4‑й неделе, имеет более доброкачественное течение.
Ранние и поздние периферические параличи являются типичными осложнениями дифтерии. Ранние параличи черепных нервов возникают на 2‑й неделе болезни. Чаще отмечаются парез мягкого неба и паралич аккомодации. Голос становится гнусавым, больные не могут задуть горящую свечу, при глотании жидкая пища выливается через нос, отсутствует рефлекс с мягкого неба, небная занавеска неподвижна, свисает или асимметрична, язычок отклонен в непораженную сторону. Иногда больные не могут читать и различать мелкие предметы. Реже наблюдаются офтальмоплегия, птоз, неврит лицевого нерва.
Поздние вялые параличи протекают по типу полирадикулоневрита и возникают на 4–5‑й неделе болезни. Выявляются снижение сухожильных рефлексов, мышечная слабость, расстройство координации, неуверенная походка.
При поражении мышц шеи и туловища больной не в состоянии сидеть, держать голову. Могут возникать параличи гортани, глотки, диафрагмы, при этом голос и кашель становятся беззвучными, больной не способен проглотить пищу и даже слюну, втягивается живот. Эти поражения могут быть изолированными либо встречаются в различных сочетаниях. Полирадикулоневриты исчезают через 1–3 мес с полным восстановлением структуры и функций мышц.
Нефротический синдром развивается в остром периоде болезни и характеризуется главным образом изменениями мочи (большое количество белка, гиалиновых и зернистых цилиндров, эритроцитов и лейкоцитов). Функция почек обычно не нарушена.
Неспецифические осложнения. Из неспецифических осложнений дифтерии возможны пневмонии, отиты, лимфадениты и др.
Прогноз. В первые 2–5 дней смертельные исходы наступают преимущественно в случае токсических форм дифтерии от инфекционно‑токсического шока и асфиксии – в случае распространенного крупа; на 2–3‑й неделе заболевания – в случае тяжелых миокардитов.
Угроза летального исхода у больных с дифтерийным полирадикулитом обусловлена поражением нервов, иннервирующих гортань, дыхательные мышцы и диафрагму (паралич дыхания), а также проводящей системы, сердца (паралич сердца).
Диагностика. Решающее значение приобретает постановка диагноза по клиническим и эпидемиологическим данным. Ведущий клинический симптом дифтерии – наличие фибриновых, плотных белесовато‑сероватых налетов, располагающихся на поверхности слизистых оболочек или кожи.
Для подтверждения диагноза заболевания используют бактериологический метод исследования. Собранный из мест поражения материал, обычно мазки из носа и глотки, засеивают на элективные среды (Леффлера, Клауберга и др.) и помещают в термостат при 37 °С. В случае обнаружения роста на средах через 24 ч сообщают предварительный результат, а через 48–72 ч – окончательный, после изучения биохимических токсигенных свойств возбудителей. Из серологических методов используют РНГА для обнаружения нарастания титра антител в динамике болезни. Перспективно изучение токсинемии.
Дифференциальная диагностика. Дифтерию глотки следует дифференцировать от стрептококковой ангины, ангины Симановского – Плаута – Венсана, инфекционного мононуклеоза, ангинозно‑бубонной формы туляремии, эпидемического паротита. Дифтерию гортани отличают от ложного крупа, возникающего при острой респираторной вирусной инфекции, кори и других заболеваниях.
Дифференциальную диагностику токсической дифтерии следует проводить с паратонзиллярным абсцессом, инфекционным мононуклеозом, эпидемическим паротитом.
Наиболее сложно дифференцировать токсическую дифтерию от паратонзиллярного абсцесса (паратонзиллита). В дифференциальной диагностике паратонзиллита и токсической дифтерии глотки необходимо обратить внимание на следующие особенности течения и симптомы:
1) паратонзиллит часто является осложнением хронического тонзиллита и развивается вслед за повторной ангиной, тогда как токсическая дифтерия глотки чаще всего начинается остро; 2) при паратонзиллите болевой синдром резко выражен с самого начала и нарастает по мере развития заболевания: затруднение и боль при глотании и прикосновении, тризм жевательных мышц, вынужденное положение головы. Уменьшение боли наступает после вскрытия абсцесса или на фоне активной антибиотикотерапии. При токсической дифтерии глотки болевой синдром выражен в меньшей степени и лишь в начальном периоде, затем он ослабевает, несмотря на дальнейшее увеличение отека слизистой оболочки глотки и налетов;
3) паратонзиллиту свойствен односторонний отек глотки, на месте образующегося абсцесса отмечаются локальное выбухание и флюктуация; при токсической дифтерии отек чаще двусторонний, он однородной консистенции и имеет разлитой характер, изменяются лишь его размеры; 4) при паратонзиллите увеличение отека не сопровождается распространением налета за пределы миндалин, при значительном отеке миндалин и мягкого неба налет может отсутствовать. Отечность подкожной клетчатки отмечается редко и не имеет склонности к
распространению; 5) температура тела при паратонзиллите держится до вскрытия абсцесса или уменьшается параллельно стиханию воспалительного процесса под влиянием антибиотиков, при токсической дифтерии глотки она снижается после 3–4‑го дня, несмотря на продолжающийся процесс; 6) характер интоксикации различен: возбуждение, гиперемия лица, тахикардия – при паратонзиллите; адинамия, бледность, гемодинамические нарушения – при токсической дифтерии.
Лечение. Основой лечения больных дифтерией является этиотропная – специфическая и антибактериальная – терапия, проводимая в комплексе с патогенетическими методами в условиях изоляции больного в инфекционный стационар и обеспечения необходимого санитарно‑гигиенического, двигательного и диетического режимов.
Решающее значение в излечении больных имеет ранняя специфическая, преимущественно серотерапия с использованием адекватных доз антитоксической противодифтерийной лошадиной сыворотки (ПДС) «Диаферм» в соответствии с формой и сроками болезни.
Наиболее выраженный эффект серотерапии наблюдается в течение первых суток или часов болезни, при этом в случаях локализованных форм болезни достаточным может быть однократное введение ПДС. К сожалению, при гипертоксических и геморрагических формах, а также при несвоевременном (на 3‑й сутки болезни и позднее) лечении токсических форм дифтерии серотерапия нередко является малоэффективной.
Противодифтерийную антитоксическую сыворотку вводят в соответствии с общими правилами применения гетерологичных белковых препаратов, направленными на предупреждение анафилактических реакций.
Больным гипертоксической, геморрагической и токсическими формами дифтерии ПДС назначают независимо от результатов определения чувствительности к гетерологичному белку, но в случаях сенсибилизации сыворотку вводят на фоне комплекса мероприятий, предупреждающих развитие анафилаксии, в частности анафилактического шока.
При локализованных и распространенных формах дифтерии ПДС вводят 1 раз в сутки внутримышечно, при субтоксической форме – дважды в сутки с интервалом 12 ч.
При токсических, гипертоксических и геморрагических формах дифтерии часть суточной дозы ПДС вводят внутривенно капельно на фоне глюкокортикостероидной и дезинтоксикационной терапии, предпочтительно в условиях отделения реанимации и интенсивной терапии (ОРИТ).
Лечебный эффект серотерапии проявляется уже в первые часы лечения в виде уменьшения степени отека тканей, площади налетов, их истончения («подтаивания») и(или) исчезновения. При развитии положительного эффекта, улучшении состояния больного последующая суточная доза ПДС может быть уменьшена вдвое. ПДС отменяют по исчезновении налетов.
Продолжительность серотерапии колеблется от 1 –3 сут при локализованных формах до 5–7 сут и иногда более – при токсических, гипертоксической и геморрагической формах дифтерии; в последних случаях суммарная доза ПДС может составлять 1–1,5 млн АЕ и более. При длительной и массивной серотерапии нередко развиваются проявления сывороточной болезни, требующие дополнительной гипосенсибилизирующей терапии.
Наряду с ПДС получен положительный эффект от использования препаратов из донорской крови – противодифтерийной плазмы и иммуноглобулина, титрованных на антитоксические антитела.
Одновременно с серотерапией проводят антибиотикотерапию с использованием бенэилпенициллина, эритромицина, цефалоспориновых производных, рифампицина и т.д. в общепринятых дозах в течение 5–10 дней.
Местно назначают полоскания растворами антисептических препаратов фурацилина, риванола и др.
Для дезинтоксикации и улучшения гемодинамики назначают нативную плазму, неокомпенсан, реополиглюкин, гемодез, 10 % раствор глюкозы. Вместе с растворами вводят кокарбоксилазу, аскорбиновую кислоту, инсулин. При токсических формах показаны кортикостероиды (гидрокортизон по 5–10 мг/кг, преднизолон по 2–5 мг/кг массы тела в сутки в течение 5–7 дней). Для предупреждения ДВС‑синдрома вводят гепарин. Эффективны плазмаферез, гемосорбция и другие эфферентные методы дезинтоксикации.
Появление признаков миокардита служит показанием к назначению АТФ, кокарбоксилазы, антиоксидантов, нестероидных противовоспалительных препаратов (индометацин и др.) и(или) глюкокортикостероидов. При нарушениях сердечного ритма эффективно применение кардиостимуляторов. При невритах, вялых параличах с первых дней вводят витамин В1 , стрихнин, прозерин, дибазол. Тяжелые полирадикулоневриты с нарушением дыхания требуют назначения искусственной вентиляции легких, гормонотерапии.
Больным необходим строгий постельный режим в течение 3–4 нед при осложненных токсических формах и 5–7 нед и более – при развитии осложнений.
Особенность лечебных мероприятий при дифтерии гортани обусловлена необходимостью купировать явления стеноза. Это достигается хорошей аэрацией палаты, назначением теплого питья (чай, молоко с содой), паровыми ингаляциями с добавлением натрия гидрокарбоната, гидрокортизона (125 мг на ингаляцию), введением эуфиллина, эфедрина, антигистаминных и седативных препаратов. Для уменьшения гипоксии применяют увлажненный кислород через носовой катетер, для улучшения дыхания удаляют пленки с помощью электроотсоса. Если тепловые и отвлекающие процедуры не оказывают терапевтического эффекта, назначают преднизолон в дозе 2–5 мг/кг в сутки до уменьшения стеноза. При прогрессировании явлений стеноза в предасфиксической стадии показана срочная назофарингеальная интубация, а при ее затруднении вследствие отека тканей глотки или гортани и при нисходящем крупе – трахеостомия с удалением фибриновых пленок с помощью электроотсоса.
Лечение бактерионосителей. Транзиторное носительство не требует лечения. При упорном носительстве токсигенных штаммов дифтерийной палочки необходимо повышать общую сопротивляемость организма (полноценное питание, прогулки, ультрафиолетовое облучение) и санировать носоглотку. Назначаются антибиотики (эритромицин, тетрациклин и др.) с учетом чувствительности к ним микроорганизма – возбудителя.
Профилактика. Главное место в профилактике дифтерии отводится иммунизации.
Особое внимание при проведении вакцинопрофилактики дифтерии обращается на достижение достаточного уровня иммунной прослойки (90–95 %), в первую очередь в организованных коллективах (детских, студенческих, военнослужащих и др.), поскольку именно эти лица являются группами риска заражения и распространения инфекции. Современные методы иммунологического скрининга позволяют выявлять серонегативных лиц, которые подлежат дополнительной вакцинации. Противопоказания к проведению прививок против дифтерии крайне ограничены и указаны в наставлении к вакцинным препаратам; весьма важным представляется правильный их учет с обоснованием медицинских отводов.
В очаге проводят мероприятия, включающие госпитализацию больных, бактериологическое исследование материала из носа и глотки у всех контактных, текущую и заключительную дезинфекцию.
После госпитализации последнего больного (носителя токсигенного штамма возбудителя) за очагом устанавливается медицинское наблюдение сроком на 7 дней с использованием методов экстренного клинико‑иммунологического контроля в отношении всех контактных (контингента риска). При выявлении восприимчивых к дифтерии (серонегативных и ранее не привитых) лиц проводится их вакцинация.
В отношении носителей токсигенных дифтерийных палочек проводят аналогичные мероприятия с изоляцией и лечением на дому.
Лабораторными критериями санации от токсигенного штамма дифтерийного микроба служат отрицательные результаты 3‑кратного бактериологического обследования, которое проводят не ранее 36 ч после отмены антибиотиков с интервалом 2 сут между забором материала из носа и глотки. Носители нетоксигенных штаммов изоляции не подлежат, их лечение осуществляется по клиническим показаниям.
Скарлатина
Скарлатина (scarlatina) – острая антропонозная инфекция, вызываемая β‑гемолитическим стрептококком группы А и характеризующаяся интоксикацией, поражением зева, точечной экзантемой и нередко регионарным лимфаденитом.
Название заболевания происходит от итальянского слова – scarlatina багровый, пурпурный.
Исторические сведения. Скарлатина известна с давних времен, но до середины XVI в. не выделялась из ряда других детских инфекций, протекающих с экзантемой. В 1564 г. неаполитанский врач Ж.Ф.Инграссиа выделил это заболевание и дал ему название «rossania». Любопытно и показательно средневековое испанское название этой болезни «garotillo» от слова «гарота» – железный ошейник, с помощью которого проводили казнь удавлением. Это, в Частности, свидетельствует о том, что скарлатина в те времена протекала крайне тяжело с выраженными шейными лимфаденитами. Это положение неоднократно подтверждалось и в дальнейшем. Англичанин Т.Сиденгам, давший полное описание скарлатины в 1675 г. как довольно легкого заболевания, в 1679 г. писал о нем как о тяжелейшей болезни и даже сравнивал его по тяжести течения и исходов с чумой. То же произошло с французским врачом Бретонно через 150 лет: за время своей клинической практики он сменил свои впечатления о течении скарлатины на диаметрально противоположные. Во второй половине XIX в. Н.Ф.Филатов писал об этом заболевании как об очень тяжелом и опасном для жизни.
В XIX в., когда бурно развивалась бактериология, во всех странах был проявлен исключительный интерес к поискам возбудителя скарлатины. Было предъявлено много претендентов на эту роль, обсуждались различные теории, касающиеся причин скарлатины. Одним из первых сформулировал стрептококковую теорию происхождения этого заболевания – и оказался прав – отечественный ученый Г.Н.Габричевский, он же отдал много сил разработке серотерапии и серопрофилактики скарлатины. Впоследствии большой вклад в понимание патогенеза и клинической картины скарлатины внесли супруги Д.Х. Дик и Д.Ф.Дик, выделившие токсин из бульонных культур и указавшие на токсинообразование как на отличительный признак возбудителя заболевания от других стрептококков.
Нельзя не отметить работы Гоффа, который изучил вспышку скарлатины на Фарерах в 1873 г. (после отсутствия этой инфекции на островах в течение 57 лет) и дал основополагающие сведения об эпидемиологии скарлатины.
Этиология. Возбудитель скарлатины – β‑гемолитический стрептококк группы А из семейства Streptососсасеа. Имеет округлую форму, в мазках обнаруживается в виде различной длины цепочек. Грамположителен. Относится к аэробам, но хорошо размножается и в анаэробных условиях. При посеве на кровяной агар вызывает гемолиз. Серологическая классификация проводится по антигенным свойствам С‑полисахарида. Группа А стрептококков, к которым относится возбудитель скарлатины, включает более 80 серотипов. Несмотря на исключительный интерес к проблеме стрептококковых инфекций и огромному числу солидных работ в этой области, до сих пор не удается получить ясный ответ на вопрос о специфических свойствах типов стрептококков А, способных вызвать скарлатину. Известно, что возбудитель продуцирует эритрогенный (скарлатинозный) токсин.
β‑Гемолитический стрептококк группы А устойчив во внешней среде. Выдерживает кипячение в течение 15 мин, устойчив к воздействию многих дезинфицирующих средств (сулема, хлорамин, карболовая кислота).
Эпидемиология. Скарлатина – антропоноз, источником инфицирования является больной человек в острый период скарлатины и в период реконвалесценции, если имеется реконвалесцентное бактериовыделение. Возможно заражение и от носителей гемолитического стрептококка А, не имевших и не имеющих симптомов скарлатины, частота такого носительства возрастает осенью при формировании детских коллективов.
Механизм передачи инфекции – аэрогенный, преобладающий путь инфицирования – воздушно‑капельный во время различных экспираторных актов (чиханье, кашель, крик и т.д.) в виде капельной фазы аэрозоля как фактора передачи возбудителя. Имеет значение пылевой аэрозоль, загрязняющий одежду, постельное белье, игрушки, мебель. Возбудитель сохраняется на них в течение нескольких суток, что повышает риск инфицирования в тесных малых по объему помещениях и при скученности людей.
Возможно инфицирование контактным механизмом (актуален при экстрабуккальной скарлатине).
Восприимчивы к скарлатине лица, не имеющие специфического антитоксического иммунитета – дети и взрослые. Дети первых 6–12 мес жизни имеют обычно пассивный иммунитет, приобретенный от матери, и болеют очень редко (1–2 % от общего числа больных). Считается также, что чувствительность к возбудителю уменьшается после 20 лет и падает после 40 лет – эти возрастные контингента реже вовлекаются в эпидемический процесс. Индекс восприимчивости равен 0,4.
Скарлатине свойственна осенне‑зимняя сезонность.
Иммунитет после скарлатины стойкий, ненапряженный, антитоксический.
Патогенез и патологоанатомическая картина. Входные ворота инфекции – зев и носоглотка. Здесь возбудитель фиксируется и продуцирует токсины. Основным из них является эритрогенный экзотоксин (токсин Диков, или токсин общего действия, или токсин сыпи), обусловливающий интоксикацию и ответственный за большинство симптомов скарлатины. Он обладает антигенными свойствами и приводит к формированию анти– токсического иммунитета. Выделяются также эндотоксины, иногда называемые токсинами «частного приложения», определяющие инвазивность и агрессивность β‑гемолитического стрептококка А. К ним относят стрептолизин, лейкоцидин, энтеротоксин и различные ферменты (стрептокиназа, гиалуронидаза и др.). Иммунитет к ним типоспецифичен и нестоек. Все сказанное объясняет тот факт, что повторные случаи скарлатины в общем редки и что человек, переболевший скарлатиной, может легко заразиться другими стрептококковыми инфекциями (рожей, ангинами, пиодермиями и т.д.).
Патогенез скарлатины сложен, в дидактических целях в нем искусственно выделяют токсический, септический (бактериальный), аллергический компоненты. Доминирует токсический компонент. Токсины обусловливают токсемию, которая является причиной генерализованного расширения мелких сосудов во всех органах, в том числе в коже и слизистых оболочках. Поэтому наблюдаются яркая гиперемия кожных покровов и резкое полнокровие языка и зева, которые так типичны для скарлатины. Точечная сыпь – тоже проявление токсемии, результат расширения сосудов кожи, идущих перпендикулярно или тангенциально к поверхности покровов. Одновременно наблюдаются небольшая периваскулярная инфильтрация и умеренный отек дермы. Эпидермис соответственно очажкам гиперемии пропитывается экссудатом, в нем развивается паракератоз, при котором между ороговевшими клетками сохраняется прочная связь [Ивановская Т.Е., 19891. Этим объясняется отторжение крупных пластин рогового слоя кожи, особенно там, где он самый толстый (ладони, подошвы), что в клинической картине проявляется пластинчатым шелушением в исходе скарлатинозной сыпи. В головном мозге и вегетативных ганглиях возникают расстройства кровообращения и в особо тяжелых случаях – дистрофические изменения нейронов.
В конце 1‑й – начале 2‑й недели нарастает роль аллергического компонента патогенеза в результате сенсибилизации продуктами жизнедеятельности и особенно распада микроорганизмов. В клинической картине проявления аллергии возможны (но не обязательны) на 2‑й, чаще 3‑й неделе заболевания. Соответствующая перестройка иммунной системы, нарушение проницаемости защитных барьеров могут привести к развитию гломерулонефрита, артериитов, поражению сердца и другим осложнениям иммунопатологического характера.
С другой стороны, эти изменения иногда способствуют распространению возбудителя из лимфатических образований зева по контакту и гематогенно, в результате чего образуются септические очаги с соответствующей патологоанатомической картиной. В лимфатическом аппарате зева видны глубокие очаги некрозов, в лимфатических узлах – очаги некроза и лейкоцитарной инфильтрации вплоть до гнойного воспаления. В селезенке развиваются типичные септические изменения. В остальных органах – септическая инфильтрация клетками миелоидного ряда с большим количеством эозинофилов, что типично именно для скарлатины. Развитие гнойного лимфаденита с зонами глубокого некроза может привести к флегмоне шеи с последующей аррозией крупных сосудов и тяжелым кровотечением. Распространение гнойно‑некротических процессов в этой области может вызвать развитие отитов, оститов височной кости, перейти на твердую мозговую оболочку, венозные синусы и иметь тяжелейшие последствия.
Клиническая картина. Инкубационный период продолжается 1–11 дней, в среднем 5–6 дней.
Заболевание начинается остро. Кардинальными признаками скарлатины являются лихорадка, поражение зева, первичный лимфаденит и сыпь.
Лихорадка – самый первый симптом скарлатины. Температура тела поднимается внезапно, обычно до высоких цифр – 38–39 °С и даже 40 °С, очень часто сопровождается однократной или многократной рвотой. На фоне высокой температуры тела больные остаются подвижными, возбужденными, болтливыми, они бегают, кричат, становятся требовательными и плохо управляемыми. В самых тяжелых случаях ночью развивается бред, больные становятся вялыми, угнетенными.
Пульс частый, степень тахикардии не соответствует высоте температуры тела, превышаются обычные соотношения.
Поражение зева при скарлатине представляет собой яркую разлитую гиперемию, охватывающую боковые миндалины (а часто и все кольцо Пирогова – Вальдейера, в которое, кроме боковых, входят носоглоточная миндалина, парные аденоидные образования у наружного отверстия евстахиевых труб и язычная миндалина, расположенная у корня языка), дужки, язычок, мягкое небо и заднюю стенку глотки и резко обрывающуюся у того места, где слизистая оболочка мягкого неба переходит в слизистую оболочку, покрывающую твердое небо. Линия обрыва образует заметные неровности края гиперемии. Ранее авторы характеризовали подобную картину как «пылающий зев с языками пламени». Иногда на этом фоне видна энантема: очень мелкие, точечные красные пятна, чаще всего в центре мягкого неба, чуть выше язычка.
Иногда, в особенно тяжелых случаях, ко 2‑му дню (реже на 3‑й день) заболевания на пылающих миндалинах появляются налеты – слизистые, фибринозные и даже некротические. В современных условиях такие налеты встречаются крайне редко.
Резкая гиперемия и отек зева сопровождаются болями в горле, на которые больной жалуется с первых часов заболевания на фоне появившейся лихорадки. В доантибиотическую эру типичные изменения в зеве держались около 6 дней, а при появлении налетов до 8–14‑го дня. В настоящее время на фоне адекватной антибиотикотерапии и правильного патогенетического лечения сроки поражения зева могут сокращаться.
Упомянутые выше лимфатические образования объединяются в кольцо Пирогова – Вальдейера лимфатическими путями, которые далее соединяют их с регионарными лимфатическими узлами. Первичный лимфаденит тоже является ранним симптомом скарлатины, чаще он двусторонний, реже односторонний. Увеличенные лимфатические узлы плотны на ощупь, слабо болезненны. Чаще увеличиваются передневерхние шейные лимфатические узлы. В современных условиях лимфаденит редко бывает значительным и встречается не у всех больных.
Сыпь появляется, как правило, в 1‑й день болезни, реже на 2‑е сутки заболевания. Она всегда располагается на фоне гиперемированной кожи и лучше всего видна там, где кожа особенно нежна: на сгибательных поверхностях конечностей, передней и боковой поверхности шеи, боковых поверхностях груди, на животе, внутренней и задней поверхностях бедер со сгущением в местах естественных сгибов – подмышечных, локтевых, паховых, подколенных областях.
Наиболее типичный элемент скарлатинозной сыпи – очень мелкое пятнышко, размером буквально с точку, отсюда ее описание как точечной сыпи (иногда не очень правильно с семантической точки зрения как мелкоточечной). В местах механической травмы, а также в сгибах можно видеть линии (симптом) Пастиа – сгруппированные петехиальные элементы, которые «живут» дольше точечной сосудистой сыпи и позволяют поставить правильный диагноз при запоздалом обращении больного к врачу. Редко можно встретить не совсем типичную сыпь в виде очень мелких папул розового цвета – мелкопапулезную сыпь, и совсем редко – так называемую милиарную сыпь, которая имеет вид мельчайших (до 1 мм в диаметре) пузырьков, наполненных серозным содержимым и располагающихся главным образом на коже живота и внутренних поверхностей бедер.
Очень характерно расположение сыпи на лице – она как бы щадит носогубной треугольник, который получил название скарлатинозного (симптом Филатова, который первым указал на эту особенность скарлатины). Видимая бледность кожи в этой области обусловлена раздражением токсином нижней части ганглия тройничного нерва (гассерова ганглия) и соответственно сосудосуживающих волокон III ветви тройничного нерва. Бледность носогубного треугольника особенно подчеркивается горящими щеками и яркими припухшими губами, что придает неповторимое своеобразие внешнему виду больных скарлатиной. Н.Ф.Филатов считал, что диагноз скарлатины можно установить во многих случаях, не раздевая больного, по внешнему виду его лица. В типичных случаях это, безусловно, соответствует действительности даже при современном, более легком течении этого заболевания.
При надавливании на покрытую сыпью кожу сыпь исчезает, таким образом можно получить «симптом ладони» (если прижать кожу больного ладонью, ее белый отпечаток некоторое время хорошо виден, но через несколько секунд исчезает, на этом месте вновь обнаруживается сыпь на гиперемированнном фоне кожи).
На 4–5‑й день болезни (при легких формах и раньше) сыпь начинает бледнеть и исчезает, сменяясь шелушением. Эпидермис отслаивается при скарлатине, пластами, особенно на пальцах рук и ног. Пластинчатое шелушение очень характерно для этого заболевания и позволяет в большинстве случаев уверенно ставить ретроспективный диагноз на 2–3‑й неделе течения скарлатины.
Очень характерны при этом заболевании изменения языка. В первые сутки инфекции он покрывается, особенно у корня языка, обильным белым налетом (что обычно наблюдается при всех инфекциях с выраженной интоксикацией), но с 3–4‑го дня он начинает очищаться с кончика и краев языка, обнажая малинового цвета поверхность с гипертрофированными сосочками. Отсюда название этого симптома – «скарлатинозный малиновый цвет» (за сходство с ягодой малины, а не только за его цвет). К концу 1‑й – началу 2‑й недели заболевания цвет языка нормализуется, но большие, выступающие сосочки хорошо видны до 3‑й недели.
Важное дифференциально‑диагностическое значение имеют симптомы симпатикотонии – сухие теплые (горячие) кожные покровы, тахикардия, блестящие глаза, активное поведение больного, выраженный и стойкий белый дермографизм. Нередко это является неоценимым подспорьем в разграничении скарлатины от скарлатиноподобной лихорадки (одной из клинических форм псевдотуберкулеза). При последней дети вялые, с грустными глазами, «мокрые», дермографизм у них обычно красный.
При неосложненном течении заболевания бронхолегочная система не изменяется. Тоны сердца громкие, наблюдаются тахикардия, умеренное повышение АД. Печень и селезенка не увеличиваются. При пальпации кишечника обычно никаких изменений обнаружить нельзя, хотя имеется склонность к запорам (что характерно для всякой симпатикотонии). В гемограмме, как правило, обнаруживается умеренный лейкоцитоз с небольшим сдвигом лейкоцитарной формулы влево. СОЭ обычно повышена. Со 2‑й недели заболевания возможна эозинофилия. Самые легкие формы скарлатины протекают без гематологических изменений. В осадке мочи могут появляться белок, эритроциты, гиалиновые цилиндры, что свидетельствует об интоксикационном синдроме.
Скарлатина протекает в легкой, средней тяжести и тяжелой формах. Тяжелые формы заболевания в настоящее время – большая редкость, в прошлом, в частности в XIX в., скарлатина была почти всегда очень тяжелым заболеванием с опасными для жизни осложнениями, наводившим на матерей не меньший ужас, чем дифтерия.
При легкой форме скарлатины (в наши дни она составляет более 65 % случаев заболевания) температура тела поднимается не выше 38,5 °С, иногда остается субфебрильной и даже нормальной. Рвота обычно однократная. Жалобы на умеренные боли в горле, недомогание, головную боль. Поражение зева – типичное, без налетов и некрозов, держится 4–5 дней. Точечная сыпь также типична, угасает к 3–4‑му дню заболевания и завершается крупнопластинчатым шелушением. Регионарные лимфадениты встречаются редко. При развитии последних увеличение шейных лимфатических узлов незначительное, болезненность их умеренная. В гемограмме нормоцитоз или небольшой лейкоцитоз.В осадке мочи изменений может не быть.
Средней тяжести форма скарлатины встречается в трети всех случаев заболевания. Она характеризуется более выраженной интоксикацией, повышением температуры тела с ознобами и жаром до 39 °С и выше, что сопровождается повторной рвотой. Поражение зева ярко выражено, на фоне пылающего зева у некоторых больных можно видеть выпот в лакуны или нагноившиеся фолликулы миндалин. Сыпь типична, сохраняется в течение 5–6 дней, иногда можно видеть единичные или сгруппированные петехии. В гемограмме – лейкоцитоз со сдвигом лейкоцитарной формулы влево, эозинофилия непостоянна. В осадке мочи иногда появляются следы белка, эритроциты, гиалиновые цилиндры как признаки интоксикации.
Тяжелая форма скарлатины протекает либо с преобладанием симптомов выраженной интоксикации (токсическая форма), либо с септическими проявлениями (септическая форма), либо с сочетанием крайних степеней интоксикации и септических очагов (токсикосептическая форма). При токсической форме температура тела бурно повышается до 40–41 °С и выше, синдром интоксикации представлен ярко и во всем объеме, с многократной рвотой и преобладанием угнетения ЦНС (у некоторых больных возможно ее возбуждение с бредом, менингизмом и судорогами). Все характерные для скарлатины симптомы также выражены во всей своей полноте и яркости, часто встречаются геморрагические элементы сыпи наряду с типичной точечной экзантемой. Тахикардия доходит до 150–180 в минуту, тоны сердца приглушаются, у некоторых больных развивается коллапс. В моче – протеинурия, гематурия, цилиндрурия.
Септическая форма– исключительная редкость в настоящее время, она развивается у детей младшего возраста, ослабленных той или иной сопутствующей патологией, страдающих первичными или вторичными иммунодефицитами. В зеве на фоне типичных скарлатинозных изменений в силу нарастающих микроциркуляторных расстройств возникают некрозы, быстро присоединяется условно‑патогенная микрофлора и развивается гнойно‑некротическая ангина. Стрептококки преодолевают кольцо Пирогова – Вальдейера, развивается лимфаденит, per contituitatem возбудители попадают в близлежащие органы: возникают гнойные отиты, гаймориты, этмоидиты, мастоидиты. При прорыве стрептококков в кровь может развиться сепсис в форме септицемии или септикопиемии. Как и при других этиологических формах сепсиса, увеличиваются печень и селезенка.
Отдельно рассматривается экстрабуккальная скарлатина, при которой входными воротами являются раневая, ожоговая, послеродовая, послеоперационная поверхности. В этом случае поражения зева и шейных лимфаденитов не бывает. Сыпь нередко распространяется по всему телу именно от ворот инфекции. В остальном клиническая картина скарлатины остается типичной.
Осложнения. В полном соответствии с патогенезом скарлатины ее осложнения можно разделить на три группы. Первая группа токсических осложнений включает развитие острой сердечно‑сосудистой недостаточности (коллапс) и токсико‑инфекционного шока. Во вторую группу входят ранние и поздние (вторичные) бактериальные осложнения: отиты, гнойные лимфадениты, заглоточные абсцессы, синуситы, мастоидиты, абсцесс головного мозга, синустромбоз, менингит, медиастинит, флегмона желудка, сепсис и т.д. Третья группа – так называемые аллергические (иммунопатологические) осложнения: постстрептококковый гломерулонефрит (с возможным исходом в нефросклероз), миокардит, васкулиты, бородавчатый эндокардит, фибриноиды интимы крупных сосудов с исходом в склероз.
Особенности скарлатины у взрослых. Взрослые болеют редко; необходима настороженность в отношении экстрабуккальной скарлатины в хирургических, акушерских, ожоговых стационарах. Течение заболевания у взрослых обычно легкое, осложнения крайне редки.
Прогноз. В абсолютном большинстве случаев благоприятный, при наличии осложнений – серьезный. Летальность в настоящее время близка к нулю, но в последние годы описано несколько случаев смерти детей от септической и токсико‑септической форм скарлатины, протекавших на фоне респираторных вирусных инфекций.
Диагностика. Базируется на клинических данных с учетом эпидемиологического анамнеза. Подтверждают диагноз выделением β‑гемолитического стрептококка группы А. Серологическая диагностика скарлатины не разработана. Для ранней диагностики возможных осложнений делают повторные анализы мочи, контроль гемограммы.
Дифференциальная диагностика. Дифференциальный диагноз проводят с псевдотуберкулезом, кишечным иерсиниозом, краснухой, аллергической сыпью.
Лечение. В типичных легких и средней тяжести случаях скарлатины назначают постельный режим на 6–7 дней, щадящую диету, обильное витаминизированное питье (соки, морсы), фрукты. Основой терапии являются антибиотики, к которым чувствителен возбудитель скарлатины. В течение нескольких десятилетий наиболее эффективным был и остается бензилпенициллин, который следует вводить в соответствии с его фармакодинамикой и фармакокинетикой не реже чем через 4 ч. Можно сочетать внутримышечное введение натриевой или калиевой соли бензилпенициллина и пероральный прием феноксиметилпенициллина в возрастных дозах. Курс лечения обычно составляет 7 дней. Эффективны эритромицин и одеандомицин в возрастных дозах. При наличии непереносимости указанных препаратов или противопоказаний к их применению можно использовать левомицетин в соответствующей дозировке.
Старшим детям, особенно страдающим хроническим тонзиллитом, следует назначить полоскание горла в первые 2–3 дня болезни раствором фурацилина (1:5000), настоем или отваром ромашки, эвкалипта, календулы и т.д. Показана витаминотерапия. Гипосенсибилизирующие средства применяют при неблагоприятном аллергическом статусе больного.
При тяжелых формах скарлатины госпитализация больных абсолютно необходима. В стационаре проводится интенсивная антибактериальная и дезинтоксикационная терапия путем внутривенных трансфузий коллоидных и кристаллоидных растворов (поровну), по показаниям вводят кардиотропные средства. При возникновении осложнений проводят их адекватное лечение с привлечением специалистов – нефрологов, кардиологов, оториноларингологов, невропатологов.
Профилактика. Специфическая профилактика не разработана. В детском дошкольном учреждении и в первых двух классах школы при выявлении больного скарлатиной объявляется карантин. Заболевший ребенок допускается в коллектив после клинического выздоровления, отрицательных результатов посева слизи из зева и носа на β‑гемолитический стрептококк группы А (обычно на это уходит 10 дней) и еще 12 дней после выздоровления. При реконвалесцентном бактериовыделении проводят антибиотикотерапию (обычно эритромицином), усиленную витаминотерапию. Полезным бывает капельное введение 5–6 раз в день 2–3 капель 5–10 % раствора аскорбиновой кислоты в каждый носовой ход.
В случае домашнего содержания ребенка силами родителей при консультации врача‑педиатра и(или) эпидемиолога проводят ежедневную текущую дезинфекцию, в день выздоровления – заключительную дезинфекцию.
Взрослые реконвалесценты после клинико‑бактериологического выздоровления переводятся на 12 дней на работу, не связанную с работой с детьми, хирургическими больными, роженицами и родильницами.
Коклюш
Коклюш (pertussis) – острая антропонозная воздушно‑капельная бактериальная инфекция, наиболее характерным признаком которой является приступообразный спазматический кашель.
Исторические сведения. Впервые эпидемия коклюша описана Г. де Байю в Париже в 1578 г., в XVII в. описание эпидемии в Англии представил Т.Сиденгам, в XVIII в. о коклюше в Голландии сообщил Хоффманн. В XVIII в. появилась первая монография по коклюшу, созданная А.Бренделом и Бассивилле. Подробное описание коклюша сделал Н.Ф.Филатов. В 1900 и 1906 гг. возбудитель выделен из откашливаемой слизи и подробно изучен Ж.Борде и О.Жангу.
В 1957 г. в нашей стране создана убитая коклюшная вакцина, с 1965 г. прививки проводятся ассоциированной вакциной (АКДС). Большой вклад в учение о коклюше внесли отечественные ученые М.Г.Данилевич, А.И.Доброхотова, В.И.Иоффе, С.Д.Носов и их сотрудники.
Этиология. Возбудитель – bordetella pertussis, или палочка Борде‑Жангу, – мелкий грамотрицательный неподвижный микроорганизм, имеющий вид короткой палочки с закругленными краями. Спор не образует. Хорошо окрашивается всеми анилиновыми красителями. Строгий аэроб. Очень чувствителен к факторам внешней среды – солнечному свету, повышению температуры, всем дезинфектантам. Возбудитель коклюша требователен к питательным средам. Хорошо растет на картофельно‑глицериновом агаре с добавлением 25–30 % дефибринированной сыворотки человека или животных, а также на казеиново‑угольном агаре (среда КУА), которая широко используется в лабораторной диагностике коклюша. Температурный оптимум роста – 35–37°С, колонии бордетелл появляются на плотных средах через 48–72 ч, а иногда и позже и внешне напоминают капельки ртути. С биохимической точки зрения коклюшная палочка инертна.
Антигенная структура возбудителя коклюша очень сложна. Различают три основных серологических типа: 1, 2, 3; 1,2, 1,3. Считается, что наибольшей вирулентностью обладают типы, содержащие антиген 2, особенно тип 1,2. Доказана циркуляция в очагах коклюша двух или всех трех серотипов возбудителя.
Кроме агглютиногенов (на основании которых проводится серотипирование), в антигенную структуру входят гемагглютинины, токсин, лимфоцитозстимулирующий фактор, аденилциклаза, защитный фактор. Токсин представлен термолабильной (экзотоксин) и термостабильной (эндотоксин) фракциями.
Эпидемиология. Коклюш – строгий антропоноз. Источником инфекции является больной человек с любой формой инфекционного процесса: тяжелой, средней тяжести, легкой, бессимптомной (бактериовыделение). Наибольшую опасность представляют больные в катаральный период заболевания и в 1‑ю неделю спазматического кашля – у 90–100 % из них выделяется коклюшная палочка. На 2‑й неделе заразительность больных снижается, возбудитель можно выделить лишь у 60–70 % больных. На 3‑й неделе Bordetella pertussis обнаруживают лишь в 30–35 % случаев, в дальнейшем – не более чем у 10 % больных. Через 4 нед от начала заболевания больные практически не заразны и для окружающих не опасны. Сложность состоит в том, что в катаральный период диагноз коклюша устанавливается очень редко (особенно при отсутствии ясных указаний на контакт с больным коклюшем), кроме того, распространены стертые и атипичные формы заболевания (особенно у взрослых). Именно поэтому источник инфекции при коклюше очень активен, его изоляция обычно бывает запоздалой и мало влияет на распространение заболевания.
Передача возбудителя происходит воздушно‑капельным путем, при непосредственном общении с больным, так как возбудитель рассеивается вокруг больного не более чем на 2–2,5 м и малоустойчив во внешней среде.
Восприимчивость людей не зависит от возраста, но зависит от наличия и напряженности иммунитета, инфицирующей дозы и вирулентности возбудителя, преморбидного фона и генетической конституции. У непривитых людей в обычных условиях восприимчивость высока, достигает 0,7–0,75 (из 100 человек, вступивших в тесный контакт с больным, заболевает 70–75). Особый контингент восприимчивых лиц составляют новорожденные, которые не получают пассивного иммунитета от матери, даже если она имеет антитела к Bordetella pertussis. Таким образом, человек восприимчив к коклюшу с первых дней жизни, это крайне важно учитывать в работе, так как новорожденные и дети до 1 года жизни болеют коклюшем тяжело и не совсем типично, среди них очень велика летальность от этой инфекции.
После перенесенного заболевания остается стойкий и напряженный, практически пожизненный иммунитет. Повторные случаи коклюша крайне редки.
В динамике эпидемического процесса сохраняется цикличность, обычно через 3–4 года происходят подъемы заболеваемости. Для коклюша характерна сезонность: увеличение заболеваемости начинается в июле – августе и достигает пика в осенне‑зимний период, но в принципе циркуляция возбудителя среди населения не прекращается в течение всего года.
В довакцинальный период коклюшу была свойственна выраженная очаговость, когда большинство детей заражались в детских учреждениях во время вспышки. В настоящее время эта особенность эпидемического процесса сглажена.
До введения обязательной вакцинации против коклюша почти 80 % заболеваемости наблюдалось у детей в возрасте до 5 лет. Точных данных о заболеваемости среди взрослых нет, так как у них коклюш распознается редко.
Патогенез и патологоанатомическая картина. Входные ворота инфекции – верхние дыхательные пути. Происходит адгезия микроорганизмов с клетками цилиндрического реснитчатого эпителия гортани, трахеи, бронхов. Поражение эпителия возникает главным образом из‑за воздействия аденилциклазы возбудителя и продуцируемого им лимфоцитозстимулирующего фактора. Микроорганизм внутрь клетки не проникает.
Основные события развиваются в результате воздействия коклюшного токсина, который вызывает длительное раздражение нервных рецепторов блуждающего нерва. Непрерывный поток импульсов, поступающий с рецепторов слизистых оболочек дыхательных путей, приводит к формированию застойного очага возбуждения (доминанты) в области дыхательного центра в продолговатом мозге. В доминантном очаге раздражения суммируются, специфический ответ возможен и на неспецифические раздражители (болевые, тактильные, звуковые и т.д.). Кроме того, возбуждение может иррадиировать на соседние центры, отсюда возможное вовлечение рвотного центра (рвотой заканчиваются некоторые приступы коклюшного кашля), сосудистого центра с ответной реакцией в виде генерализованного сосудистого спазма, повышения АД, острого нарушения мозгового кровообращения, центра скелетной мускулатуры с возникновением клонических и тонических судорог. Иногда реализуется переход доминанты в состояние парабиоза, чем объясняется возникновение задержек и остановок дыхания в судорожный период коклюша, особенно у новорожденных и самых маленьких грудных детей.
В результате токсинемии и приступов судорожного кашля развиваются гемодинамические расстройства, к которым присоединяется повышение проницаемости сосудистой стенки, что в клинической картине проявляется гипоксией, ацидозом, геморрагическими симптомами.
Возбудители и продукты их жизнедеятельности вызывают угнетение факторов неспецифической защиты организма и иммуносупрессию, что приводит к достаточно частому присоединению вторичной бактериальной флоры и вирусных инфекций.
Патологоанатомические изменения при коклюше скудны и неспецифичны: гиперемия, отек, пролиферация эпителиальных клеток дыхательных путей, слущивание отдельных клеток, изменения в легких, головном мозге. В остальном патологоанатомическая картина коклюша определяется его осложнениями, от которых и наступает смерть.
Клиническая картина. Инкубационный период колеблется от 3 до 14 дней, в среднем составляет 5–8 дней. В типичных случаях можно выделить еще 4 периода: катаральный (начальный), спазматический (судорожный), разрешения (обратного развития) и реконвалесценции.
Катаральный период протекает по‑разному и не имеет никаких специфических особенностей. Температура тела может оставаться нормальной, обычно бывает субфебрильной, в очень тяжелых и редких случаях может повышаться до 38–39 °С; от тяжести заболевания зависит и выраженность интоксикации – от легкого недомогания, беспокойства, раздражительности и снижения аппетита до значительной. Одновременно возникают небольшой насморк, кашель, слезотечение. Постепенно развертывается картина фарингита, ларингита, трахеобронхита. Изредка коклюш дебютирует симптоматикой ложного крупа, который, однако, быстро купируется.
Кашель и в этот период является ведущим симптомом коклюша: он сухой, не уменьшается при приеме симптоматических средств, усиливается к вечеру или ночью, у трети больных становится навязчивым, постепенно приобретает характер приступов.
В легких случаях продолжительность катарального периода больше – до 11–14 дней, при более тяжелом течении сокращается до 5–8 дней. В спазматический (судорожный) период кашель становится настолько своеобразным, что диагноз можно поставить на расстоянии; часто коклюш распознают сами матери.
Характерны приступы кашля, после окончания которых больной чувствует себя вполне хорошо, дети спокойно играют, интересуются окружающим или засыпают. Почти все дети так или иначе чувствуют приближение приступа: старшие жалуются на першение в горле, царапанье за грудиной, младшие испытывают страх, беспокоятся, начинают плакать, теряют интерес к игрушкам, часто вскакивают с места, бегут к матери. Вслед за этим один за другим следуют приступы кашля. Во время приступа короткие кашлевые толчки следуют один за другим, не давая возможности вдохнуть. Когда такая возможность появляется (обычно через 10–12 кашлевых толчков), воздух со свистом устремляется через судорожно сжатую голосовую щель, что сопровождается громким свистящим звуком (французские авторы назвали такой судорожный вдох, сопровождаемый свистящим звуком, репризом). Вслед за вдохом следует еще несколько кашлевых «разрядов» с репризами, общим числом 3–6 и продолжительностью 1–4 мин. Ребенок все это время напуган, вены на шее набухают, лицо краснеет, потом становится цианотичным, по щекам катятся слезы, глаза широко раскрыты, язык высовывается изо рта максимально, кончик его поднят кверху. Во время приступа у некоторых детей происходит непроизвольное извержение кала и мочи, могут быть обмороки и судороги. Завершается приступ отделением большого количества вязкой, густой слизи, во многих случаях возникает рвота.
Кашлевой пароксизм можно спровоцировать резким светом, сильным внезапным шумом, суетой вокруг ребенка, его волнением, испугом, взрывом других эмоций (в том числе бурным смехом или плачем) самого больного, а также осмотром зева с использованием шпателя или ложки.
Количество таких пароксизмов различно и зависит от тяжести заболевания. При легкой форме их число не превышает 8–10 в сутки, рвотой не сопровождаются, протекают при общем хорошем самочувствии и состоянии больного. При средней тяжести форме коклюша число приступов достигает 15 в сутки, они завершаются, как правило, рвотой. Вне приступа самочувствие улучшается, однако полностью может не нормализовываться: дети остаются вялыми, отказываются от еды, плохо спят из‑за приступов кашля, не выспавшись, становятся капризными. Вне приступа лицо остается одутловатым, веки отечны, могут появляться кровоизлияния на конъюнктиве. При тяжелой форме заболевания количество приступов превышает 20–25 за сутки, достигает и 30. Особенно впечатлительные, нервные дети даже в «светлые» промежутки проводят в ожидании следующего приступа – становятся мучениками на весь спазматический период. У них развивается кислородная недостаточность, кожные покровы бледны, появляется и удерживается цианоз носогубного треугольника, акроцианоз. У некоторых больных наблюдаются надрыв и язвочка на уздечке языка – следствие напряжения и травмы о нижние резцы.
В особо тяжелых случаях возможно нарушение мозгового кровообращения с потерей сознания, судорогами, нарушениями ритма дыхания, иногда парезами, которые в период разрешения и выздоровления проходят без следа. Описаны случаи кровоизлияния в мозг, клиническая картина которого обусловлена его локализацией и обширностью, тогда последствия могут быть необратимыми.
Температура тела в большинстве случаев остается нормальной в течение всего судорожного периода. При перкуссии грудной клетки в этот период выявляется зона притупления в межлопаточной области, при аускультации – незначительное количество влажных крупно– и среднепузырчатых хрипов, сухие хрипы. В случае длительного судорожного периода при выстукивании возможен тимпанический оттенок перкуторного звука вследствие эмфиземы легких.
В гемограмме очень характерен лейкоцитоз (от 10,0–15,0 * 10^9 /л в легких случаях, до 30,0–40,0 * 10^9 /л при тяжелых формах заболевания), а также относительный и абсолютный лимфоцитоз – 60–85 % и более в лейкоцитарной формуле. Отсутствие лейкоцитоза и лимфоцитоза не свидетельствует, однако, об отсутствии коклюша, особенно у привитых и взрослых больных.
Продолжительность спазматического (судорожного) периода 2–8 нед и более. К концу его приступы протекают мягче, число пароксизмов постепенно уменьшается, заболевание переходит в следующий период.
Период разрешения (обратного развития) продолжается еще 2–4 нед. Приступы становятся редкими, без рвоты, переносятся значительно легче, нормализуются самочувствие и состояние больных.
Период реконвалесценции охватывает 2–6 мес. При наслоении других респираторных инфекций, в первую очередь ОРЗ, возможно возобновление кашля. В этот период сохраняются раздражительность, слабость, повышенная возбудимость больных, их восприимчивость к другим инфекциям.
Таким образом коклюш протекает у большинства заболевших – это типичное течение заболевания. К атипичному течению относят стертые и абортивные формы. При стертых формах заболевания отсутствуют приступы судорожного кашля, но сам кашель может продолжаться несколько недель и месяцев, он не поддается лечению симптоматическими средствами. При абортивной форме после типичного течения катарального периода развиваются пароксизмы судорожного кашля, но через 1–2 дня они совершенно исчезают, кашель довольно быстро проходит.
Бессимптомная (субклиническая) форма выявляется лишь в очагах коклюша при бактериологическом и серологическом обследовании контактных лиц.
Особенности коклюша у детей раннего возраста. Заболевание протекает значительно тяжелее, чем у старших детей, инкубационный период укорачивается. Катаральный период обычно короткий, а судорожный – длиннее. Собственно судорожный кашель обычно отсутствует, но наблюдаются его эквиваленты: приступы беспокойства, чиханья, крика, в этот период ребенок может принимать позу плода. Репризы отсутствуют или выражены нечетко. Нередко развиваются задержки дыхания (от 30 с до 2 мин) и даже его остановка (апноэ более 2 мин). Они могут возникать на высоте приступа и, что особенно опасно, вне приступа и даже во сне. «Заменой» рвоты у самых маленьких детей может быть срыгивание. У детей младшего возраста часты осложнения коклюша, возможны тяжелые последствия (нарушения мозгового кровообращения с параличами, бронхиты с последующей бронхоэктатической болезнью, нарушения психомоторного развития, эпилептиформные припадки и т.д.).
Особенности течения коклюша у привитых. Заболевание протекает в легкой форме, как правило, без осложнений и последствий, а чаще в атипичной (стертой) форме.
Особенности коклюша у взрослых. Коклюш чаще протекает в легкой или атипичной форме и проявляется обычно длительным, упорным, навязчивым кашлем, не поддающимся лечению. Репризы не выражены, рвоты, как правило, не бывает. Осложнения редки.
Правильный диагноз устанавливается редко, обычно в случаях одновременного заболевания ребенка с типичным течением инфекции или при бактериологическом и серологическом обследовании взрослого, работающего в детском коллективе или вступившего в контакт с больным коклюшем ребенком.
Осложнения. Многочисленны, некоторые из них очень серьезны и могут привести к смерти. Возможны пневмонии, эмфизема легких, средостения и подкожной клетчатки, редко развивается ателектаз легких, иногда возникает кровоизлияние в головной мозг и сетчатку глаза с соответствующими последствиями. Описаны разрыв барабанных перепонок, выпадение прямой кишки, образование грыж, особенно у грудных детей. Возможно присоединение вторичной бактериальной флоры с развитием гнойных отита, бронхита, пневмонии, плеврита, эмпиемы, медиастинита и т.д.
Нередко следствием коклюша (особенно у детей первых 3 лет жизни) становится бронхоэктатическая болезнь. Считается также, что некоторые больные, страдающие малыми и большими эпилептическими припадками, приобрели их вследствие перенесенного коклюша.
Прогноз. В большинстве случаев благоприятный, у новорожденных и детей первого года жизни всегда серьезный. Серьезен прогноз при тяжелом течении заболевания и при развитии осложнений. В довакцинальный период в бывшем СССР ежегодно заболевало коклюшем около 600 тыс. человек, из них умирало более 5 тыс. (т.е. более 8 %), летальность от коклюша на первом году жизни достигала 50–60 .%.
Диагностика. Диагностика коклюша в типичных случаях очень проста и основывается на оценке кашлевого приступа с репризами. К сожалению, диагноз, установленный в этот период, надо считать поздним как в терапевтическом, так и в эпиде– миологическом отношении.
Диагноз коклюша в катаральный период, безусловно, возможен при наличии эпидемиологических предпосылок (контакт с коклюшным больным). При неубедительных эпидемиологических данных диагноз в начальный (катаральный) период основывается на том, что при коклюше кашель доминирует над всеми другими проявлениями болезни, нарастает с каждым днем, несмотря на проводимую симптоматическую терапию, протекает в большинстве случаев на фоне нормальной (реже субфебрильной) температуры тела, усиливается в вечерние и ночные часы, после тепловых процедур. Очень помогает диагностике клинический анализ крови: в гемограмме уже в этот период выявляются лимфоцитоз и лейкоцитоз при нормальной СОЭ.
Верификация диагноза коклюша проводится бактериологическим методом. Существует несколько методов забора материала («кашлевые пластинки», «заглоточный тампон»), который помещают в питательную среду. Обследование проводят в первые 2 нед заболевания. Предварительный ответ получают через 3–5 дней, окончательный – через 5–7 сут.
Используется также серологический метод подтверждения диагноза (РА, РСК, РПГА). Диагностический титр в наиболее часто используемой РПА 1:80 (у непривитых). Во всех остальных случаях для подтверждения диагноза необходимо получить нарастание титра антител в 4 раза и более (в парных сыворотках, взятых с интервалом 10–14 дней). Реакцию ставят одновременно с коклюшным и паракоклюшным антигенами.
Дифференциальная диагностика. Коклюш дифференцируют от острых респираторных вирусных заболеваний, кори, бронхитов, пневмонии (в катаральный период), туберкулезного и опухолевого бронхоаденита, бронхиальной астмы, муковисцидоза, попадания инородного тела в бронхи.
Лечение. Дети со средней тяжести и тяжелыми формами коклюша должны лечиться в условиях стационара.
Исключительное значение в лечении больных коклюшем имеет организация режима их содержания и питания. Необходимо устранение внешних раздражителей, обеспечение спокойной обстановки, предоставление ребенку возможности заняться спокойными играми. Комнату, где находится больной, следует хорошо и часто проветривать, при нормальной температуре тела с ребенком надо возможно больше гулять (избегая контактов с другими детьми), летом в любое время, зимой – при температуре окружающего воздуха не ниже ‑10–12 °С и безветрии.
Ранее авторы рекомендовали обеспечивать больного коклюшем не только свежим, прохладным, но и влажным воздухом. В помещении, особенно с центральным отоплением, следует установить увлажнитель воздуха, при его отсутствии поставить сосуды с водой, повесить мокрые полотенца. На улице, если это возможно, надо гулять вблизи воды (по берегу реки, озера, канала, пруда).
Питание должно быть полноценным по составу, щадящим по приготовлению, дробным. Важно сохранить естественное вскармливание грудным детям, увеличив число кормлений на 1–2 в сутки, уменьшив соответственно разовый объем молока. То же надо сделать и при искусственном вскармливании. После рвоты ребенка надо докармливать. Ребенок во время болезни должен получать достаточное количество жидкости (чай, соки, морсы, щелочная минеральная вода, боржом, ессентуки № 20 и др.). Старшим детям исключить еду «всухомятку», при которой раздражается задняя стенка глотки, что провоцирует очередной приступ кашля.
Специфическая терапия коклюша не разработана. Из этиотропных средств используют антибиотики широкого спектра действия – полусинтетический пенициллин ампициллин (сам пенициллин, т.е. калиевая и натриевая соли бензилпенициллина и феноксиметилпенициллин при коклюше неэффективен), левомицетин, аминогликозиды, макролиды в возрастных дозах. Курс антибиотикотерапии составляет 5–7 дней. Антибиотики эффективны в то время, когда возбудитель еще не покинул организм, т.е. в ранние сроки заболевания – в катаральный период и в первые дни спазматического периода. В более поздние сроки антибиотикотерапия эффекта не дает. Ее возобновляют при развитии вторичных осложнений.
С первых дней болезни проводится патогенетическая терапия, направленная на ослабление кашлевого рефлекса, устранение кислородной недостаточности и нормализацию гемодинамики. Показана симптоматическая терапия (например, при возникновении судорог), назначение обычных противокашлевых препаратов неэффективно. Некоторым больным помогает иглорефлексотерапия, иногда приходится прибегать к баротерапии.
Центральное место в патогенетической терапии занимают препараты психотропного ряда. Только в условиях стационара назначают нейролептик аминазин (0,6 % раствор для внутримышечного введения или соответствующая взвесь препарата для перорального приема) в дозе 1–1,5 мг/кг массы тела в сутки, перед дневным и ночным сном, а также нейролептик дроперидол в возрастных дозах.
Не только в стационаре, но и дома можно использовать пипольфен (дипразин) не столько как антигистаминный препарат, сколько в качестве средства с выраженным влиянием на ЦНС, седативной активностью. Препарат вводят внутримышечно или внутрь в возрастных дозировках. Димедрол применять не следует, так как он сушит слизистые оболочки и может спровоцировать кашлевой приступ у больного коклюшем.
В домашних условиях используют обычно транквилизаторы из группы диазепама (седуксен, реланиум, сибазон) внутримышечно 0,5 % раствор из расчета 0,5–1,0 мг/кг в сутки или перорально в возрастной дозе. Курс лечения 7–10 дней, при необходимости – дольше.
Профилактика. Основной и самой надежной мерой профилактики коклюша является создание активного иммунитета путем вакцинации. По календарю обязательных прививок, действующему на территории Российской Федерации и других стран бывшего СССР, вакцинация адсорбированной коклюшно‑дифтерийно‑столбнячной (АКДС) вакциной.
Больного коклюшем изолируют на 25 дней от начала заболевания. Если в детском коллективе выявляется бактериовыделитель коклюшных палочек, он изолируется до получения 2 отрицательных результатов бактериологического обследования (его проводят 2 дня подряд или с интервалом 1–2 дня). Выписка больного в детское учреждение возможна не ранее 25‑го дня от начала заболевания при условии клинического выздоровления без контрольного бактериологического обследования. Раньше 25‑го дня от момента заболевания можно выписать ребенка при значительном клиническом улучшении и двух отрицательных результатах бактериологического обследования.
Детям, вступившим в контакт с коклюшным больным, особенно на 1‑м году жизни и не привитым до 2 лет, вводят донорский нормальный иммуноглобулин (2–4 дозы).
В детском коллективе при регистрации больного коклюшем на детей в возрасте до 7 лет накладывается карантин на 14 дней со дня изоляции больного.
Текущая и заключительная дезинфекция не проводятся из‑за малой устойчивости возбудителя во внешней среде.
Паракоклюш
Паракоклюш (parapertussis) – острая антропонозная бактериальная инфекция, неотличимая по клиническим проявлениям от легких форм коклюша. Самостоятельность паракоклюша подтверждена выделением в 1937 г. Ж.Элдерингом и П.Л.Хендриком возбудителя болезни Bordetella parapertussis, который достаточно легко отличается от Bordetella pertussis по виду колоний и антигенному составу. Паракоклюш встречается в 20–25 раз реже, чем коклюш, лишь во время эпидемий паракоклюша на долю его возбудителя может приходиться 20–30 % культур бордетеля, выделенных от населения. Перекрестного иммунитета коклюш и паракоклюш не дают: переболевший коклюшем может заболеть паракоклюшем и наоборот.
Эпидемиология. Такая же, как при коклюше.
Патогенез. Не отличается от патогенеза коклюша.
Клиническая картина. В основных чертах совпадает с картиной легкой формы коклюша. Инкубационный период колеблется от 7 до 15 дней. Смена периодов заболевания, столь характерная для коклюша, при паракоклюше сглажена, лишь у 15–20 % больных наблюдается типичный приступ коклюшного кашля с репризами и рвотой. У остальных больных кашель как при трахеобронхитах иной этиологии, но упорный, не поддающийся обычной симптоматической терапии. Интоксикации практически не бывает, температура тела остается нормальной.
В гемограмме обнаруживается умеренный лимфоцитоз, но не у всех больных.
Осложнения развиваются редко. Возможны пневмонии у детей с отягощенным анамнезом.
Прогноз благоприятный.
Диагностика. Клиническое распознавание и дифференциальная диагностика по клиническим данным невозможны. Это трудно сделать даже при наличии эпидемиологических данных о контакте с больным коклюшем или о пребывании в очаге коклюша, так как в одном и том же очаге возможна циркуляция обоих возбудителей. Диагноз паракоклюша устанавливают по результатам специфических методов диагностики: бактериологического с выделением возбудителя паракоклюша и серологического (РА, РСК, РПГА). Серологические реакции ставят одновременно с коклюшным и паракоклюшным антигенами.
Лечение. Проводится по тем же правилам, по которым лечат больных коклюшем.
Профилактика. Вакцинация с помощью АКДС для профилактики паракоклюша непригодна. Заболевшего выводят из детского коллектива и изолируют на 2–4 нед, возвращение в коллектив возможно и раньше при условии двух отрицательных результатов бактериологического обследования.
Глава 8
Дата добавления: 2019-02-12; просмотров: 187; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
