Карбоновые кислоты. Сложные эфиры
Базовый уровень сложности
1. Состав предельных одноосновных карбоновых кислот выражается общей формулой
| 1) | СnН2nО | 2) | СnН2n+2О | 3) | СnН2nО2 | 4) | СnН2n-2О2 |
2. Предельные одноосновные карбоновые кислоты изомерны
| 1) | сложным эфирам | 3) | двухатомным спиртам |
| 2) | простым эфирам | 4) | альдегидам |
3. Общей формулой сложных эфиров является
| 1) | R-СОО-R1 | 3) | R-СОH |
| 2) | R-СООH | 4) | R-ОH |
4. Изомером сложного эфира, формула которого
С2Н5-СОО-С3Н7,
является
| 1) | этиловый эфир пропановой кислоты |
| 2) | метиловый эфир этановой кислоты |
| 3) | 2,3-диметилбутановая кислота |
| 4) | 2,2-диметилпропановая кислоты |
5. Функциональной группой карбоновых кислот является
| 1) | алкоксильная | 3) | карбонильная |
| 2) | гидроксильная | 4) | карбоксильная |
6. Двухосновной является карбоновая кислота
| 1) | масляная | 2) | щавелевая | 3) | линолевая | 4) | акриловая |
7. Ароматической одноосновной является карбоновая кислота
| 1) | молочная | 2) | фталевая | 3) | стеариновая | 4) | бензойная |
8. Непредельной является карбоновая кислота, формула которой
| 1) | С17Н35СООН | 2) | С3Н7СООН | 3) | С17Н33СООН | 4) | С2Н5СООН |
9. Гомологом 2-метилбутановой кислоты является вещество, формула которого
|
|
|
| 1) | CH3(CH2)3COOH | 3) | CH3-CH(CH3)-COOH |
| 2) | CH3-CH(CH3)-CH2-COOH | 4) | CH3-CH2-CH2-CH2-COOH |
10. В воде не растворяется карбоновая кислота
| 1) | этановая | 3) | метановая |
| 2) | пропионовая | 4) | стеариновая |
11. Смешивается с водой в любых соотношениях кислота
| 1) | уксусная | 3) | олеиновая |
| 2) | масляная | 4) | пальмитиновая |
12. Наиболее сильной из перечисленных кислот является
| 1) | уксусная | 3) | бромуксусная |
| 2) | хлоруксусная | 4) | фторуксусная |
13. Сила кислот увеличивается в последовательности
| 1) | муравьиная – уксусная – пропионовая |
| 2) | уксусная – хлоруксусная – дихлоруксусная |
| 3) | фторуксусная – хлоруксусная – бромуксусная |
| 4) | пропионовая – масляная – уксусная |
14. При взаимодействии карбоновых кислот со спиртами образуются
| 1) | сложные эфиры | 3) | аминокислоты |
| 2) | простые эфиры | 4) | углеводы |
15. При взаимодействии этановой кислоты с метанолом образуется
| 1) | метилформиат | 3) | этилацетат |
| 2) | метилацетат | 4) | этилформиат |
16. Уксусная кислота взаимодействует с
| 1) | SiO2 | 2) | Cu | 3) | Mg(OH)2 | 4) | C2H6 |
|
|
|
17. Пропионовая кислота образует сложный эфир при взаимодействии с
| 1) | CH3COH | 3) | NaOH |
| 2) | CH2OH-CHOH-CH2OH | 4) | HCOOH |
18. Метановая кислота в отличие от уксусной кислоты взаимодействует с
| 1) | CH3OH | 3) | Ag |
| 2) | КОН | 4) | [Ag(NH3)2]OH |
19. Уксусная кислота не взаимодействует с
| 1) | хлором | 3) | этаном |
| 2) | карбонатом кальция | 4) | пропанолом-1 |
20. Взаимодействие карбоновых кислот с глицерином относится к реакциям
| 1) | изомеризации | 3) | этерификации |
| 2) | декарбоксилирования | 4) | гидратации |
21. Пропионовая кислота взаимодействует с каждым из двух веществ
| 1) | C2Н5ОН и Cu | 2) | NaOH и Mg | 3) | MgO и SiO2 | 4) | CH4 и СН3ОН |
22. Синтетическое волокно лавсан получают при взаимодействии терефталевой кислоты с этиленгликолем по реакции
| 1) | полимеризации | 3) | изомеризации |
| 2) | сополимеризации | 4) | поликонденсации |
23. Полиметилметакрилат (оргстекло) получают из метилового эфира метакриловой кислоты по реакции
| 1) | полимеризации | 3) | дегидратации |
| 2) | сополимеризации | 4) | поликонденсации |
24. С каждым из трех веществ:
|
|
|
K, [Ag(NH3)2]OH, Cu(OH)2 –
может реагировать
| 1) | муравьиная кислота | 3) | пентаналь |
| 2) | уксусная кислота | 4) | пентин-1 |
25. Пропионовая кислота взаимодействует с каждым из двух веществ
| 1) | CН3ОН и CО2 | 2) | Cl2 и NaHCO3 | 3) | CaO и KCl | 4) | C6H6 и Ag |
26. Олеиновая кислота взаимодействует с каждым из двух веществ
| 1) | глицерином и серебром | 3) | метанолом и бромоводородом |
| 2) | пропаном и хлором | 4) | оксидом кремния(IV) и азотом |
27. И уксусная кислота, и этиленгликоль взаимодействуют с
| 1) | гидроксидом натрия | 3) | медью |
| 2) | гидроксидом меди(II) | 4) | бромной водой |
28. И уксусная кислота, и фенол взаимодействуют с
| 1) | гидроксидом натрия | 3) | этаном |
| 2) | оксидом меди(II) | 4) | бензолом |
29. И муравьиная кислота, и формальдегид взаимодействуют с
| 1) | MgO | 3) | [Ag(NH3)2]OH |
| 2) | Na2CO3 | 4) | KOH |
30. Бутановую кислоту можно получить при взаимодействии
| 1) | бутанола-2 с оксидом меди(II) | 3) | бутаналя с водородом |
| 2) | бутанона с оксидом меди(II) | 4) | бутаналя с гидроксидом меди(II) |
31. Муравьиную кислоту можно отличить от пропионовой с помощью
|
|
|
| 1) | гидроксида натрия |
| 2) | cульфата меди(II) |
| 3) | аммиачного раствора оксида серебра |
| 4) | этанола |
32. Взаимодействие уксусной кислоты с этанолом относится к реакциям
| 1) | гидролиза | 3) | изомеризации |
| 2) | гидратации | 4) | этерификации |
33. Щелочному гидролизу (омылению) сложных эфиров соответствует схема реакции
| 1) | R1-СОО-R2 + NaOH → |
| 2) | R-СООH + NaOH → |
| 3) | R1-О-R2 + Na → |
| 4) | R-ОH + K → |
34. Метилформиат можно получить при взаимодействии
| 1) | уксусной кислоты и метанола | 3) | уксусной кислоты и метаналя |
| 2) | муравьиной кислоты и метанола | 4) | метановой кислоты и этанола |
35. Этилформиат образуется в результате реакции между
| 1) | С2Н5ОН + СН3СООН→ | 3) | С2Н5ОН + НСООН→ |
| 2) | СН3ОН + СН3СООН→ | 4) | СН3ОН + НСООН→ |
36. На смещение химического равновесия в системе
С2Н5ОН(ж) + СН3СООН(ж)  СН3СООС2Н5(ж) + Н2О(ж) + Q
СН3СООС2Н5(ж) + Н2О(ж) + Q
не оказывает влияния
| 1) | увеличение концентрации этилацетата |
| 2) | уменьшение давления |
| 3) | уменьшение концентрации этанола |
| 4) | повышение температуры |
37. В состав жиров может входить кислота
| 1) | уксусная | 2) | линолевая | 3) | муравьиная | 4) | акриловая |
38. В состав жиров не входит кислота
| 1) | бутановая | 2) | олеиновая | 3) | пропионовая | 4) | стеариновая |
39. Среда водного раствора ацетата калия
| 1) | щелочная | 2) | нейтральная | 3) | кислая | 4) | слабокислая |
40. В водном растворе формиата натрия лакмус приобретает окраску
| 1) | малиновую | 2) | красную | 3) | синюю | 4) | фиолетовую |
41. Лакмус приобретает синюю окраску в водном растворе
| 1) | фенола | 3) | уксусной кислоты |
| 2) | стеарата калия | 4) | этиленгиколя |
42. Лакмус имеет фиолетовую окраску в водном каждого из двух веществ
| 1) | ацетата калия и глицерина | 3) | муравьиной кислоты и фенола |
| 2) | этиленгликоля и этанола | 4) | метаналя и формиата натрия |
43. Взаимодействие сложного эфира с водой относится к реакциям
| 1) | этерификации | 3) | гидрирования |
| 2) | гидратации | 4) | гидролиза |
44. Продуктами гидролиза метилацетата являются
| 1) | метанол и муравьиная кислота | 3) | этанол и муравьиная кислота |
| 2) | этанол и уксусная кислота | 4) | метанол и уксусная кислота |
45. Продуктами гидролиза жиров могут быть
| 1) | глицерин и пропионовая кислота |
| 2) | этиленгликоль и олеиновая кислота |
| 3) | глицерин и линоленовая кислота |
| 4) | этиленгликоль и пальмитиновая кислота |
46. Продуктами щелочного гидролиза жиров могут быть
| 1) | глицерин и высшие карбоновые кислоты |
| 2) | глицерин и мыла |
| 3) | этиленгликоль и высшие карбоновые кислоты |
| 4) | этиленгликоль и мыла |
47. Процесс превращения жидкого жира в твердый отражает схема реакции
| 1) | СН2-О-СО-С17Н35 │ СН-О-СО-С17Н35 + КОН → │ СН2-О-СО-С17Н35 | 3) | СН2-О-СО-С17Н33 │ СН-О-СО-С17Н33 + Н2 → │ СН2-О-СО-С17Н33 |
| 2) | СН2-О-СО-С17Н33 │ СН-О-СО-С17Н33 + Br2 → │ СН2-О-СО-С17Н33 | 4) | СН2-О-СО-С15Н31 │ СН-О-СО-С15Н31 + Н2O → │ СН2-О-СО-С15Н31 |
48. Мыла относятся к классу веществ
| 1) | карбоновые кислоты | 3) | соли |
| 2) | жиры | 4) | спирты |
49. Верны ли следующие суждения о карбоновых кислотах?
А. Жидкие карбоновые кислоты состоят из димеров, образованных за счет водородных связей.
Б. Натриевые и калиевые соли высших карбоновых кислот - мыла .
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
50. Верны ли следующие суждения о карбоновых кислотах?
А. Карбоновые кислоты – сильные электролиты.
Б. В карбоновых кислотах связь О – Н более полярна, чем в спиртах.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
51. Верны ли следующие суждения о карбоновых кислотах?
А. Высшие карбоновые кислоты не растворяются в воде.
Б. Реакция взаимодействия карбоновых кислот со спиртами называется реакцией этерификации.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
52. Верны ли следующие суждения о карбоновых кислотах?
А. Муравьиная кислота в отличие от остальных карбоновых кислот вступает в реакцию «серебряного зеркала».
Б. Пропионовую кислоту можно получить окислением пропанола-2.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
53. Какие из приведенных утверждений о карбоновых кислотах верны?
А. Бутановая кислота и этилацетат – изомеры.
Б. Стеариновую кислоту получают при гидролизе жиров.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
54. Какие из приведенных утверждений о муравьиной кислоте верны?
А. Сложные эфиры муравьиной кислоты называются ацетатами.
Б. Муравьиная кислота содержится в листьях крапивы.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
55. Какие из приведенных утверждений об уксусной кислоте верны?
А. Водный раствор уксусной кислоты проводит электрический ток.
Б. Уксусная кислота может быть получена восстановлением ацетальдегида.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
56. Верны ли следующие суждения об олеиновой кислоте?
А. Олеиновая кислота входит состав растительных масел.
Б. Олеиновая кислота обесцвечивает бромную воду.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
57. Верны ли следующие суждения о сложных эфирах?
А. Сложные эфиры образуются в результате реакции этерификации.
Б. Метилформиат изомерен уксусной кислоте.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
58. Какие из приведенных утверждений о сложных эфирах верны?
А. Сложные эфиры с небольшой молекулярной массой – легковоспламеняющиеся жидкости.
Б. Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов входят в состав природных восков.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
59. Какие из приведенных утверждений о жирах верны?
А. Продуктами щелочного гидролиза жиров являются глицерин и карбоновые кислоты.
Б. Жидкие жиры способны вступать в реакцию полимеризации.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
60. Какие из приведенных утверждений о мыле и синтетических моющих средствах верны?
А. Моющая способность мыла снижается в жесткой воде вследствие образования нерастворимых солей.
Б. И мыло, и синтетические моющие средства быстро разлагаются в окружающей среде и не представляют экологической опасности.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
61. В схеме превращений
CH3ОН → X → HCOOH
веществом Х может быть
| 1) | метан | 3) | метаналь |
| 2) | хлорметан | 4) | метиловый эфир уксусной кислоты |
62. В схеме превращений
CH3CH2CH2ОН  X → CH3CН2COОН
X → CH3CН2COОН
веществом Х может быть
| 1) | пропаналь | 2) | пропанол-2 | 3) | пропилацетат | 4) | пропанон |
63. В схеме превращений
CH3CН2COОН → X → C2H6
веществом Х является
| 1) | этилпропионат | 3) | пропионат калия |
| 2) | пропанон | 4) | пропанон |
64. В схеме превращений
C6H5CОOH → X → C6H6
веществом Х является
| 1) | C6H5CОOК | 2) | C6H5CОH | 3) | C6H5CН2OH | 4) | C6H5CН2OК |
65. В схеме превращений
C4H9COONa  X1
X1  Х2
Х2
веществами Х1 и Х2 соответственно являются
| 1) | C4H8 и С3Н7СОН | 3) | C4H6 и С3Н7СН2ОН |
| 2) | C4H8 и С3Н7СООН | 4) | C4H10 и СН3СООН |
66. В схеме превращений
C2H2  X1
X1  Х2
Х2
веществами Х1 и Х2 соответственно являются
| 1) | C2H5OH и СН3СОН | 3) | СН3СОН и СН3СООН |
| 2) | СН2OH-CH2OH и СН3СОН | 4) | СН3СОН и C2H5OH |
67. В схеме превращений
CH3COONa  X1
X1  Х2
Х2
веществами Х1 и Х2 соответственно являются
| 1) | C2H6 и С3Н7СH2ОН | 3) | CH3Cl и СН3-O-CH3 |
| 2) | СН3СОOH и СН3СОOCH3 | 4) | CH3COH и СН3СОCl |
68. В схеме превращений
СН3СООН  CH3COOCH3
CH3COOCH3 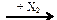 СН3СООNa
СН3СООNa
веществами Х1 и Х2 могут быть
| 1) | CH4 и Na2CO3 | 3) | CH3OH и NaOH |
| 2) | CH3OH и NaCl | 4) | CH4 и NaOH |
Повышенный уровень сложности
69. Установите соответствие между тривиальным названием карбоновой кислоты и ее формулой
| ТРИВИАЛЬНОЕ НАЗВАНИЕ КИСЛОТЫ | ФОРМУЛА КИСЛОТЫ | ||||
| А) | масляная | 1) | C17H33CООН | ||
| Б) | уксусная | 2) | HCООН | ||
| В) | бензойная | 3) | CH3CООН | ||
| Г) | олеиновая | 4) | C6H5CООН | ||
|
| 5) | CH3(CН2)2CООН | |||
| А | Б | В | Г | ||
|
|
| ||||
70. Установите соответствие между систематическим и тривиальным названием органических кислот
| СИСТЕМАТИЧЕСКОЕ НАЗВАНИЕ | ТРИВИАЛЬНОЕ НАЗВАНИЕ | ||||
| А) | этановая | 1) | терефталевая кислота | ||
| Б) | этандиовая | 2) | щавелевая кислота | ||
| В) | 2-гидроксипропановая | 3) | уксусная кислота | ||
| Г) | пентановая | 4) | молочная кислота | ||
|
| 5) | валериановая кислота | |||
| А | Б | В | Г | ||
|
|
| ||||
71. В состоянии sp3- и sp2-гибридизации атомы углерода находятся в молекулах
| 1) | бутанола-2 | 4) | муравьиной кислоты |
| 2) | толуола | 5) | пропионовой кислоты |
| 3) | бензойной кислоты | 6) | ацетона |
72. Установите соответствие между формулой органического вещества и средой его водного раствора.
| ФОРМУЛА ВЕЩЕСТВА | СРЕДА РАСТВОРА | ||||
| А) | С6Н5ОNa | 1) | кислая | ||
| Б) | СН3ОН | 2) | нейтральная | ||
| В) | CH3COONa | 3) | щелочная | ||
| Г) | CH3COOН |
| |||
| А | Б | В | Г | ||
|
|
| ||||
73. Установите соответствие между названием органического вещества и средой его водного раствора
| НАЗВАНИЕ ВЕЩЕСТВА | CРЕДА ВОДНОГО РАСТВОРА | ||||
| А) | пропионат калия | 1) | нейтральная | ||
| Б) | глицерин | 2) | кислая | ||
| В) | формальдегид | 3) | щелочная | ||
| Г) | этилат натрия |
| |||
| А | Б | В | Г | ||
|
|
| ||||
74. Установите соответствие между названием органического вещества и цветом лакмуса в его водном растворе.
| НАЗВАНИЕ ВЕЩЕСТВА | ЦВЕТ ЛАКМУСА | ||||
| А) | хлоруксусная кислота | 1) | красный | ||
| Б) | ацетальдегид | 2) | фиолетовый | ||
| В) | этиленгликоль | 3) | синий | ||
| Г) | бензоат натрия |
| |||
| А | Б | В | Г | ||
|
|
| ||||
75. И муравьиная, и уксусная кислота взаимодействуют с
| 1) | CO2 | 4) | N2 |
| 2) | [Ag(NH3)2]OH | 5) | CH3OH |
| 3) | Mg | 6) | Са(OH)2 |
76. И муравьиная, и уксусная кислота взаимодействуют с
| 1) | КOH | 4) | Cu |
| 2) | [Ag(NH3)2]OH | 5) | BaO |
| 3) | С6Н5CH3 | 6) | С2Н5ОН |
77. И пропановая, и акриловая кислота могут взаимодействовать с
| 1) | СО2 | 4) | NaHCO3 |
| 2) | О2 | 5) | С3Н7ОН |
| 3) | С2Н5ОС2Н5 | 6) | НBr |
78. И уксусная, и олеиновая кислота взаимодействуют с
| 1) | серебром | 4) | пропанолом |
| 2) | азотом | 5) | бромной водой |
| 3) | гидроксидом натрия | 6) | оксидом кальция |
79. Уксусную кислоту можно получить, используя
| 1) | каталитическое гидрирование растительных жиров |
| 2) | восстановление этаналя |
| 3) | окисление этаналя |
| 4) | каталитическое окисление бутана |
| 5) | гидролиз жиров |
| 6) | ферментативное брожение спиртосодержащих жидкостей |
80. Гидролиз жиров в промышленности используют для получения
| 1) | маргарина | 4) | мыла |
| 2) | этанола | 5) | глицерина |
| 3) | этиленгликоля | 6) | высших карбоновых кислот |
81. С раствором гидроксида калия способны взаимодействовать
| 1) | глицерин | 4) | метилацетат |
| 2) | формальдегид | 5) | муравьиная кислота |
| 3) | фенол | 6) | метанол |
82. Для метановой кислоты справедливы утверждения
| 1) | ограниченно растворяется в воде |
| 2) | при взаимодействии со спиртами образует простые эфиры |
| 3) | проявляет сильные восстановительные свойства |
| 4) | вступает в реакцию «серебряного зеркала» |
| 5) | обесцвечивает бромную воду |
| 6) | при попадании на кожу вызывает ожоги |
83. Для уксусной кислоты справедливы утверждения
| 1) | смешивается с водой в любых соотношениях |
| 2) | в газообразном состоянии сохраняет димерную структуру |
| 3) | взаимодействует с хлором |
| 4) | вступает в реакцию «серебряного зеркала» |
| 5) | легко полимеризуется |
| 6) | 80%-ный водный раствор называется столовым уксусом |
84. В результате каталитического окисления бутана объемом 33,6 л (н.у.) с выходом 80% получили уксусную кислоту, масса которой составила _________ г. (Запишите число с точностью до целых.)
85. При взаимодействии уксусной кислоты массой 30 г с магнием массой 4,8 г выделился водород, объем которого равен _________ л. (Запишите число с точностью до сотых.)
86. Муравьиную кислоту массой 46 г нагрели с метанолом массой 45 г в присутствии концентрированной кислоты. Масса сложного эфира, полученного в результате реакции этерификации, равна _________ г. (Запишите число с точностью до целых.)
87. В результате гидролиза 14,8 г этилформиата с выходом 90% получили муравьиную кислоту, масса которой составила _________ г. (Запишите число с точностью до сотых.)
88. В результате щелочного гидролиза 29,6 г метилацетата получили ацетат натрия, масса которого равна _________ г. (Запишите число с точностью до десятых.)
89. В результате гидролиза этилацетата с выходом 90% получили 3,24 г уксусной кислоты. Масса этилацетата, подвергшегося гидролизу, равна _________ г. (Запишите число с точностью до сотых.)
90. В 150 г воды растворили 50 г 70%-ной уксусной эссенции. Массовая доля уксусной кислоты в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
91. Какую массу воды надо добавить к 10 г 80%-ной уксусной эссенции для получения 3%-ного раствора? Ответ: _________ г. (Запишите число с точностью до целых.)
92. К 200 г 5%-ного раствора уксусной кислоты добавили 20 г 60%-ного раствора той же кислоты. Массовая доля уксусной кислоты в полученном растворе равна _________ %. (Запишите число с точностью до целых.)
Высокий уровень сложности
93. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СаС2 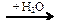 Х1 → CH3COH → CH3COOH
Х1 → CH3COH → CH3COOH  X2 → CH4
X2 → CH4
Укажите условия протекания реакций.
94. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО  Х1
Х1  X2 → HCOOCH3 → X2
X2 → HCOOCH3 → X2  X3
X3
Укажите условия протекания реакций.
95. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С2Н5СООН 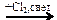 Х1
Х1  X2
X2  Х3
Х3  X4
X4 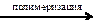 Х5
Х5
Укажите условия протекания реакций.
96. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C6H12О6 → С2Н5ОН 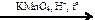 X1
X1  X2 → СН3СООК → С2Н6
X2 → СН3СООК → С2Н6
Укажите условия протекания реакций.
97. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С6H6 → C6H5CH3 → C6H5COOH  X1
X1  X2 → C6H6
X2 → C6H6
Укажите условия протекания реакций.
98. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
метилциклогексан → толуол  X1 → С6Н5СОН
X1 → С6Н5СОН 
 X2
X2  X3
X3
Укажите условия протекания реакций.
99. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3COOК  Х1 → C2H2 → К2C2O4 → Н2C2O4
Х1 → C2H2 → К2C2O4 → Н2C2O4  X2
X2
Укажите условия протекания реакций.
100. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H5Cl → C4H10 → CH3COOH  X1
X1 
 CH3-C(O)-CH3
CH3-C(O)-CH3 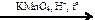 X2
X2
Укажите условия протекания реакций.
101. (С4) К 22,2 г пропионовой кислоты добавили 168 г 5%-ного раствора гидрокарбоната натрия. Определите массовые доли веществ в растворе после окончания реакции.
102. (С4) К 23 г 20%-ного раствора муравьиной кислоты добавили 262,5 г 8%-ного раствора гидрокарбоната натрия. Определите массовые доли веществ в растворе после окончания реакции.
103. (С4) К 12 г уксусной кислоты добавили 180,2 мл 10%-ного раствора гидроксида натрия (плотность 1,11 г/мл). После выпаривания воды сухой остаток прокалили, а затем полученную твердую смесь растворили в 300 мл воды. Определите массовые доли веществ в полученном растворе.
104. (С4) Определите массу муравьиной кислоты, которую следует добавить к 34,97 мл 40%-ного раствора гидроксида натрия (плотность 1,43 г/мл), чтобы массовая доля соли в полученном растворе стала равна 20%. Вычислите массовую долю гидроксида натрия в образовавшемся растворе.
105. (С4) Для полного гидролиза 10,4 г смеси сложных эфиров, состоящей из этилацетата и метилформиата, необходимо затратить 35,6 мл 20%-ного раствора гидроксида калия (плотность 1,18 г/мл). Определите массовые доли сложных эфиров в смеси.
106. (С5) Установите формулу предельной одноосновной карбоновой кислоты, плотность паров по аргону которой равна 1,85.
107. (С5) Установите формулу предельной одноосновной карбоновой кислоты, массовая доля углерода в которой равна 54,55%.
108. (С5) Установите молекулярную формулу предельной одноосновной карбоновой кислоты, массовая доля кислорода в которой в 1,333 раза больше массовой доли углерода.
109.(С5) Для нейтрализации предельной одноосновной карбоновой кислоты массой 13,8 г потребовалось 120 г 10%-ного раствора гидроксида натрия. Определите молекулярную формулу кислоты.
110.(С5) При взаимодействии предельной одноосновной карбоновой кислоты массой 24 г с избытком магния выделилось 4,48 л (н.у.) водорода. Определите молекулярную формулу кислоты.
111. (С5) При полном гидролизе 2,64 г сложного эфира образовалось 1,8 г предельной одноосновной карбоновой кислоты и 1,38 г предельного одноатомного спирта. Установите молекулярную формулу сложного эфира.
112. (С5) Для полного сгорания 3,7 г сложного эфира, образованного предельной одноосновной карбоновой кислотой и предельным одноатомным спиртом, потребовалось 3,92 л (н.у.) кислорода. Установите молекулярную формулу сложного эфира.
113. (С5) При сгорании органического вещества массой 2,16 г получили 3,96 г углекислого газа (н.у.) и 1,08 г воды. Плотность паров вещества по кислороду равна 2,25. Установите молекулярную формулу вещества. С3Н4О2
Углеводы
Базовый уровень сложности
1. Состав большинства углеводов может быть выражен формулой
| 1) | Сn(H2O)m | 2) | Cn(OH)m | 3) | CnH2nO2 | 4) | CnH2n+2Om |
2. Число гидроксильных групп в молекуле фруктозы равно
| 1) | 3 | 2) | 4 | 3) | 5 | 4) | 6 |
3. Глюкоза взаимодействует с каждым из двух веществ
| 1) | Н2 и Сu(ОН)2 | 3) | СuO и СН4 |
| 2) | NaОН и СН3СОН | 4) | SiO2 и C2H5OH |
4. И глюкоза, и фруктоза взаимодействуют с
| 1) | Са(ОН)2 | 2) | Сu(ОН)2 | 3) | [Ag(NH3)2]OH | 4) | I2 |
5. В результате гидролиза сахарозы образуется (образуются)
| 1) | только глюкоза | 3) | глюкоза и фруктоза |
| 2) | только фруктоза | 4) | глюкоза и рибоза |
6. Крахмал взаимодействует с
| 1) | [Ag(NH3)2]OH | 2) | СаО | 3) | Сu(ОН)2 | 4) | Н2О (Н+) |
7. Конечным продуктом гидролиза целлюлозы является
| 1) | сахароза | 2) | фруктоза | 3) | рибоза | 4) | глюкоза |
8. Целлюлоза взаимодействует с каждым из двух веществ
| 1) | уксусной кислотой и кислородом |
| 2) | азотной кислотой и раствором йода |
| 3) | гидроксидом меди(II) и серной кислотой |
| 4) | гидроксидом натрия и аммиачным раствором оксида серебра |
9. И крахмал, и целлюлоза взаимодействуют с
| 1) | гидроксидом меди(II) | 3) | оксидом магния |
| 2) | кислородом | 4) | раствором йода |
10. И для крахмала, и для целлюлозы справедливо утверждение
| 1) | состоят из остатков фруктозы |
| 2) | взаимодействуют с гидроксидом меди(II) |
| 3) | окисляются под действием аммиачного раствора оксида серебра |
| 4) | подвергаются гидролизу |
11. Аммиачный раствор оксида серебра является реактивом на
| 1) | сахарозу | 2) | фруктозу | 3) | крахмал | 4) | глюкозу |
12. Раствор глюкозы можно отличить от раствора фруктозы с помощью
| 1) | NaOH | 2) | H2SO4 | 3) | [Ag(NH3)2]OH | 4) | FeCl3 |
13. Какие из приведенных утверждений об углеводах верны?
А. Углеводы являются компонентами клеток всех растительных и животных организмов.
Б. И крахмал, и целлюлоза обладают высокой питательной ценностью для организма человека.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
14. Верны ли следующие суждения о глюкозе?
А. Изомером глюкозы является рибоза.
Б. Глюкоза подвергается гидролизу.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
15. Верны ли следующие суждения о глюкозе?
А. Глюкоза является альдегидоспиртом.
Б. Продуктом спиртового брожения глюкозы является этанол.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
16. Верны ли следующие суждения о глюкозе?
А. Глюкоза образуется в процессе фотосинтеза.
Б. Продуктом восстановления глюкозы является шестиатомный спирт сорбит.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
17. Верны ли следующие суждения о сахарозе?
А. Сахароза взаимодействует с гидроксидом меди(II) с образованием раствора ярко-синего цвета.
Б. Единственным продуктом гидролиза сахарозы является глюкоза.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
18. Верны ли следующие суждения о крахмале?
А. Крахмал хорошо растворяется в холодной воде.
Б. Конечным продуктом гидролиза крахмала является фруктоза.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
19. Верны ли следующие суждения о крахмале?
А. Крахмал - дисахарид.
Б. Реактивом на крахмал является раствор йода.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
20. Верны ли следующие суждения о целлюлозе?
А. Макромолекулы целлюлозы имеют разветвленное строение.
Б. Целлюлоза вступает в реакцию «серебряного зеркала».
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
21. Верны ли следующие суждения о целлюлозе?
А. Является сырьем для получения искусственных волокон.
Б. При взаимодействии с азотной кислотой образует простые эфиры.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
22. В схеме превращений
C6H12О6  X → C2H4
X → C2H4
веществом Х является
| 1) | СН3СОН | 3) | СН3СН(ОН)СООН |
| 2) | С3Н7СООН | 4) | C2H5OH |
23. В схеме превращений
CО2  X1
X1  X2
X2
веществами Х1 и Х2 соответственно могут быть
| 1) | фруктоза и сорбит | 3) | сахароза и фруктоза |
| 2) | глюкоза и глюконовая кислота | 4) | крахмал и молочная кислота |
24. В соответствии с термохимическим уравнением реакции
С6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж) + 2800 кДж
количество теплоты, выделяющееся при окислении 36 г глюкозы, равно
| 1) | 560 кДж | 2) | 280 кДж | 3) | 140 кДж | 4) | 420 кДж |
Повышенный уровень сложности
25. Глюкоза взаимодействует с
| 1) | гидроксидом меди(II) |
| 2) | аммиачным раствором оксида серебра |
| 3) | карбонатом магния |
| 4) | водородом |
| 5) | бромидом калия |
| 6) | азотом |
26. Фруктоза взаимодействует с
| 1) | гидроксидом меди(II) |
| 2) | хлоридом магния |
| 3) | аммиачным раствором оксида серебра |
| 4) | водородом |
| 5) | кислородом |
| 6) | водой |
27. И для глюкозы, и для фруктозы справедливы утверждения
| 1) | хорошо растворяются в воде |
| 2) | образуются в зеленых растениях в процессе фотосинтеза |
| 3) | окисляются под действием гидроксида меди(II) |
| 4) | при восстановлении водородом образуют сорбит |
| 5) | вступают в реакцию «серебряного зеркала» |
| 6) | легко подвергаются гидролизу |
28. Для крахмала справедливы утверждения
| 1) | cостав выражается формулой (С6Н10О5)n |
| 2) | макромолекулы содержат альдегидные группы |
| 3) | набухает в горячей воде, образуя коллоидный раствор |
| 4) | промежуточным продуктом гидролиза является сахароза |
| 5) | дает синее окрашивание при взаимодействии с йодом |
| 6) | плохо усваивается организмом человека |
29. Крахмал взаимодействует с
| 1) | C6H5СН3 | 4) | I2 |
| 2) | Н2О (Н+) | 5) | NaCl |
| 3) | НNO3 | 6) | Mg(OH)2 |
30. Целлюлоза взаимодействует с
| 1) | азотной кислотой |
| 2) | аммиачным раствором оксида серебра |
| 3) | уксусной кислотой |
| 4) | кислородом |
| 5) | карбонатом натрия |
| 6) | углекислым газом |
31. И для крахмала, и для целлюлозы справедливы утверждения:
| 1) | cостав выражается формулой (С6Н10О5)n |
| 2) | макромолекулы содержат гидроксо-группы |
| 3) | способны к образованию сложных эфиров |
| 4) | продуктом гидролиза является фруктоза |
| 5) | образуют растворы ярко-синего цвета под действием гидроксида меди(II) |
| 6) | вступают в реакцию «серебряного зеркала» |
32. И для крахмала, и для целлюлозы справедливы утверждения:
| 1) | являются полимерами растительного происхождения |
| 2) | макромолекулы имеют линейное строение |
| 3) | образуются в процессе фотосинтеза |
| 4) | конечным продуктом гидролиза является глюкоза |
| 5) | являются ценными питательными продуктами |
| 6) | используются для получения искусственного волокна |
33. С аммиачным раствором оксида серебра способны взаимодействовать
| 1) | сахароза | 4) | муравьиная кислота |
| 2) | пропин | 5) | крахмал |
| 3) | глюкоза | 6) | целлюлоза |
34. В процессе образования 360 г глюкозы выделяется кислород, объем (н.у.) которого равен _________ л. (Запишите число с точностью до десятых.)
35. В процессе образования 72 г глюкозы поглощается углекислый газ, объем (н.у.) которого равен _________ л. (Запишите число с точностью до сотых.)
36. При поглощении 268,8 л (н.у.) углекислого газа в процессе фотосинтеза образуется фруктоза, масса которой равна _________ г. (Запишите число с точностью до целых.)
37. В результате спиртового брожения глюкозы с выходом с выходом 70% получили 257,6 г этанола. Масса глюкозы, подвергшейся брожению, равна _________ г. (Запишите число с точностью до целых.)
38. В результате молочнокислого брожения 75 г глюкозы с выходом 60% получили молочную кислоту, масса которой равна _________ г. (Запишите число с точностью до целых.)
39. К 180 г 40%-ного раствора глюкозы добавили 20 г глюкозы. Массовая доля глюкозы в полученном растворе равна _________ %. (Запишите число с точностью до целых.)
40. Масса сахара, которую следует растворить в 300 мл воды для получения 25%-ного раствора, равна _________ г. (Запишите число с точностью до целых.)
Высокий уровень сложности
41. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО2 → C6H12О6  Х1
Х1  X2 → CO2 → (C6H10O5)n
X2 → CO2 → (C6H10O5)n
Укажите условия протекания реакций.
42. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
(C6H10O5)n → C6H12О6 → СН3СН(ОН)СООН  Х1
Х1 
 Х2 → СО2
Х2 → СО2
Укажите условия протекания реакций.
43. (С4) Определите массу глюкозы, которая необходима для получения 400 мл 70%-ного раствора этанола (плотность 0,868 г/мл), если массовая доля выхода этанола в процессе брожения составляет 60%.
44. (С4) В результате молочнокислого брожения 360 г глюкозы с выходом 70% получили молочную кислоту, которую растворили в 489 мл воды. Какой объем 20%-ного раствора гидроксида натрия (плотность 1,22 г/мл) следует добавить к полученному раствору, чтобы массовая доля кислоты в нем снизилась в 2 раза?
Амины
Базовый уровень сложности
1. Состав предельных аминов выражается формулой
| 1) | СnН2n+1N | 2) | СnН2n+3N | 3) | СnН2n-1N2 | 4) | СnН2n-3N2 |
2. Наиболее сильными основными свойствами обладает
| 1) | анилин | 2) | аммиак | 3) | метиламин | 4) | диметиламин |
3. Наиболее слабыми основными свойствами обладает
| 1) | аммиак | 2) | анилин | 3) | дифениламин | 4) | диметиламин |
4. Основные свойства аминов увеличиваются в последовательности
| 1) | анилин – диметиламин – метиламин |
| 2) | анилин – дифениламин – трифениламин |
| 3) | фениламин – метиламин – диметиламин |
| 4) | трифениламин – триметиламин – метиламин |
5. Среда водного раствора метиламина
| 1) | щелочная | 2) | нейтральная | 3) | кислая | 4) | слабокислая |
6. В водном растворе диметиламина лакмус приобретает окраску
| 1) | малиновую | 2) | красную | 3) | синюю | 4) | фиолетовую |
7. В водном растворе анилина лакмус имеет окраску
| 1) | малиновую | 2) | красную | 3) | синюю | 4) | фиолетовую |
8. В водном растворе сульфата метиламмония лакмус приобретает окраску
| 1) | оранжевую | 2) | красную | 3) | синюю | 4) | фиолетовую |
9. Метиламин взаимодействует с
| 1) | NaOH | 2) | H2SO4 | 3) | KCl | 4) | H2 |
10. Этиламин взаимодействует с каждым из трех веществ
| 1) | KOH, ZnO, HNO2 | 3) | Cu(OH)2, H2SO4, CO2 |
| 2) | HI, H2, C6H5CH3 | 4) | H2O, HBr, O2 |
11. Триметиламин не взаимодействует с
| 1) | O2 | 2) | H2 | 3) | HNO3 | 4) | HCl |
12. Метиламин взаимодействует с каждым из двух веществ
| 1) | Cu и H2O | 2) | HNO3 и C2H6 | 3) | HCl и O2 | 4) | Mg(OH)2 и N2 |
13. Анилин взаимодействует с
| 1) | Сu(OH)2 | 2) | C3H8 | 3) | BaO | 4) | HBr |
14. Анилин взаимодействует с каждым из двух веществ
| 1) | КОН и H2SO4 | 2) | HCl и C6H6 | 3) | CaO и H2 | 4) | HNO3и O2 |
15. Анилин не взаимодействует с
| 1) | гидроксидом бария | 3) | бромной водой |
| 2) | бромоводородом | 4) | серной кислотой |
16. Продуктами полного сгорания аминов являются
| 1) | углекислый газ, вода и оксид азота(II) |
| 2) | oксид углерода(II), вода и аммиак |
| 3) | углекислый газ, вода и азот |
| 4) | углекислый газ, водород и азот |
17. И метиламин, и анилин взаимодействуют с каждым из двух веществ
| 1) | бромной водой и бромоводородом |
| 2) | водородом и серной кислотой |
| 3) | водой и гидроксидом натрия |
| 4) | соляной кислотой и кислородом |
18. Анилин в отличие от фенола взаимодействует с
| 1) | Сa(OH)2 | 2) | HCl | 3) | Br2 | 4) | O2 |
19. И анилин, и фенол взаимодействуют с каждым из двух веществ
| 1) | хлороводородом и водородом |
| 2) | кислородом и метаном |
| 3) | гидроксидом натрия и серной кислотой |
| 4) | бромной водой и азотной кислотой |
20. И анилин, и бензол взаимодействуют с каждым из двух веществ
| 1) | бромом и разбавленной серной кислотой |
| 2) | кислородом и азотной кислотой |
| 3) | гидроксидом меди(II) и водой |
| 4) | натрием и кислородом |
21. Среда водного раствора хлорида этиламмония
| 1) | щелочная | 2) | нейтральная | 3) | кислотная | 4) | слабокислая |
22. В водном растворе сульфата фениламмония лакмус приобретает окраску
| 1) | оранжевую | 2) | красную | 3) | синюю | 4) | фиолетовую |
23. С гидроксидом натрия реагирует
| 1) | хлорид фениламммония | 3) | метиламин |
| 2) | метилбензол | 4) | дифениламин |
24. Анилин можно отличить от бензола с помощью
| 1) | лакмуса | 3) | гидроксида калия |
| 2) | бромной воды | 4) | cульфата меди(II) |
25. Верны ли следующие суждения о метиламине?
А. Метиламин - газ, хорошо растворимый в воде.
Б. В отличие от аммиака метиламин обладает более сильными основными свойствами.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
26. Верны ли следующие суждения об анилине?
А. В отличие от бензола анилин взаимодействует с бромной водой.
Б. Анилин – сильный яд.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
27. Верны ли следующие суждения об анилине?
А. Анилин получают восстановлением нитробензола.
Б. Основные свойства анилина выражены сильнее, чем у метиламина.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
28. Верны ли следующие суждения о фениламине?
А. Водный раствор фениламина окрашивает лакмус в синий цвет.
Б. Фениламин легко окисляется.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
29. В схеме превращений
C6H6  C6H6NO2
C6H6NO2  C6H5NH2
C6H5NH2
веществами Х1 и Х2 соответственно могут быть
| 1) | HNO3 и H2O | 2) | HNO2 и Н2 | 3) | NO и NН3 | 4) | HNO3 и H2 |
30. В схеме превращений
C2H5NH2  X1
X1  X2
X2
веществами Х1 и Х2 соответственно могут быть
| 1) | C2H5Br и C2H5OH | 3) | C2H5Br и C2H4 |
| 2) | C2H5NH3Br и C2H5OH | 4) | C2H5NH3Br и C2H5NH2 |
Повышенный уровень сложности
31. Метиламин взаимодействует с
| 1) | водородом | 4) | бромоводородом |
| 2) | азотистой кислотой | 5) | серной кислотой |
| 3) | гидроксидом магния | 6) | бензолом |
32. Анилин взаимодействует с
| 1) | бромом | 4) | медью |
| 2) | серной кислотой | 5) | оксидом натрия |
| 3) | хлороводородом | 6) | диметиловым эфиром |
33. Диметиламин взаимодействует с
| 1) | хлороводородом | 4) | водой |
| 2) | бромной водой | 5) | кислородом |
| 3) | гидроксидом натрия | 6) | серебром |
34. Для диметиламина справедливы утверждения
| 1) | изомерен этиламину |
| 2) | жидкость с запахом аммиака |
| 3) | водный раствор окрашивает лакмус в синий цвет |
| 4) | взаимодействует со щелочами |
| 5) | горит на воздухе |
| 6) | может быть получен окислением нитрометана |
35. Для анилина справедливы утверждения
| 1) | все атомы углерода в молекуле находятся в sp2-гибридном состоянии |
| 2) | плохо растворяется в воде и бензоле |
| 3) | основные свойства выражены сильнее, чем у аммиака |
| 4) | взаимодействует с сильными кислотами с образованием солей |
| 5) | устойчив к действию окислителей |
| 6) | используется для получения красителей |
36. И для метиламина, и для анилина справедливы утверждения
| 1) | плохо растворяются в воде |
| 2) | основные свойства выражены слабее, чем у аммиака |
| 3) | способны к образованию солей |
| 4) | взаимодействуют с бромной водой |
| 5) | можно получить восстановлением соответствующих нитросоединений |
| 6) | сгорают на воздухе с образованием СО2, Н2О и N2 |
37. С хлороводородом способны взаимодействовать
| 1) | бензол | 4) | гексан |
| 2) | пропин | 5) | анилин |
| 3) | этиламин | 6) | фенол |
38. С гидроксидом натрия способны взаимодействовать
| 1) | толуол | 4) | метилформиат |
| 2) | пропин | 5) | дифениламин |
| 3) | сульфат метиламммония | 6) | тристеарат |
39. С бромной водой способны взаимодействовать
| 1) | изопропиламин | 4) | анилин |
| 2) | этилен | 5) | фенол |
| 3) | триметиламин | 6) | толуол |
40. Объем (н.у.) хлороводорода, который может присоединить этиламин массой 9 г, равен _________ л. (Запишите число с точностью до сотых.)
41. Объем (н.у.) азота, который выделяется при полном сгорании диметиламина массой 36 г, равен _________ л. (Запишите число с точностью до сотых.)
42. Для полного сгорания 8 л (н.у.) метиламина необходим кислород, объем (н.у.) которого равен _________ л. (Запишите число с точностью до целых.)
43. Какой объем (н.у.) воздуха необходим для полного сгорания 4 л (н.у.) триметиламина? Ответ: _________ л. (Запишите число с точностью до целых.)
44. К диметиламину объемом 2,24 л (н.у.) добавили 7,3 г хлороводорода. Объем (н.у.) газовой смеси после окончания реакции равен _________ л. (Запишите число с точностью до сотых.)
45. Из нитробензола массой 24,6 г с выходом 80% получили анилин, масса которого равна _________ г. (Запишите число с точностью до сотых.)
46. Из нитробензола с выходом 90% получили 25,11 г анилина. Масса нитробензола, вступившего в реакцию, равна _________ г. (Запишите число с точностью до десятых.)
47. Из нитробензола с выходом 75% получили 41,85 г анилина. Объем водорода (н.у.), вступившего в реакцию, равен _________ л. (Запишите число с точностью до сотых.)
48. При взаимодействии 12,3 г анилина с избытком бромной воды выпадает осадок, масса которого равна _________ г. (Запишите число с точностью до целых.)
49. При взаимодействии анилина с бромной водой, массовая доля брома в которой равна 4,8%, выпал осадок массой 9,9 г. Масса бромной воды, вступившей в реакцию, равна _________ г. (Запишите число с точностью до целых.)
Высокий уровень сложности
50. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CO → СН3ОН  Х1
Х1 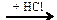 Х2
Х2  X1 → CO2
X1 → CO2
Укажите условия протекания реакций.
51. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C6H6 → С6Н5NO2 → С6Н5NH2  Х1 → С6Н5NH2
Х1 → С6Н5NH2  X2
X2
Укажите условия протекания реакций.
52. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H6 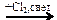 Х1
Х1  Х2
Х2  C2H5OH
C2H5OH  X2
X2  X3
X3
Укажите условия протекания реакций.
53. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
X1 → C2H4  Х1
Х1  X2
X2  X3
X3  X4
X4
Укажите условия протекания реакций.
54. (С4) Через 16%-ный раствор соляной кислоты (плотность 1,078 г/мл), объем которого 63,5 мл, пропустили 4,48 л (н.у.) метиламина. Определите массовые доли веществ в полученном растворе.
55. (С4) К 47 г 10%-ного раствора сульфата этиламмония прилили 31,2 г 20%-ного раствора хлорида бария. Определите массовые доли веществ в полученном растворе.
56. (С4) К 163 г 5%-ного раствора хлорида диметиламмония прилили 15,06 мл 30%-ного раствора гидроксида натрия (плотность 1,328 г/мл), после чего смесь нагрели. Определите массовые доли веществ в растворе после окончания реакции.
57. (С5) Установите формулу предельного третичного амина, плотность паров по водороду которого равна 36,5.
58. (С5) Установите формулу предельного первичного амина, массовая доля углерода в котором равна 53,33%.
59. (С5) Установите формулу предельного вторичного амина, массовая доля азота в котором равна 23,73%.
60. (С5) Установите молекулярную формулу предельного вторичного амина, 6,75 г которого могут присоединить 3,36 л (н.у.) хлороводорода.
61.(С5) В результате полного сгорания предельного третичного амина массой 3,54 г выделилось 0,672 л (н.у.) азота. Определите молекулярную формулу амина.
62.(С5) В результате полного сгорания предельного вторичного амина выделилось 1,76 г углекислого газа и 1,26 г воды. Определите молекулярную формулу амина.
63.(С5) Для полного сгорания предельного амина массой 12,4 г необходимо 20,16 л (н.у.) кислорода. Определите молекулярную формулу амина.
Аминокислоты. Белки
Базовый уровень сложности
1. Соединением, молекулы которого содержат две функциональные группы, является
| 1) | пропанол-2 | 2) | ацетальдегид | 3) | глицин | 4) | глицерин |
2. Глицин и аланин являются
| 1) | структурными изомерами | 3) | гомологами |
| 2) | геометрическими изомерами | 4) | одним и тем же веществом |
3. Аминоуксусная кислота и нитроэтан являются
| 1) | структурными изомерами | 3) | гомологами |
| 2) | геометрическими изомерами | 4) | одним и тем же веществом |
4. Глицин и аминоэтановая кислота являются
| 1) | структурными изомерами | 3) | одним и тем же веществом |
| 2) | геометрическими изомерами | 4) | гомологами |
5. С аминоуксусной кислотой взаимодействует каждое из двух веществ
| 1) | азот и бромоводород | 3) | бензол и серная кислота |
| 2) | гидроксид натрия и метанол | 4) | кислород и метан |
6. С аланином взаимодействует каждое из двух веществ
| 1) | водород и оксид кремния(IV) | 3) | пропан и пропанол-2 |
| 2) | вода и толуол | 4) | глицин и соляная кислота |
7. И с уксусной, и с аминоуксусной кислотой взаимодействует каждое из двух веществ
| 1) | бутан и нитрат калия | 3) | хлороводород и гидроксид калия |
| 2) | гидроксид калия и карбонат калия | 4) | серная кислота и бутанол-1 |
8. Аланин не взаимодействует с
| 1) | карбонатом натрия | 3) | азотной кислотой |
| 2) | гидроксидом натрия | 4) | хлоридом калия |
9. С гидроксидом калия, хлороводородом и этанолом взаимодействует
| 1) | толуол | 3) | глицин |
| 2) | этиламин | 4) | этановая кислота |
10. Синтетическое волокно капрон получают из ε-аминокапроновой кислоты по реакции
| 1) | полимеризации | 3) | сополимеризации |
| 2) | поликонденсации | 4) | изомеризации |
11. Верны ли следующие суждения об аминокислотах?
А. Аминокислоты – органические амфотерные соединения.
Б. Для аминокислот характерны реакции полимеризации.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
12. Верны ли следующие суждения об аминокислотах?
А. При взаимодействии аминокислот друг с другом образуются сложные эфиры.
Б. Аминокислоты можно получить в результате гидролиза белков.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
13. Верны ли следующие суждения об аминоуксусной кислоте?
А. Водный раствор аминоуксусной кислоты окрашивает лакмус в красный цвет.
Б. Аминоуксусная кислота взаимодействует и с гидроксидом натрия, и с соляной кислотой.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
14. Верны ли следующие суждения об аланине?
А. Водный раствор аланина нейтрален.
Б. Аланин образует соли при взаимодействии и с кислотами, и со щелочами.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
15. Верны ли следующие суждения о белках и их свойствах?
А. Первичная структура белков обусловлена последовательностью α-аминокислотных остатков в полипептидной цепи.
Б. Белки можно распознать с помощью раствора сульфата меди(II) в щелочной среде.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба суждения |
| 4) | оба суждения неверны |
16. Какие из приведенных утверждений о белках и их свойствах верны?
А. Белки - природные высокомолекулярные соединения.
Б. При нагревании до 90 ˚С яичный белок альбумин подвергается обратимой денатурации.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
17. Какие из приведенных утверждений о белках и их свойствах верны?
А. В молекулах белка α-аминокислотные остатки связаны между собой пептидными связями.
Б. Белки подвергаются гидролизу.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
Повышенный уровень сложности
18. Для аминоуксусной кислоты справедливы утверждения:
| 1) | является изомером глицина |
| 2) | бесцветное кристаллическое вещество |
| 3) | водный раствор окрашивает лакмус в красный цвет |
| 4) | проявляет амфотерные свойства |
| 5) | взаимодействует с аланином |
| 6) | вступает в реакции полимеризации |
19. Аланин взаимодействует с
| 1) | соляной кислотой | 4) | пропанолом-1 |
| 2) | толуолом | 5) | оксидом кремния(IV) |
| 3) | гидроксидом кальция | 6) | метаном |
20. 2-аминопропановая кислота взаимодействует с
| 1) | азотной кислотой | 4) | толуолом |
| 2) | глицином | 5) | пропаном |
| 3) | гексаном | 6) | гидроксидом натрия |
21. В реакцию поликонденсации способны вступать
| 1) | бутадиен | 4) | метаналь |
| 2) | глицин | 5) | циклогексан |
| 3) | фенол | 6) | пропен |
22. Гидролизу подвергаются
| 1) | рибоза | 4) | глицилаланин |
| 2) | крахмал | 5) | тристеарат |
| 3) | аланин | 6) | глицерин |
23. С гидроксидом натрия взаимодействуют
| 1) | глицерин | 4) | аланин |
| 2) | этан | 5) | анилин |
| 3) | фенол | 6) | хлорэтан |
24. С бромоводородом взаимодействуют
| 1) | этиленгликоль | 4) | аминоуксусная кислота |
| 2) | триэтиламин | 5) | гексан |
| 3) | толуол | 6) | бензол |
25. Соль образуется при взаимодействии между
| 1) | метилэтиламином и водой |
| 2) | глицином и гидроксидом натрия |
| 3) | 2-аминопропановой кислотой и соляной кислотой |
| 4) | анилином и серной кислотой |
| 5) | аминоуксусной кислотой и этанолом |
| 6) | глицином и аланином |
26. Масса 20%-ного раствора гидроксида натрия, которая может вступить во взаимодействие с 15 г аминоуксусной кислоты, равна _________ г. (Запишите число с точностью до целых.)
27. Масса 10%-ного раствора соляной кислоты, которая может вступить во взаимодействие с 4,5 г аминоуксусной кислоты, равна _________ г. (Запишите число с точностью до десятых.)
28. Масса соли, которая образуется при взаимодействии 8,9 г 2-аминопропионовой кислоты с 7,0 г гидроксида калия, равна _________ г. (Запишите число с точностью до десятых.)
29. Масса соли, которая образуется при взаимодействии 15,0 г глицина с 10,0 г хлороводорода, равна _________ г. (Запишите число с точностью до десятых.)
Высокий уровень сложности
30. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CН3СОН  X1
X1  Х2
Х2  Х3
Х3  X1
X1  Х4
Х4
Укажите условия протекания реакций.
31. (С4) К 91,7 мл 8%-ного раствора гидроксида натрия (плотность 1,09 г/мл) добавили 15 г аминоуксусной кислоты, а затем прилили 295,3 мл 6%-ного раствора соляной кислоты (плотность 1,03 г/мл). Определите массовые доли веществ в образовавшемся растворе.
32. (С4) К 118,1 мл 6%-ного раствора соляной кислоты (плотность 1,03 г/мл) добавили 8,9 г аланина, а затем прилили 407,8 мл 4%-ного раствора гидроксида калия (плотность 1,03 г/мл). Определите массовые доли веществ в образовавшемся растворе.
33. (С5) Одноосновная моноаминокислота массой 3,0 г при взаимодействии с избытком бромоводорода образует соль массой 6,24 г. Установите формулу аминокислоты.
34. (С5) К одноосновной моноаминокислоте массой 2,67 г для образования соли необходимо добавить 11,2 г 15%-ного раствора гидроксида калия. Установите формулу аминокислоты.
Ответы
| Теория строения органических соединений. Изомерия. Гомология | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 1 | 2 | 2 | 4 | 3 | 3 | 2 | 3 | 3 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 1 | 2 | 2 | 1 | 2 | 4 | 1 | 4 | 2 | 1 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 4 | 3 | 2 | 1 | 4 | 3 | 4 | 2 | 2 | 2 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 3 | 3 | 1 | 4 | 4 | 4 | 1 | 2 | 125 | 246 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
| Ответ | 245 | 246 | 256 | 2351 | 2341 | 4531 | 2164 | 4231 | 3234 | 2431 |
| № | 51 | |||||||||
| Ответ | 3442 | |||||||||
| Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 1 | 4 | 1 | 4 | 3 | 1 | 2 | 2 | 1 | 2 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 3 | 2 | 3 | 2 | 3 | 2 | 4 | 3 | 126 | 3356 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | ||
| Ответ | 4534 | 1122 | 126 | 3213 | 2332 | 2331 | 4212 | 2322 | ||
| Классификация и номенклатура органических соединений | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 4 | 1 | 3 | 3 | 2 | 1 | 3 | 3 | 3 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 4 | 3 | 2 | 3 | 1 | 2 | 3 | 3 | 2 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 1 | 3 | 4 | 245 | 1435 | 4112 | 6431 | 1136 | 1436 | 5315 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 4651 | 6532 | 4532 | 5621 | 4521 | 5123 | 2416 | 2615 | 3215 | 3245 |
| № | 41 | |||||||||
| Ответ | 3145 | |||||||||
| Особенности и классификация реакций в органической химии | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 4 | 2 | 2 | 3 | 2 | 1 | 4 | 1 | 3 | 2 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 4 | 3 | 1 | 1 | 3 | 2 | 125 | 234 | 256 | 124 |
| № | 21 | 22 | 23 | 24 | ||||||
| Ответ | 346 | 245 | 346 | 2142 | ||||||
| Алканы | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 2 | 2 | 4 | 3 | 4 | 3 | 3 | 3 | 3 | 2 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 2 | 2 | 3 | 3 | 4 | 2 | 4 | 2 | 2 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 1 | 3 | 2 | 1 | 1 | 2 | 1 | 3 | 3 | 3 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 3 | 4 | 1 | 125 | 246 | 345 | 345 | 145 | 134 | 145 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | |
| Ответ | 667 или 700 | 30 | 10 | 280 | 2150 | 13,44 | 8 | 24 | 0,75 | |
| 50[1]. | |
| 1) | 3С + 4Al  Al4C3 Al4C3
|
| 2) | Al4C3 + 12H2O → 3CH4 + 4Al(OH)3 |
| 3) | CH4 + Cl2  CH3Cl + HCl CH3Cl + HCl
|
| 4) | 2CH3Cl + 2Na  C2H6 + 2NaCl C2H6 + 2NaCl
|
| 5) | C2H6 + HNO3(разб.)  C2H5NO2 + H2O C2H5NO2 + H2O
|
| 5 1 . | |
| 1) | 2СO + 5H2  C2H6 + 2H2O C2H6 + 2H2O
|
| 2) | C2H6 + Cl2  C2H5Cl + HCl C2H5Cl + HCl
|
| 3) | CH3Cl + C2H5Cl + 2Na  C3H8 + 2NaCl C3H8 + 2NaCl
|
| 4) | CH3CH2CH3 + Br2  CH3CHBrCH3 + HBr CH3CHBrCH3 + HBr
|
| 5) | 2CH3CHBrCH3 + 2Na  CH3CH(CH3)CH(CH3)CH3 + 2NaBr CH3CH(CH3)CH(CH3)CH3 + 2NaBr
|
| 5 2 . | |
| 1) | 2CH4  C2H2 + 3H2 C2H2 + 3H2
|
| 2) | C2H2 + 2H2  C2H6 C2H6
|
| 3) | C2H6 + Cl2  C2H5Cl + HCl C2H5Cl + HCl
|
| 4) | 2C2H5Cl + 2Na  CH3CH2CH2CH3 + 2NaCl CH3CH2CH2CH3 + 2NaCl
|
| 5) | CH3CH2CH2CH3  CH3-CH(CH3)-CH3 CH3-CH(CH3)-CH3
|
| 5 3 . | |
| 1) | C3H7COONa + NaOH  C3H8 + Na2CO3 C3H8 + Na2CO3
|
| 2) | C3H8  СН3СН=СН2 + H2 СН3СН=СН2 + H2
|
| 3) | СН3СН=СН2 + H2  CH3CH2CH3 CH3CH2CH3
|
| 4) | СН3СН2СН3 + Br2  CH3CHBrCH3 + HBr CH3CHBrCH3 + HBr
|
| 5) | 2CH3CHBrCH3 + 2Na  CH3CH(CH3)CH(CH3)CH3 +2NaBr CH3CH(CH3)CH(CH3)CH3 +2NaBr
|
54. ω(NaOH) = 1,9%, ω(Na2CO3) = 12,6%
55. 50% пропана, 50% бутана
56. ω(NaOH) = 1,48%, ω(Na2CO3) = 5,89%
57. ω(КСl) = 3,48%, ω(ВаСl2) = 4,86%, ω(КOH) = 0,65%
58. 8,2%
59. 7,95 г
60. 6,25 г
61. 5,59 г
62. С8Н18
63. С6Н14
64. С4Н9Сl
65. С3Н7NO2
66. С2Н6
67. С3Н8
68. С2Н6
69. С2Н5Сl
| Алкены | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 1 | 3 | 2 | 3 | 3 | 4 | 4 | 1 | 4 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 2 | 3 | 1 | 2 | 4 | 4 | 2 | 2 | 3 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 4 | 4 | 3 | 2 | 4 | 2 | 3 | 1 | 2 | 3 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 2 | 2 | 3 | 1 | 2 | 4 | 2 | 3 | 2 | 1 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
| Ответ | 4 | 4 | 1 | 2 | 4 | 245 | 256 | 456 | 145 | 123 |
| № | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| Ответ | 146 | 146 | 2456 | 2136 | 1523 | 4312 | 64 | 6,72 | 8,96 | 60 |
| № | 61 | 62 | 63 | 64 | 65 | 66 | ||||
| Ответ | 10 | 12,4 | 308 | 35,84 | 750 | 16,7 | ||||
| 67[2] . | |
| 1) | СН3CH2CH2CH3 + Br2  СН3CHBrCH2CH3 + HBr СН3CHBrCH2CH3 + HBr
|
| 2) | СН3CHBrCH2CH3 + KOH(спирт. р-р)  СН3СН=СНСН3 + КBr + H2O СН3СН=СНСН3 + КBr + H2O
|
| 3) | СН3СН=СНСН3 + H2O 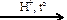 CH3CH(OH)CH2CH3 CH3CH(OH)CH2CH3
|
| 4) | CH3CH(OH)CH2CH3  СН3СН=СНСН3 + H2O СН3СН=СНСН3 + H2O
|
| 5) | 3СН3СН=СНСН3 + 2KMnO4 + 4H2O → 3СН3СН(OH)СН(OH)СН3 + + 2MnO2 + 2KOH |
| 68 . | |
| 1) | CH3CH2CH3  CH3CH=CH2 + H2 CH3CH=CH2 + H2
|
| 2) | CH3CH=CH2 + Br2 → CH3CHBrCH2Br |
| 3) | CH3CHBrCH2Br + Zn  CH3CH=CH2 + ZnCl2 CH3CH=CH2 + ZnCl2
|
| 4) | CH3CH=CH2 + H2O 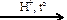 CH3CH(OH)CH3 CH3CH(OH)CH3
|
| 5) | CH3CH(OH)CH3  CH3CH=CH2 + H2O CH3CH=CH2 + H2O
|
| 69 . | |
| 1) | C2H4 + HCl → С2Н5Сl |
| 2) | 2С2Н5Сl + 2Na  СН3CH2CH2CH3 + 2NaCl СН3CH2CH2CH3 + 2NaCl
|
| 3) | СН3CH2CH2CH3 + Br2  СН3CHBrCH2CH3 + HBr СН3CHBrCH2CH3 + HBr
|
| 4) | СН3CHBrCH2CH3 + KOH(спирт. р-р)  СН3СН=СНСН3 + КBr + H2O СН3СН=СНСН3 + КBr + H2O
|
| 5) | 5СН3СН=СНСН3 + 8KMnO4 + 12H2SO4  10CH3COOH + 8MnSO4 + + 4K2SO4 + 12H2O 10CH3COOH + 8MnSO4 + + 4K2SO4 + 12H2O
|
| 70 . | |
| 1) | 3СO + 7H2  C3H8 + 3H2O C3H8 + 3H2O
|
| 2) | CH3CH2CH3  CH3CH=CH2 + H2 CH3CH=CH2 + H2
|
| 3) | CH3CH=CH2 + H2O 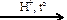 CH3CH(OH)CH3 CH3CH(OH)CH3
|
| 4) | CH3CH(OH)CH3  CH3CH=CH2 + H2O CH3CH=CH2 + H2O
|
| 5) | 3СН3СН=СН2 + 2KMnO4 + 4H2O → 3СН3СН(OH)СН2(OH) + 2MnO2 + + 2KOH |
| 71 . | |
| 1) | CH3CH2CH3  CH3CH=CH2 + H2 CH3CH=CH2 + H2
|
| 2) | CH2=CHCH3 + H2  CH3CH2CH3 CH3CH2CH3
|
| 3) | СН3CH2CH3 + Br2  СН3CHBrCH3 + HBr СН3CHBrCH3 + HBr
|
| 4) | СН3CHBrCH3 + KOH(спирт. р-р)  CH2=CHCH3 + КBr + H2O CH2=CHCH3 + КBr + H2O
|
| 5) | СН2=СНСН3 + Br2  СН2=СНСН2Br + HBr СН2=СНСН2Br + HBr
|
| 72 . | |
| 1) | СН2=СНСН2СН3 + HCl  CH2ClCH2CH2CH3 CH2ClCH2CH2CH3
|
| 2) | CH2ClCH2CH2CH3 + KOH(спирт. р-р)  CH2=CHCH2CH3 + КCl + H2O CH2=CHCH2CH3 + КCl + H2O
|
| 3) | CH2=CHCH2CH3 + H2O 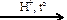 CH3CH(OH)CH2CH3 CH3CH(OH)CH2CH3
|
| 4) | CH3CH(OH)CH2CH3  СН3СН=СНСН3 + H2O СН3СН=СНСН3 + H2O
|
| 5) | СН3СН=СНСН3 + Br2 → CH3CHBrCHBrCH3 |
73. 1014 мл
74. 505,6 г
75. 33,3%
76. 1,8%
77. 6,9%
78. 2,84%
79. С7Н14
80. С3Н6
81. С4Н8
82. С3Н6
83. С5Н10
84. С2Н4
85. С6Н12
| Алкадиены. Каучуки | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 2 | 3 | 2 | 3 | 4 | 2 | 3 | 4 | 3 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 4 | 2 | 4 | 2 | 1 | 2 | 3 | 1 | 3 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 2 | 2 | 3 | 135 | 135 | 356 | 136 | 345 | 64 | 300 |
| № | 31 | 32 | 33 | 34 | 35 | |||||
| Ответ | 25 | 240 | 110 | 373 или 392 | 125,4 | |||||
| 36[3] . | |
| 1) | 2СO + 5H2  C2H6 + 2H2O C2H6 + 2H2O
|
| 2) | C2H6 + Br2  C2H5Br + HBr C2H5Br + HBr
|
| 3) | 2С2Н5Br + 2Na  СН3CH2CH2CH3 + 2NaBr СН3CH2CH2CH3 + 2NaBr
|
| 4) | СН3CH2CH2CH3  СH2=CH-CH=CH2 + 2H2 СH2=CH-CH=CH2 + 2H2
|
| 5) | СH2=CH-CH=CH2 + Br2  СH2Br-CH=CH-CH2Br или
СH2=CH-CH=CH2 + Br2 СH2Br-CH=CH-CH2Br или
СH2=CH-CH=CH2 + Br2  СH2Br-CHBr-CH=CH2 СH2Br-CHBr-CH=CH2
|
| 37 . | |
| 1) | CH3CH2CH2CH2CH2OH  CH3CH2CH2CH=CH2 + H2O CH3CH2CH2CH=CH2 + H2O
|
| 2) | CH3CH2CH2CH=CH2 + H2  CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH3
|
| 3) | CH3CH2CH2CH2CH3  CH3CHCH2CH3
|
CH3 CH3CHCH2CH3
|
CH3
|
| 4) | CH3CHCH2CH3  СH2=C-CH=CH2 + 2H2
| |
CH3 CH3 СH2=C-CH=CH2 + 2H2
| |
CH3 CH3
|
| 5) | nСH2=C-CH=CH2 → [-СH2=C-CH=CH2-]n | | CH3 CH3 |
| 38 . | |
| 1) | 2СН3Br + 2Na  СН3CH3 + 2NaBr СН3CH3 + 2NaBr
|
| 2) | СН3CH3  CH2=CH2 + H2 CH2=CH2 + H2
|
| 3) | CH2=CH2 + H2O 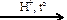 C2H5OH C2H5OH
|
| 4) | 2C2H5OH 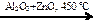 СH2=CH-CH=CH2 + 2H2O + H2 СH2=CH-CH=CH2 + 2H2O + H2
|
| 5) | nСH2=CH-CH=CH2 → [-СH2-CH=CH-CH2-]n |
39. 40%
40. 80% бутена-2 и 20% бутадиена-1,2
41. С5Н8
42. С5Н8
43. С6Н10
44. С4Н6
45. С5Н8
| Алкины | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 2 | 3 | 2 | 1 | 2 | 2 | 2 | 3 | 4 | 2 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 2 | 3 | 3 | 4 | 3 | 1 | 2 | 4 | 2 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 3 | 4 | 1 | 2 | 2 | 4 | 4 | 2 | 1 | 2 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 1 | 3 | 2 | 4 | 3 | 4 | 2 | 4 | 2 | 2 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
| Ответ | 3 | 1 | 3 | 4 | 1 | 3125 | 356 | 134 | 234 | 345 |
| № | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| Ответ | 346 | 126 | 346 | 346 | 346 | 456 | 70 | 200 | 5,6 | 112,5 |
| № | 61 | 62 | 63 | 64 | 65 | 66 | ||||
| Ответ | 2,43 | 79.2 | 100 | 286 или 300 | 18,75 | 44,8 | ||||
| 67[4] . | |
| 1) | 2CH4  C2H2 + 3H2 C2H2 + 3H2
|
| 2) | C2H2 + 2[Cu(NH3)2]Сl → CCu≡CCu + 2NH4Cl + 2NH3 |
| 3) | CCu≡CCu + 2HCl → C2H2↑ + 2CuCl↓ |
| 4) | C2H2 + HCl  CH2=CHCl CH2=CHCl
|
| 5) | nCH2=CHCl → [-CH2-CHCl-]n |
| 68 . | |
| 1) | C2H6 + Cl2  C2H5Cl + HCl C2H5Cl + HCl
|
| 2) | C2H5Cl + KOH(спирт. р-р)  СН2=CH2 + KCl + H2O СН2=CH2 + KCl + H2O
|
| 3) | СН2=CH2 + Br2 → CH2Br-CH2Br |
| 4) | CH2Br-CH2Br + 2KOH(спирт. р-р)  CH≡CH + 2KBr + 2H2O CH≡CH + 2KBr + 2H2O
|
| 5) | 3CH≡CH  C6H6 C6H6
|
| 69 . | |
| 1) | 2СO + 5H2  C2H6 + 2H2O C2H6 + 2H2O
|
| 2) | C2H6 + Br2  C2H5Br + HBr C2H5Br + HBr
|
| 3) | C2H5Br + KOH(спирт. р-р)  СН2=CH2 + KBr + H2O СН2=CH2 + KBr + H2O
|
| 4) | СН2=CH2  CH≡CH + H2 CH≡CH + H2
|
| 5) | CH≡CH + H2O  CH3COH CH3COH
|
| 70 . | |
| 1) | CaO + 3C  CaC2 + CO CaC2 + CO
|
| 2) | CaC2 + 2H2O → C2H2 + Ca(OH)2 |
| 3) | C2H2 + 2[Ag(NH3)2]OH  C2Ag2↓ + 4NH3↑ + 2H2O C2Ag2↓ + 4NH3↑ + 2H2O
|
| 4) | C2Ag2 + 2HCl → C2H2 + 2AgCl↓ |
| 5) | 3C2H2 + 8KMnO4 → 3K2C2O4 + 8MnO2 + 2KOH + 2H2O |
| 71 . | |
| 1) | СН3CH2CH3 + Br2  СН3CHBrCH3 + HBr СН3CHBrCH3 + HBr
|
| 2) | СН3CHBrCH3 + KOH(спирт. р-р)  CH3CH=CH2 + КBr + H2O CH3CH=CH2 + КBr + H2O
|
| 3) | CH3CH=CH2 + Br2 → CH3CHBrCH2Br |
| 4) | CH3CHBrCH2Br + 2KOH(спирт. р-р)  CH3С≡CH + 2KBr + 2H2O CH3С≡CH + 2KBr + 2H2O
|
| 5) | 5CH3С≡CH + 8KMnO4 + 12H2SO4  5CH3COOH + 5CO2 +
+ 8MnSO4 + 4K2SO4 + 12H2O 5CH3COOH + 5CO2 +
+ 8MnSO4 + 4K2SO4 + 12H2O
|
| 72 . | |
| 1) | C2Н5Сl + CH3Cl + 2Na  CH3CH2CH3 + 2NaCl CH3CH2CH3 + 2NaCl
|
| 2) | CH3CH2CH3  CH3CH=CH2 + H2 CH3CH=CH2 + H2
|
| 3) | CH3CH=CH2 + Br2 → CH3CHBrCH2Br |
| 4) | CH3CHBrCH2Br + 2KOH(спирт. р-р)  CH3С≡CH + 2KBr + 2H2O CH3С≡CH + 2KBr + 2H2O
|
| 5) | CH3С≡CH + H2O  CH3-C-CH3
||
O CH3-C-CH3
||
O
|
| 73 . | |
| 1) | СН3CH2CH2CH3 + Br2  СН3CHBrCH2CH3 + HBr СН3CHBrCH2CH3 + HBr
|
| 2) | СН3CHBrCH2CH3 + KOH(спирт. р-р)  СН3СН=СНСН3 + КBr + H2O СН3СН=СНСН3 + КBr + H2O
|
| 3) | СН3СН=СНСН3 + Cl2 → CH3-CHCl-CHCl-CH3 |
| 4) | CH3-CHCl-CHCl-CH3 + 2KOH(спирт. р-р)  CH3С≡CCH3 + 2KCl +
+ 2H2O CH3С≡CCH3 + 2KCl +
+ 2H2O
|
| 5) | 5CH3С≡CCH3 + 6KMnO4 + 9H2SO4  10CH3COOH + 6MnSO4 +
+ 3K2SO4 + 4H2O 10CH3COOH + 6MnSO4 +
+ 3K2SO4 + 4H2O
|
| 74 . | |
| 1) | 2CH3Cl + 2Na  C2H6 + 2NaCl C2H6 + 2NaCl
|
| 2) | C2H6 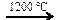 C2H2 + 2H2 C2H2 + 2H2
|
| 3) | 2C2H2  CH≡C-CH=CH2 CH≡C-CH=CH2
|
| 4) | CH≡C-CH=CH2 + HCl  CH2=C-CH=CH2
|
Cl CH2=C-CH=CH2
|
Cl
|
| 5) | nCH2=C-CH=CH2 → [-CH2-C=CH-CH2-]n | | Cl Cl |
75. 12,5 г СаСО3, ω(СаСl2) = 27,3%
76. 69,5 мл
77. 3,95 г
78. 6,64 г
79. 8,0 г
80. 0,45% КОН, 2,02% К2С2О4
81. 10 г осадка, 4,485 кг известковой воды
82. С5Н8
83. С4Н6
84. С3Н4
85. С4Н6
86. С3Н4
87. СН3СН2С≡СН
88. С6Н10
89. С5Н8
| Циклоалканы | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 1 | 4 | 2 | 1 | 1 | 4 | 3 | 1 | 4 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 4 | 3 | 4 | 3 | 2 | 1 | 2 | 3 | 3 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 2 | 2 | 1 | 3 | 1 | 4 | 236 | 235 | 345 | 145 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | |
| Ответ | 126 | 245 | 124 | 356 | 4,48 | 29,2 | 17,2 | 25 | 67,2 | |
| 40[5] . | |
| 1) |  + Br2 + Br2  CH2BrCH2CH2Br CH2BrCH2CH2Br
|
| 2) | CH2BrCH2CH2Br + Zn   + ZnBr2 + ZnBr2
|
| 3) |  + HCl → CH3CH2CH2Cl + HCl → CH3CH2CH2Cl
|
| 4) | CH3CH2CH2Cl + KOH(спирт. р-р)  CH3СH=CH2 + KCl + H2O CH3СH=CH2 + KCl + H2O
|
| 5) | CH3СH=CH2 + H2  CH3CH2CH3 CH3CH2CH3
|
| 41 . | |
| 1) | BrCH2CH2CH2CH2Br + Zn   + ZnBr2 + ZnBr2
|
| 2) |  + H2 + H2  CH3CH2CH2CH3 CH3CH2CH2CH3
|
| 3) | CH3CH2CH2CH3  CH3-CH(CH3)-CH3 CH3-CH(CH3)-CH3
|
| 4) | CH3-CH(CH3)-CH3  CH3-C(CH3)=CH2 + H2 CH3-C(CH3)=CH2 + H2
|
| 5) | CH3 | 3CH3-C(CH3)=CH2 + 2KMnO4 + 4H2O → 3СН3-С - СН2 + 2MnO2 + 2KOH | | OH OH |
| 42 . | |
| 1) | CH3COONa + NaOH  CH4 + Na2CO3 CH4 + Na2CO3
|
| 2) | 2CH4  C2H2 + 3H2 C2H2 + 3H2
|
| 3) | 3CH≡CH  C6H6 C6H6
|
| 4) | C6H6 + 3H2  C6H12 (циклогексан) C6H12 (циклогексан)
|
| 5) | С6Н12 + Br2  С6Н11Br + HBr С6Н11Br + HBr
|
43. 49,2 мл раствора NaOH, ω(NaCl) = 7,94%
44. 33,3% циклопропана и 66,7% циклобутана
45. С6Н12
46. С5Н10
47. С3Н6
48. С4Н8
| Арены | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 4 | 2 | 2 | 2 | 3 | 4 | 3 | 2 | 4 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 3 | 4 | 3 | 2 | 4 | 2 | 4 | 3 | 4 | 1 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 1 | 4 | 4 | 2 | 4 | 3 | 3 | 2 | 2 | 1 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 3 | 1 | 4 | 4 | 4 | 3 | 2 | 1 | 3 | 4 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
| Ответ | 2 | 4 | 1 | 1 | 2 | 2 | 4 | 4 | 4 | 2 |
| № | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| Ответ | 1 | 3 | 2 | 3 | 4 | 4 | 3 | 4 | 3 | 1 |
| № | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 |
| Ответ | 235 | 245 | 235 | 256 | 236 | 356 | 136 | 126 | 125 | 345 |
| № | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
| Ответ | 234 | 2652 | 2153 | 2143 | 4131 | 2246 | 13,44 | 3,36 | 26,88 | 40 |
| № | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 |
| Ответ | 32 | 84 | 120 или 126 | 134,4 | 15,68 | 60,5 | 224 или 235 | 15,6 | 39 | 56,25 |
| 91[6] . | |
| 1) | 2CH4  C2H2 + 3H2 C2H2 + 3H2
|
| 2) | 3CH≡CH  C6H6 C6H6
|
| 3) | C6H6 + Сl2  C6H5Cl + HCl C6H5Cl + HCl
|
| 4) | C6H5Cl + CH3Cl + 2Na  C6H5CH3 + 2NaCl C6H5CH3 + 2NaCl
|
| 5) | C6H5CH3 + 3HNO3  C6H2(NO2)3CH3 + 3Н2О
2,4,6-тринитротолуол C6H2(NO2)3CH3 + 3Н2О
2,4,6-тринитротолуол
|
| 92 . | |
| 1) | СаС2 + 2Н2О → C2H2 + Ca(OH)2 |
| 2) | 3CH≡CH  C6H6 C6H6
|
| 3) | C6H6 + C2H5Cl  С6Н5С2Н5 + HCl С6Н5С2Н5 + HCl
|
| 4) | С6Н5С2Н5  С6H5CH=CH2 + H2 С6H5CH=CH2 + H2
|
| 5) | С6H5CH=CH2 + 2KMnO4 + 3H2SO4  C6H5COOH + CO2↑ +
+ 2MnSO4 + K2SO4 + 4H2O C6H5COOH + CO2↑ +
+ 2MnSO4 + K2SO4 + 4H2O
|
| 93 . | |
| 1) | 2CH3CH2CH2Cl + 2Na  CH3CH2CH2CH2CH2CH3 + 2NaCl CH3CH2CH2CH2CH2CH3 + 2NaCl
|
| 2) | CH3CH2CH2CH2CH2CH3  C6H6 + 4H2O C6H6 + 4H2O
|
| 3) | С6Н6 + C2H4 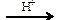 С6Н5С2Н5 С6Н5С2Н5
|
| 4) | С6Н5С2Н5  С6H5CH=CH2 + H2 С6H5CH=CH2 + H2
|
| 5) | 3С6H5CH=CH2 + 2KMnO4 + 4H2O → 3C6H5CH(OH)CH2(OH) + 2MnO2↓ + + 2KOH |
| 94 . | |
| 1) |  + HCl → CH3CH2CH2Cl + HCl → CH3CH2CH2Cl
|
| 2) | 2CH3CH2CH2Cl + 2Na  CH3CH2CH2CH2CH2CH3 + 2NaCl CH3CH2CH2CH2CH2CH3 + 2NaCl
|
| 3) | CH3CH2CH2CH2CH2CH3  C6H6 + 4H2O C6H6 + 4H2O
|
| 4) | С6Н6 + CH3Cl  C6H5CH3 + HCl C6H5CH3 + HCl
|
| 5) | C6H5CH3 + 2KMnO4 → C6H5COOK + 2MnO2↓ + KOH + H2O |
| 95 . | |
| 1) | C6H11CH3  C6H5CH3 + 3H2 C6H5CH3 + 3H2
|
| 2) | C6H5CH3 + Сl2  C6H5CH2Cl + HCl C6H5CH2Cl + HCl
|
| 3) | C6H5CH2Cl + CH3Cl + 2Na  C6H5CH2CH3 + 2NaCl C6H5CH2CH3 + 2NaCl
|
| 4) | C6H5CH2CH3  С6H5CH=CH2 + H2 С6H5CH=CH2 + H2
|
| 5) | nС6H5CH=CH2 → [-CH-CH2-]n | С6H5 |
| 96 . | |
| 1) | СН3СН(ОН)СН3 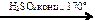 СН3СH=СН2 + H2O СН3СH=СН2 + H2O
|
| 2) | СН3СH=СН2 + Br2 → CH3CHBrCH2Br |
| 3) | CH3CHBrCH2Br + 2KOH(спирт. р-р)  CH3С≡CH + 2KBr + 2H2O CH3С≡CH + 2KBr + 2H2O
|
| 4) | 3CH3С≡CH  C6H3(CH3)3 C6H3(CH3)3
|
| 5) | 5C6H3(CH3)3 + 18KMnO4 + 27H2SO4  5C6H3(COOH)3 + 18MnSO4 +
+ 9K2SO4 + 42H2O 5C6H3(COOH)3 + 18MnSO4 +
+ 9K2SO4 + 42H2O
|
| 97 . | |
| 1) | 3CH≡CH  C6H6 C6H6
|
| 2) | С6Н6 + C2H5Cl  С6Н5С2Н5 + HCl С6Н5С2Н5 + HCl
|
| 3) | C6H5C2H5 + Сl2  C6H5CHClCH3 + HCl C6H5CHClCH3 + HCl
|
| 4) | C6H5CHClCH3 + CH3Cl + 2Na  С6Н5СН(СН3)2 + 2NaCl С6Н5СН(СН3)2 + 2NaCl
|
| 5) | 5С6Н5СН(СН3)2 + 18KMnO4 + 27H2SO4  5C6H5COOH + 10CO2↑ +
+ 18MnSO4 + 9K2SO4 + 42H2O 5C6H5COOH + 10CO2↑ +
+ 18MnSO4 + 9K2SO4 + 42H2O
|
| 98 . | |
| 1) | С6Н5СООNa + NaOH  C6H6 + Na2CO3 C6H6 + Na2CO3
|
| 2) | С6Н6 + C2H4 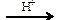 С6Н5С2Н5 + HCl С6Н5С2Н5 + HCl
|
| 3) | C6H5C2H5 + Сl2  C6H5CHClCH3 + HCl C6H5CHClCH3 + HCl
|
| 4) | C6H5CHClCH3 + KOH(спирт. р-р)  C6H5CH=CH2 + КCl + H2O C6H5CH=CH2 + КCl + H2O
|
| 5) | C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br |
| 99 . | |
| 1) | CH2=CH2 + Br2  CH2Br-CH2Br CH2Br-CH2Br
|
| 2) | CH2Br-CH2Br + 2KOH(спирт. р-р)  CH≡CH + 2KBr + 2H2O CH≡CH + 2KBr + 2H2O
|
| 3) | 3CH≡CH  C6H6 C6H6
|
| 4) | C6H6 + Сl2  C6H5Cl + HCl C6H5Cl + HCl
|
| 5) | 2C6H5Cl + 2Na  C6H5-C6H5 + 2NaCl C6H5-C6H5 + 2NaCl
|
100. ω(NaOH) = 4,30%, ω(NaBr) = 15,94%
101. 1,081 г
102. ω(AgNO3) = 7,85%, ω(HNO3) = 5,15%
103. ω(НBr) = 8,7%, ω(HNO3) = 3,6%
104. 60% бензола, 40% стирола
105. С6Н5С2Н5
106. С8Н10
107. С6Н5С2Н5
108. С9Н12
109. С7Н8
110. С8Н10
11 1 . С6Н6
| Природные источники углеводородов | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 4 | 2 | 1 | 3 | 4 | 3 | 4 | 1 | 2 | 3 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |
| Ответ | 1 | 3 | 2 | 3 | 234 | 976 или 1025 | 152 | 280,8 | 234,6 | |
| Спирты. Фенолы | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 2 | 3 | 2 | 3 | 4 | 4 | 3 | 3 | 3 | 2 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 3 | 3 | 3 | 4 | 3 | 1 | 2 | 4 | 4 | 2 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 4 | 3 | 1 | 2 | 2 | 4 | 4 | 3 | 4 | 2 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 2 | 2 | 3 | 4 | 3 | 4 | 2 | 2 | 4 | 2 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
| Ответ | 4 | 3 | 4 | 2 | 3 | 2 | 2 | 2 | 2 | 3 |
| № | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| Ответ | 4 | 2 | 1 | 4 | 3 | 3 | 1 | 3 | 1 | 4 |
| № | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 |
| Ответ | 2 | 4 | 4 | 1 | 3 | 4 | 4 | 2 | 3 | 3 |
| № | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
| Ответ | 3 | 2 | 4 | 2 | 4 | 1 | 2 | 4 | 2 | 2 |
| № | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 |
| Ответ | 3 | 3 | 2 | 2 | 2 | 3 | 2 | 2 | 3 | 4 |
| № | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 |
| Ответ | 1 | 1 | 3 | 1 | 2 | 4 | 3 | 3 | 1 | 4 |
| № | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 |
| Ответ | 3 | 2 | 2 | 3 | 4 | 2 | 2 | 3 | 4 | 4 |
| № | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 |
| Ответ | 2143 | 256 | 135 | 235 | 236 | 356 | 146 | 146 | 346 | 234 |
| № | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 |
| Ответ | 1113 | 64,4 | 149 | 82,8 | 17,6 | 9,2 | 18,6 | 23,2 | 26,88 | 3,31 |
| № | 131 | 132 | 133 | 134 | 135 | 136 | 137 | |||
| Ответ | 3,76 | 8,96 | 13,44 | 187 или 196 | 12,4 | 24,3 | 100 | |||
| 138[7] . | |
| 1) | CO + 2H2  СН3ОН СН3ОН
|
| 2) | СН3ОН + HCl → СН3Сl + H2O |
| 3) | 2СН3Сl + 2Na  C2H6 + 2NaCl C2H6 + 2NaCl
|
| 4) | C2H6  CH2=CH2 + H2 CH2=CH2 + H2
|
| 5) | CH2=CH2 + H2O  CH3CH2OH CH3CH2OH
|
| 139 . | |
| 1) | Al4C3 + 12H2O → 3CH4 + 4Al(OH)3 |
| 2) | CH4 + Cl2  CH3Cl + HCl CH3Cl + HCl
|
| 3) | CH3Cl + NaOH  CH3OH + NaCl CH3OH + NaCl
|
| 4) | 2CH3OH  CH3-O-CH3 + H2O CH3-O-CH3 + H2O
|
| 5) | CH3-O-CH3 + 3O2 → 2CO2 + 3H2O |
| 140 . | |
| 1) | СаС2 + 2Н2О → C2H2 + Ca(OH)2 |
| 2) | C2H2 + H2  C2H4 C2H4
|
| 3) | CH2=CH2 + HCl → CH3-CH2Cl |
| 4) | CH3-CH2Cl + KOH(водн.р-р)  CH3-CH2OH + KCl CH3-CH2OH + KCl
|
| 5) | 5CH3-CH2OH + 4KMnO4 + 6H2SO4  5CH3COOH + 4MnSO4 +
+ 2K2SO4 + 11H2O 5CH3COOH + 4MnSO4 +
+ 2K2SO4 + 11H2O
|
| 141 . | |
| 1) |  + H2 + H2  CH3CH2CH3 CH3CH2CH3
|
| 2) | СН3CH2CH3 + Br2  СН3CHBrCH3 + HBr СН3CHBrCH3 + HBr
|
| 3) | СН3CHBrCH3 + KOH(водн.р-р)  CH3-CHOH-CH3 + KBr CH3-CHOH-CH3 + KBr
|
| 4) | CH3-CHOH-CH3 + CuO  CH3-CO-CH3 + Cu + H2O CH3-CO-CH3 + Cu + H2O
|
| 5) | CH3-CO-CH3 + H2  CH3-CHOH-CH3 CH3-CHOH-CH3
|
| 142 . | |
| 1) | СН3CH2CH2CH3 + Br2  СН3CHBrCH2CH3 + HBr СН3CHBrCH2CH3 + HBr
|
| 2) | СН3CHBrCH2CH3 + KOH(спирт. р-р)  СН3СН=СНСН3 + КBr + H2O СН3СН=СНСН3 + КBr + H2O
|
| 3) | СН3СН=СНСН3 + Br2 → CH3-CHBr-CHBr-CH3 |
| 4) | CH3-CHBr-CHBr-CH3 + 2KOH(водн.р-р) → CH3-CH(OH)-CH(OH)-CH3 + + 2KBr |
| 5) | CH3-CH(OH)-CH(OH)-CH3 + 2Na → CH3-CH(ONa)-CH(ONa)-CH3 + H2 |
| 143 . | |
| 1) | C6H12O6  2C2H5OH + 2СО2 2C2H5OH + 2СО2
|
| 2) | C2H5OH 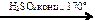 CH2=CH2 + H2O CH2=CH2 + H2O
|
| 3) | CH2=CH2 + HCl → CH3-CH2Cl |
| 4) | CH3-CH2Cl + KOH(спирт. р-р)  СН2=СН2 + КBr + H2O СН2=СН2 + КBr + H2O
|
| 5) | 3СН2=СН2 + 2KMnO4 + 4H2O → 3CH2(OH)-CH2(OH) + 2MnO2↓ + 2KOH |
| 144 . | |
| 1) | C6H6 + Сl2  C6H5Cl + HCl C6H5Cl + HCl
|
| 2) | C6H5Cl + 2NaOH → C6H5ONa + NaCl + H2O |
| 3) | C6H5ONa + HCl → C6H5OH + NaCl |
| 4) | C6H5OH + 3H2  C6H11OH (циклогексанол) C6H11OH (циклогексанол)
|
| 5) | 2C6H11OH + 17О2 → 12СО2 + 12Н2О |
| 145 . | |
| 1) | CH3CH2CH2OH 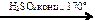 CH3CH=CH2 + H2O CH3CH=CH2 + H2O
|
| 2) | CH3CH=CH2 + Br2  CH2BrCH=CH2 + HBr CH2BrCH=CH2 + HBr
|
| 3) | CH2BrCH=CH2 + NaOH(водн.р-р) → CH2(OH)CH=CH2 + NaBr |
| 4) | CH2(OH)CH=CH2 +H2O2  CH2(OH)-CH(OH)-CH2(OH) CH2(OH)-CH(OH)-CH2(OH)
|
| 5) | CH2(OH)-CH(OH)-CH2(OH) + 3HNO3 
 CH2(ONO2)-CH(ONO2)-CH2(ONO2) + 3H2O CH2(ONO2)-CH(ONO2)-CH2(ONO2) + 3H2O
|
146. 505,6 г
147. 42,6% этанола, 57,4% этиленгиколя
148. 10,76%
149. 4,3%
150. С3Н6(ОН) 2
151. С4Н8(ОН)2
152. С4Н9ОН
153. С5Н11ОН
154. С4Н8(ОН)2
155. С3Н7ОН
156. СН3ОН
157. С5Н9(ОН)3
158. С6Н4(ОН)С2Н5
159. С3Н8О
160. С2Н6О2
161. С2Н6О
162. СН4О
| Альдегиды и кетоны | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 3 | 3 | 3 | 3 | 1 | 1 | 4 | 4 | 1 | 3 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 3 | 1 | 4 | 4 | 4 | 3 | 2 | 3 | 4 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 2 | 3 | 2 | 4 | 3 | 2 | 3 | 4 | 2 | 3 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 4 | 1 | 1 | 3 | 3 | 3 | 3 | 4 | 4 | 4 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
| Ответ | 3 | 1 | 2543 | 145 | 126 | 246 | 135 | 235 | 6554 | 126 |
| № | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| Ответ | 124 | 236 | 356 | 256 | 456 | 124 | 0,44 | 6,48 | 44,8 | 11,2 |
| № | 61 | 62 | 63 | 64 | 65 | 66 | ||||
| Ответ | 4,4 | 6,72 | 4,48 | 213 или 224 | 13,8 | 80 | ||||
| 67[8] . | |
| 1) | СаС2 + 2Н2О → C2H2 + Ca(OH)2 |
| 2) | C2H2 + H2O  CH3COH CH3COH
|
| 3) | CH3COH + H2  CH3CH2OH CH3CH2OH
|
| 4) | CH3CH2OH + CuO  CH3COH + Cu + H2O CH3COH + Cu + H2O
|
| 5) | CH3COH + 2[Ag(NH3)2]OH  CH3COONH4 + 2Ag↓ + 3NH3↑ + H2O CH3COONH4 + 2Ag↓ + 3NH3↑ + H2O
|
| 68 . | |
| 1) | СН3СН2СН2СООNa + NaOH  C3H8 + Na2CO3 C3H8 + Na2CO3
|
| 2) | СН3CH2CH3 + Br2  СН3CHBrCH3 + HBr СН3CHBrCH3 + HBr
|
| 3) | СН3CHBrCH3 + NaOH(водн.р-р)  CH3-CHOH-CH3 + NaBr CH3-CHOH-CH3 + NaBr
|
| 4) | CH3-CHOH-CH3 + CuO  CH3-CO-CH3 + Cu + H2O CH3-CO-CH3 + Cu + H2O
|
| 5) | CH3-CO-CH3 + 4O2  3CO2 + 3H2O 3CO2 + 3H2O
|
| 69 . | |
| 1) | Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3↓ |
| 2) | CH4 + Br2  CH3Br + HBr CH3Br + HBr
|
| 3) | CH3Br + NaOH(водн.р-р)  CH3OH + NaBr CH3OH + NaBr
|
| 4) | CH3OH + CuO  HCOH + Cu + H2O HCOH + Cu + H2O
|
| 5) | 3HCOH + 2K2Cr2O7 + 8H2SO4 → 3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 11H2O |
| 70 . | |
| 1) | 2C2H5Br + 2 Na  CH3CH2CH2CH3 + 2NaBr CH3CH2CH2CH3 + 2NaBr
|
| 2) | CH3CH2CH2CH3 + Br2  CH3CHBrCH2CH3 + HBr CH3CHBrCH2CH3 + HBr
|
| 3) | CH3CHBrCH2CH3 + NaOH(водн.р-р)  CH3CH(OH)CH2CH3 + NaBr CH3CH(OH)CH2CH3 + NaBr
|
| 4) | CH3CH(OH)CH2CH3 + CuO  CH3C(O)CH2CH3 + Cu + H2O CH3C(O)CH2CH3 + Cu + H2O
|
| 5) | 5CH3C(O)CH2CH3 + 6KMnO4 + 9H2SO4  10CH3COOH + 6MnSO4 + + 3K2SO4 + 9H2O 10CH3COOH + 6MnSO4 + + 3K2SO4 + 9H2O
|
| 71 . | |
| 1) | C6H6 + CH3Cl  C6H5CH3 + HCl C6H5CH3 + HCl
|
| 2) | C6H5CH3 + Cl2  C6H5CH2Cl + HCl C6H5CH2Cl + HCl
|
| 3) | C6H5CH2Cl + NaOH(водн.р-р)  C6H5CH2OH + NaCl C6H5CH2OH + NaCl
|
| 4) | C6H5CH2OH + CuO  C6H5COH + Cu + H2O C6H5COH + Cu + H2O
|
| 5) | C6H5COH + 2Cu(OH)2  C6H5COOH + Cu2O + 2H2O C6H5COOH + Cu2O + 2H2O
|
72. 3,6 г
73. 30% или 60,,
74. 75,2% СН3СОН, 24,8% С2Н5СОН
75. 2,47%
76. С2Н5СОН
77. С2Н5СОН
78. С4Н9СОН
79. С2Н5СОН
80. С3Н7СОН
81. С4Н9СОН
82. С2Н4О
83. С3Н6О
84. СН2О
| Карбоновые кислоты. Сложные эфиры | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 3 | 1 | 1 | 3 | 4 | 2 | 4 | 3 | 3 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 1 | 4 | 2 | 1 | 2 | 3 | 2 | 4 | 3 | 3 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 2 | 4 | 1 | 1 | 2 | 3 | 2 | 1 | 3 | 4 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 3 | 4 | 1 | 2 | 3 | 2 | 2 | 3 | 1 | 3 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
| Ответ | 2 | 2 | 4 | 4 | 3 | 2 | 3 | 3 | 3 | 2 |
| № | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 |
| Ответ | 3 | 1 | 3 | 2 | 1 | 3 | 3 | 3 | 2 | 1 |
| № | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 |
| Ответ | 3 | 1 | 3 | 1 | 4 | 3 | 2 | 3 | 5341 | 3245 |
| № | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 |
| Ответ | 256 | 3231 | 3113 | 1223 | 356 | 156 | 245 | 346 | 346 | 456 |
| № | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 |
| Ответ | 345 | 346 | 123 | 144 | 4,48 | 60 | 8,28 | 32,8 | 5,28 | 17,5 |
| № | 91 | 92 | ||||||||
| Ответ | 257 | 10 | ||||||||
| 93[9] . | |
| 1) | СаС2 + 2Н2О → C2H2 + Ca(OH)2 |
| 2) | C2H2 + H2O  CH3COH CH3COH
|
| 3) | CH3COH + 2Cu(OH)2  CH3COOH + Cu2O + 2H2O CH3COOH + Cu2O + 2H2O
|
| 4) | CH3COOH + NaOH → CH3COONa + H2O |
| 5) | СН3СООNa + NaOH  CH4 + Na2CO3 CH4 + Na2CO3
|
| 94 . | |
| 1) | CO + NaOH(тв.)  HCOONa HCOONa
|
| 2) | 2HCOONa + H2SO4 → 2HCOOH + Na2SO4 |
| 3) | HCOOH + CH3OH  HCOOCH3 + H2O HCOOCH3 + H2O
|
| 4) | HCOOCH3 + H2O  HCOOH + CH3OH HCOOH + CH3OH
|
| 5) | HCOOH + 2[Ag(NH3)2]OH  CO2↑ + 2Ag↓ + 4NH3↑ + 2H2O CO2↑ + 2Ag↓ + 4NH3↑ + 2H2O
|
| 95 . | |
| 1) | С2Н5СООН + Cl2  CH3CHClCOOH + HCl CH3CHClCOOH + HCl
|
| 2) | CH3CHClCOOH + 2KOH(спирт. р-р)  СН2=СНCOOK + КCl + 2H2O СН2=СНCOOK + КCl + 2H2O
|
| 3) | СН2=СНCOOK + HCl → СН2=СНCOOH + KCl |
| 4) | СН2=СНCOOH + CH3OH  СН2=СНCOOCH3 + H2O СН2=СНCOOCH3 + H2O
|
| 5) | nСН2=СНCOOCH3 → [-CH2-CH-]n | COOCH3 |
| 96. | |
| 1) | C6H12O6 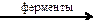 2C2H5OH + 2СО2 2C2H5OH + 2СО2
|
| 2) | 5C2H5OH + 4KMnO4 + 6H2SO4  5CH3COOH + 4MnSO4 + 2K2SO4 + + 11H2O 5CH3COOH + 4MnSO4 + 2K2SO4 + + 11H2O
|
| 3) | CH3COOH + CH3CH(OH)CH3  CH3COOCH(CH3)2 + H2O CH3COOCH(CH3)2 + H2O
|
| 4) | CH3COOCH(CH3)2 + KOH → CH3COOK + CH3CH(OH)CH3 |
| 5) | 2CH3COOK + 2H2O  С2H6 + 2CO2 + H2 + 2KOH С2H6 + 2CO2 + H2 + 2KOH
|
| 97 . | |
| 1) | C6H6 + CH3Cl  C6H5CH3 + HCl C6H5CH3 + HCl
|
| 2) | 5C6H5CH3 + 6KMnO4 + 9H2SO4  5C6H5COOH + 6MnSO4 +
+ 3K2SO4 + 14H2O 5C6H5COOH + 6MnSO4 +
+ 3K2SO4 + 14H2O
|
| 3) | C6H5COOH + CH3OH  C6H5COOCH3 + H2O C6H5COOCH3 + H2O
|
| 4) | C6H5COOCH3 + NaOH → C6H5COONa + CH3OH |
| 5) | C6H5COONa + NaOH  C6H6 + Na2CO3 C6H6 + Na2CO3
|
| 98 . | |
| 1) | C6H11CH3  C6H5CH3 + 3H2 C6H5CH3 + 3H2
|
| 2) | C6H5CH3 + 2Cl2  C6H5CHCl2 + 2HCl C6H5CHCl2 + 2HCl
|
| 3) | C6H5CHCl2 + 2NaOH → C6H5COH + 2NaCl + H2O |
| 4) | 3C6H5COH + K2Cr2O7 + 4H2SO4 → 3C6H5COOH + Cr2(SO4)3 + K2SO4 + + 4H2O |
| 5) | C6H5COOH + C2H5OH  C6H5COOC2H5 + H2O C6H5COOC2H5 + H2O
|
| 99 . | |
| 1) | СН3СООK + KOH  CH4 + K2CO3 CH4 + K2CO3
|
| 2) | 2CH4  C2H2 + 3H2 C2H2 + 3H2
|
| 3) | 3C2H2 + 8KMnO4 → 3К2C2O4 + 8MnO2 + 2KOH + 2H2O |
| 4) | К2C2O4 + 2HCl → Н2C2O4 + 2KCl |
| 5) | Н2C2O4  CO + CO2 + H2O CO + CO2 + H2O
|
| 100. | |
| 1) | 2C2H5Cl + 2Na  C4H10 + NaCl C4H10 + NaCl
|
| 2) | 2C4H10 + 5O2 → 4CH3COOH + 2H2O |
| 3) | 2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O |
| 4) | (CH3COO)2Ca  CH3-C(O)-CH3 + CaCO3 CH3-C(O)-CH3 + CaCO3
|
| 5) | 5CH3-C(O)-CH3 + 6KMnO4 + 9H2SO4  5CH3COOH + 5HCOOH +
+ 6MnSO4 + 3K2SO4 + 9H2O 5CH3COOH + 5HCOOH +
+ 6MnSO4 + 3K2SO4 + 9H2O
|
101. 7,97% С2Н5CОOН, 5,17% С2Н5CОONa
102. 2,42% НCОONa, 4,48% NaHCO3
103. 6,52% Na2CO3, 1,23% NaOH
104. 7,82 г муравьиной кислоты, ω(NaOH) = 22,8%
105. 42,3% этилацетата, 57,7% метилформиата
106. С2Н5СООН
107. С3Н7СООН
108. СН3СООН
109. НСООН
110. СН3СООН
111. СН3СООС2Н5
11 2 . НСООС2Н5 или СН3СООСН3
11 3 . С3Н4О2
| Углеводы | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 1 | 3 | 1 | 2 | 3 | 4 | 4 | 1 | 2 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 4 | 3 | 1 | 4 | 3 | 3 | 1 | 4 | 2 | 4 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 1 | 4 | 2 | 1 | 124 | 145 | 124 | 135 | 234 | 134 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 123 | 134 | 234 | 268,8 | 53,76 | 360 | 720 | 45 | 46 | 100 |
| 41[10] . | |
| 1) | 6СO2 + 6H2O  С6Н12О6 + 6О2 С6Н12О6 + 6О2
|
| 2) | C6H12O6 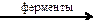 2C2H5OH + 2СО2 2C2H5OH + 2СО2
|
| 3) | С2H5OH + CH3COOH  CH3COOC2H5 + H2O CH3COOC2H5 + H2O
|
| 4) | CH3COOC2H5 + 5O2 → 4CO2 + 4H2O |
| 5) | 6nCO2 + 5nH2O  (C6H10O5)n + 6nO2 (C6H10O5)n + 6nO2
|
| 42 . | |
| 1) | (C6H10O5)n + (n-1)H2O  nC6H12О6 nC6H12О6
|
| 2) | C6H12О6 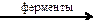 2СН3СН(ОН)СООН 2СН3СН(ОН)СООН
|
| 3) | СН3СН(ОН)СООН + HCOOH  CH3CHCOOH + H2O
|
OОCН CH3CHCOOH + H2O
|
OОCН
|
| 4) | CH3CHCOOH + CH3OH  CH3CHCOOCH3 + H2O
| |
OОCН OOCH CH3CHCOOCH3 + H2O
| |
OОCН OOCH
|
| 5) | CH3CHCOOСH3 + 5O2 → 5CO2 + 4H2O | OОCН |
43. 792 г
44. 166,6 мл
| Амины | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 2 | 4 | 3 | 3 | 1 | 3 | 4 | 2 | 2 | 4 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 2 | 3 | 4 | 4 | 1 | 3 | 4 | 2 | 4 | 2 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| Ответ | 3 | 2 | 1 | 2 | 3 | 3 | 1 | 2 | 4 | 4 |
| № | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
| Ответ | 245 | 123 | 145 | 135 | 146 | 356 | 235 | 346 | 245 | 4,48 |
| № | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | |
| Ответ | 8,96 | 18 | 100 или 105 | 2,24 | 14,88 | 36,9 | 40,32 | 33 | 300 | |
| 50[11] . | |
| 1) | CO + 2H2  СН3ОН СН3ОН
|
| 2) | CH3OH + NH3  CH3NH2 + H2O CH3NH2 + H2O
|
| 3) | CH3NH2 + HCl → [CH3NH3]Cl |
| 4) | [CH3NH3]Cl + NaOH → CH3NH2 + NaCl + H2O |
| 5) | 4CH3NH2 + 9O2 → 4CO2 + 2N2 + 10H2O |
| 51 . | |
| 1) | C6H6 + HNO3  C6H5NO2 + H2O C6H5NO2 + H2O
|
| 2) | C6H5NO2 + 3H2 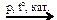 C6H5NH2 + 2H2O C6H5NH2 + 2H2O
|
| 3) | C6H5NH2 + HBr → [C6H5NH3]Br |
| 4) | [C6H5NH3]Br + NaOH → C6H5NH2 + NaBr + H2O |
| 5) | C6H5NH2 + 3Br2 → C6H2Br3NH2↓ |
| 52 . | |
| 1) | C2H6 + Cl2  C2H5Cl + HCl C2H5Cl + HCl
|
| 2) | C2H5Cl + 2NH3  C2H5NH2 + NH4Cl C2H5NH2 + NH4Cl
|
| 3) | C2H5NH2 + HNO2 → C2H5OH + N2 + H2O |
| 4) | C2H5OH + NH3  C2H5NH2 + H2O C2H5NH2 + H2O
|
| 5) | 2C2H5NH2 + H2SO4 → [C2H5NH3]2SO4 или C2H5NH2 + H2SO4 → [C2H5NH3]HSO4 |
| 53 . | |
| 1) | C2H5OH 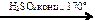 C2H4 + H2O C2H4 + H2O
|
| 2) | C2H4 + HI → C2H5I |
| 3) | C2H5I + C2H5NH2 → [(C2H5)2NH2]I |
| 4) | [(C2H5)2NH2]I + NH3 → (C2H5)2NH + NH4I |
| 5) | 2(C2H5)2NH + 2Na → 2(C2H5)2NNa + H2 |
54. 18,08 % хлорида метиламмония, 4,89% НСl
55. 5,63 % хлорида этиламмония, 1,44% ВаСl2
56. 3,25% NaCl, 1,12% NaOH
57. (С2Н5)(СН3)2N
58. С2Н5NН2
59. (С2Н5)(СН3)NН
60. (СН3)2NН
61. (СН3)3N
62. (СН3)2NН
63. СН3NН2
| Аминокислоты. Белки | ||||||||||
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Ответ | 3 | 3 | 1 | 3 | 2 | 4 | 2 | 4 | 3 | 2 |
| № | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Ответ | 1 | 2 | 2 | 3 | 3 | 1 | 3 | 245 | 134 | 126 |
| № | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | |
| Ответ | 234 | 245 | 346 | 124 | 234 | 40 | 21,9 | 12,7 | 22,3 | |
| 30[12]. | |
| 1) | CН3СОН + 2Cu(OH)2  CH3COOH + Cu2O + 2H2O CH3COOH + Cu2O + 2H2O
|
| 2) | CH3COOH + Сl2  CH2ClCOOH + HCl CH2ClCOOH + HCl
|
| 3) | CH2ClCOOH + 2NH3 → NH2CH2COOH + NH4Cl |
| 4) | NH2CH2COOH + NaOH → NH2CH2COONa + H2O |
| 5) | NH2CH2COONa + 2HCl → [NH3CH2COOH]Cl + NaCl |
31. 5,32% [NH3CH2COOH]Cl, 2,79% NaCl, 0,87% HCl
32. 2,31% NH2CH(СН3)COOK, 2,71% KCl
33. NH2CН2СOOН
34. NH2CН(СН3)СOOН
Список литературы
1. Габриелян О.С. Химия. 10 класс (базовый уровень). - М.: Дрофа, 2008.
2. Каверина А.А., Медведев Ю.Н., Добротин Д.Ю. Типичные ошибки при выполнении заданий Единого государственного экзамена по химии. – М.: ООО «ТИД «Русское слово – РС», 2009.
3. Кузнецова Н.Е., Титова И.М., Гара Н.Н. Химия. 10 класс (профильный уровень). – М.: Вентана-Граф, 2006.
4. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. – М.: Экзамен, 2000.
5. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. – М.: Экзамен, 2000.
6. Медведев Ю.Н. ЕГЭ. Химия. Типовые тестовые задания. – М.: Экзамен, 2008.
7. Новошинский И.И., Новошинская Н.С. Органическая химия. 11 класс (профильный уровень). – М.: ООО «ТИД «Русское слово – РС», 2008.
8. Отличник ЕГЭ. Химия. Решение сложных задач /под ред. А.А. Кавериной. – М.: Интеллект-Центр, 2010.
9. Пособие по подготовке к ЕГЭ. Химия. Типовые тестовые задания. – СПб.: Тригон, 2008.
10. Самое полное издание типовых вариантов реальных заданий ЕГЭ: 2009: Химия / Авт.-сост. А.С. Корощенко, М.Г. Снастина. – М. АСТ: Астрель, 2008.
11. Химия. 10 класс (профильный уровень) / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. - М.: Дрофа, 2007.
12. Химия. 11 класс (базовый уровень) / В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008.
13. www.ege.ru.
14. www.fipi.ru.
Оглавление
| Предисловие.………………………………………………………………..... | 3 |
| Теория строения органических соединений. Изомерия. Гомология …….. | 6 |
| Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода.………..……………………………………... | 15 |
| Классификация и номенклатура органических соединений……………… | 20 |
| Особенности и классификация реакций в органической химии…………. | 28 |
| Алканы……………………………………………………………...………… | 32 |
| Алкены………………………………………………………………………... | 41 |
| Алкадиены. Каучуки………………………………………………………… | 53 |
| Алкины……………………………………………………………………….. | 59 |
| Циклоалканы…………………………………………………………………. | 70 |
| Арены………………………………………………………………………… | 76 |
| Природные источники углеводородов………………………………........... | 90 |
| Спирты. Фенолы……………………………………………………………... | 93 |
| Альдегиды и кетоны………………………………………………………… | 112 |
| Карбоновые кислоты. Сложные эфиры…………………………………….. | 122 |
| Углеводы……………………………………………………………………... | 136 |
| Амины………………………………………………………………………… | 142 |
| Аминокислоты. Белки……………………………………………………….. | 149 |
| Ответы………………………………………………………………………. | 154 |
| Список литературы…………………………………………………………. | 164 |
[1] На задания 50 – 53 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[2] На задания 67 – 72 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[3] На задания 36 – 38 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[4] На задания 67 – 74 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[5] На задания 40 – 42 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[6] На задания 91 – 99 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[7] На задания 138 – 145 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[8] На задания 67 – 71 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[9] На задания 93 – 100 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[10] На задания 41 – 42 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[11] На задания 50 – 53 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
[12] На заданиe 30 даны возможные варианты ответа; допускаются иные формулировки, не искажающие смысла задания.
Дата добавления: 2019-01-14; просмотров: 42987; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
