Особенности и классификация реакций в органической химии 7 страница
47. По правилу Марковникова происходит взаимодействие между
| 1) | бутином-2 и хлороводородом | 4) | бутаном и хлором |
| 2) | бутином-1 и водородом | 5) | пропеном и бромоводородом |
| 3) | бутином-1 и водой | 6) | пропином и водой |
48. Бутин-1 способен реагировать с
| 1) | натрием | 4) | кислородом |
| 2) | гидроксидом натрия | 5) | хлоридом меди(II) |
| 3) | водой | 6) | серебром |
49. Бутин-2 способен реагировать с
| 1) | аммиачным раствором хлорида меди(I) |
| 2) | водным раствором перманганата калия |
| 3) | хлороводородом |
| 4) | бромом |
| 5) | натрием |
| 6) | гидроксидом калия |
50. Ацетилен способен реагировать с каждым из веществ, указанных в ряду
| 1) | NaОH, C6H5Cl, I2 | 4) | [Cu(NH3)2]Cl, O2, Na |
| 2) | CuSO4, H2, Li2O | 5) | KMnO4, HCN, HBr |
| 3) | H2O, Br2, [Ag(NH3)2]OH | 6) | Ag, Cu(OH)2, Cl2 |
51. Пропин способен реагировать с каждым из веществ, указанных в ряду
| 1) | LiОH, C6H6, I2 | 4) | H2, O2, Na |
| 2) | Cu, H2, H2O | 5) | KMnO4, CH4, HBr |
| 3) | Cl2, HCl, [Ag(NH3)2]OH | 6) | H2O, [Cu(NH3)2]Cl, Br2 |
52. Для ацетилена справедливы утверждения
| 1) | атомы углерода в молекуле находятся в состоянии sp-гибридизации |
| 2) | молекула имеет линейное строение |
| 3) | при обычных условиях - газ, тяжелее воздуха |
| 4) | взаимодействует с медью с выделением водорода |
| 5) | окисляется под действием гидроксида меди(II) |
| 6) | горит на воздухе коптящим пламенем |
53. Для бутина-2 характерны
| 1) | sp-гибридизация всех атомов углерода в молекуле |
| 2) | наличие цис-транс-изомеров |
| 3) | реакция гидрирования |
| 4) | окисление под действием перманганата калия |
| 5) | взаимодействие с аммиачным раствором оксида серебра |
| 6) | обесцвечивание бромной воды |
|
|
|
54. И для ацетилена, и для дивинила характерны
| 1) | наличие сопряженных двойных связей |
| 2) | взаимодействие с натрием |
| 3) | реакция полимеризации |
| 4) | взаимодействие с галогеноводородами |
| 5) | горение на воздухе бесцветным пламенем |
| 6) | реакция гидрирования |
55. И для ацетилена, и для этилена характерны
| 1) | sp2-гибридизация всех атомов углерода в молекуле |
| 2) | наличие двух π-связей в молекуле |
| 3) | взаимодействие с галогенами |
| 4) | обесцвечивание раствора перманганата калия |
| 5) | реакция с аммиачным раствором оксида серебра |
| 6) | горение на воздухе |
56. Бутин-1 в отличие от бутина-2
| 1) | содержит одну π-связь в молекуле |
| 2) | образует цис-транс-изомеры |
| 3) | вступает в реакцию полимеризации |
| 4) | взаимодействует с аммиачным раствором хлорида меди(I) |
| 5) | реагирует с натрием с выделением водорода |
| 6) | взаимодействует с аммиачным раствором оксида серебра |
57. Максимальный объем (н.у.) водорода, который может присоединить пропин объемом 35 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
|
|
|
58. Масса бромной воды с массовой долей брома 3,2%, которую может обесцветить ацетилен объемом 0,448 л (н.у.), равна _________ г. (Запишите число с точностью до целых.)
59. Объем (н.у.) ацетилена, который выделится при гидролизе 20 г технического карбида кальция, содержащего 20% примесей, равен _________ л. (Запишите число с точностью до десятых.)
60. Метан объемом 300 л (н.у.) подвергли пиролизу и с выходом 75% получили ацетилен, объем (н.у.) которого равен _________ л. (Запишите число с точностью до десятых.)
61. Масса бромоводорода, которую максимально может присоединить бутин-1 объемом 0,336 л (н.у.), равна _________ г. (Запишите число с точностью до сотых.)
62. Из ацетилена объемом 44,8 л (н.у.) по реакции Кучерова с выходом 90% получили ацетальдегид, масса которого равна _________ г. (Запишите число с точностью до десятых.)
63. Объем (н.у.) кислорода, который необходим для полного сгорания ацетилена объемом 40 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
64. Объем (н.у.) воздуха, который необходим для полного сгорания пропина объемом 15 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
65. Смесь этана и этина объемом 80 л (н.у.) максимально может присоединить 30 л (н.у.) водорода. Объемная доля этина в исходной смеси газов равна _________ %. (Запишите число с точностью до сотых.)
|
|
|
66. Смесь этана и этина объемом 2 л (н.у.) может обесцветить 400 г бромной воды с массовой долей брома 3,2%. Объемная доля этина в исходной смеси газов равна _________ %. (Запишите число с точностью до десятых.)
Высокий уровень сложности
67. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СН4 → C2H2 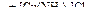 Х1
Х1  X2
X2  X3
X3 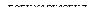 Х4
Х4
Укажите условия протекания реакций.
68. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H6 → С2Н5Cl → C2H4 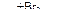 Х1
Х1 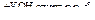 X2
X2 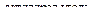 Х3
Х3
Укажите условия протекания реакций.
69. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CO → C2H6 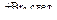 Х1 → C2H4 → C2H2
Х1 → C2H4 → C2H2 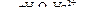 X2
X2
Укажите условия протекания реакций.
70. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CaO → CaC2 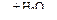 Х1
Х1  Х2 → X1
Х2 → X1  X3
X3
Укажите условия протекания реакций.
71. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
пропан 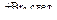 Х1
Х1 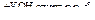 Х2
Х2 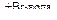 Х3 → СН3С≡СН
Х3 → СН3С≡СН 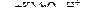 X4
X4
Укажите условия протекания реакций.
72. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
|
|
|
C2Н5Сl → C3H8 → С3Н6 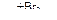 Х1 → СН3С≡СН
Х1 → СН3С≡СН 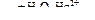 X2
X2
Укажите условия протекания реакций.
73. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
н-бутан 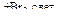 Х1
Х1 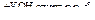 Х2
Х2  Х3
Х3 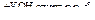 X4
X4 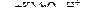 X5
X5
Укажите условия протекания реакций.
74. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3Cl → C2H6 → C2H2  Х1
Х1 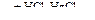 X2
X2 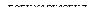 X3
X3
Укажите условия протекания реакций.
75. (С4) К 32 г карбида кальция добавили 200 мл 20%-ного раствора соляной кислоты (плотность 1,14 г/мл). Сколько граммов карбоната кальция может вступить во взаимодействие с кислотой, содержащейся в реакционной смеси? Какова массовая доля хлорида кальция в полученном растворе?
76. (С4) К карбиду кальция массой 9,6 г прилили 36,1 мл 16%-ного раствора азотной кислоты (плотность 1,09 г/мл). Какой объем 10%-ного раствора соляной кислоты (плотность 1,05 г/мл) потребуется для нейтрализации полученной реакционной смеси?
77. (С4) Сколько граммов карбида кальция надо добавить к 181,8 мл 20%-ного раствора азотной кислоты (плотность 1,1 г/мл), чтобы массовая доля соли в полученном растворе стала равна 5%?
78. (С4) Сколько граммов карбида кальция надо добавить к 150 мл 12%-ного раствора соляной кислоты (плотность 1,06 г/мл), чтобы массовая доля соли в полученном растворе стала равна массовой доле кислоты?
79. (С4) Сколько граммов карбида кальция надо добавить к 300 мл 20%-ного раствора азотной кислоты (плотность 1,1 г/мл), чтобы массовая доля кислоты в полученном растворе стала равна 15%?
80. (С4) Ацетилен,полученный в результате гидролиза карбида кальция массой 3,84 г, пропустили через 5%-ный водный раствор перманганата калия до его полного обесцвечивания. Определите массовые доли веществ в полученном растворе.
81. (С4) Смесь этина и этена объемом 1,12 л (н.у.), которая может обесцветить 400 мл бромной воды с массовой долей брома 3,2%, сожгли. Какова максимальная масса осадка, которая может образоваться при пропускании образовавшего в результате сгорания углекислого газа через известковую воду с массовой долей Са(ОН)2 0,165%? Сколько граммов известковой воды потребуется для этого?
82. (С5) Установите молекулярную формулу алкина, плотность паров которого по воздуху равна 2,345.
83. (С5) Установите молекулярную формулу алкина, массовая доля водорода в котором равна 11,11%.
84. (С5) Алкин массой 8 г может максимально присоединить 8,96 л (н.у.) водорода. Установите молекулярную формулу алкина.
85. (С5) Алкин массой 2,7 г может обесцветить 333,3 г бромной воды, массовая доля брома в которой 4,8%. Установите молекулярную формулу алкина.
86. (С5) Одинаковое количествоалкина в результате присоединения хлора и брома образует соответственно 5,46 г тетрахлорпроизводного и 10,8 г тетрабромпроизводного. Установите молекулярную формулу алкина.
87. (С5) В результате взаимодействия гомолога ацетилена массой 2,16 г с избытком аммиачного раствора оксида серебра выпал осадок, масса которого составила 6,44 г. Установите молекулярную формулу алкина.
88. (С5) В результате полного сгорания алкина образовалось 2,688 л (н.у.) углекислого газа и 1,8 г воды. Установите молекулярную формулу алкина.
89. (С5) Для полного сгорания алкина потребовалось 15,68 л (н.у.) кислорода, в результате чего образовалось 7,2 г воды. Установите молекулярную формулу алкина.
Циклоалканы
Базовый уровень сложности
1. Состав циклоалканов выражается общей формулой
| 1) | CnH2n | 2) | CnH2n-2 | 3) | CnH2n-6 | 4) | CnH2n+2 |
2. Циклоалканом может быть вещество, формула которого
| 1) | C6H6 | 2) | C6H10 | 3) | C6H14 | 4) | C6H12 |
3. К соединениям с общей формулой СnН2n относятся
| 1) | алкины и алкадиены | 3) | алкены и алкадиены |
| 2) | алкены и циклоалканы | 4) | алкины и циклоалканы |
4. Последовательности
алкан – циклоалкан – алкин
может соответствовать ряд веществ
| 1) | С5Н12, С6Н12, С3Н4 | 3) | С6Н12, С4Н10, С4Н6 |
| 2) | С3Н8, С4Н10, С6Н6 | 4) | С2Н6, С4Н8, С2Н4 |
5. В молекуле циклогексана атомы углерода находятся в состоянии гибридизации
| 1) | только sp3 | 2) | только sp2 | 3) | только sp | 4) | sp3 и sp |
6. Изомером метилциклопропана является
| 1) | пропан | 2) | циклопропан | 3) | бутан | 4) | бутен |
7. Изомером метилциклогексана является
| 1) | гексан | 2) | метилбензол | 3) | гептен-1 | 4) | гептин-1 |
8. Наиболее легко подвергается гидрированию
| 1) | циклопропан | 2) | циклобутан | 3) | циклопентан | 4) | циклогексан |
9. Реакции присоединения не характерны для
| 1) | метилциклопропана | 3) | метилциклопентана |
| 2) | метилциклобутана | 4) | метилциклогексана |
10. Циклогексан способен вступать в реакцию
| 1) | с бромной водой |
| 2) | гидратации |
| 3) | гидрирования |
| 4) | дегидрирования |
11. Для циклопропана не характерны реакции
| 1) | присоединения бромоводорода |
| 2) | замещения атомов водорода |
| 3) | гидрирования |
| 4) | присоединения брома |
12. При взаимодействии циклопропана с бромом образуется
| 1) | 1-бромпропан | 3) | бромциклопропан |
| 2) | 2-бромпропан | 4) | 1,3-дибромпропан |
Дата добавления: 2019-01-14; просмотров: 6226; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
