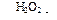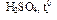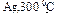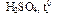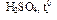Особенности и классификация реакций в органической химии 4 страница
45. В соответствии с термохимическим уравнением реакции
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж) + 1410 кДж
количество теплоты, выделяющееся при образовании 4,48 л (н.у.) углекислого газа, равно
| 1) | 705 кДж | 2) | 70,5 кДж | 3) | 282 кДж | 4) | 141кДж |
Повышенный уровень сложности
46. Этилен реагирует с
| 1) | Сu | 4) | KMnO4 |
| 2) | Br2 | 5) | H2O |
| 3) | Cu(OH)2 | 6) | Mg(OH)2 |
47. Пропен способен реагировать с каждым из трех веществ в ряду
| 1) | Br2, HCl, C3H8 | 4) | HCHO, CH4, HBr |
| 2) | KMnO4, H2, H2O | 5) | H2, O2, HI |
| 3) | KH, C6H6, I2 | 6) | H2O, HCl, Br2 |
48. И для этена, и бутена-2 справедливы утверждения
| 1) | содержат только sp2-гибридные атомы углерода |
| 2) | имеют плоское строение молекулы |
| 3) | образуют цис-транс-изомеры |
| 4) | обесцвечивают водный раствор перманганата калия |
| 5) | взаимодействуют с бромоводородом |
| 6) | горят на воздухе |
49. Для этилена в отличие от этана характерны
| 1) | наличие π-связи между атомами углерода |
| 2) | образование цис-транс-изомеров |
| 3) | плохая растворимость в воде |
| 4) | плоское строение молекулы |
| 5) | способность вступать в реакцию полимеризации |
| 6) | горение на воздухе с выделением большого количества тепла |
50. Пропен в отличие от этена
| 1) | содержит тетраэдрический фрагмент атомов в молекуле |
| 2) | имеет несимметричное строение молекулы |
| 3) | образует межклассовые изомеры |
| 4) | плохо растворяется в воде |
| 5) | окисляется водным раствором перманганата калия |
| 6) | обесцвечивает бромную воду |
51. Этен в отличие от этана
|
|
|
| 1) | содержит атомы углерода в sp2-гибридном состоянии |
| 2) | хорошо растворяется в воде |
| 3) | образует межклассовые изомеры |
| 4) | окисляется водным раствором перманганата калия |
| 5) | взаимодействует с бромом |
| 6) | горит на воздухе светящимся пламенем |
52. По правилу Марковникова происходит взаимодействие между
| 1) | бутеном-1 и хлороводородом | 4) | пропеном и бромоводородом |
| 2) | бутеном-1 и водородом | 5) | пропаном и хлором |
| 3) | бутеном-2 и водой | 6) | бутеном-1 и водой |
53. Установите соответствие между исходными веществами и продуктами, преимущественно образующимися в результате их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ | ||||
| А) | СН2=СН ─ СН3 + HBr → | 1) | СН2Br ─ СН2 ─ СН3 | ||
| Б) | СН2=СH ─ СН2F + HBr → | 2) | СН3 ─ СНBr ─ СН3 | ||
| В) | СН2=СН ─ СН3 + Br2(водн.) → | 3) | СН3 ─ СHBr ─ СН2F | ||
| Г) | СН2=СН ─ СН3 + Br2 | 4) | СН2Br ─ СH2 ─ СН2F | ||
|
| 5) | СН2Br ─ СНBr ─ СН3 | |||
|
| 6) | СН2=СН ─ СН2Br + HBr | |||
| А | Б | В | Г | ||
|
|
| ||||
54. Установите соответствие между исходными веществами и продуктами, преимущественно образующимися в результате их взаимодействия.
| ИСХОДНЫЕ ВЕЩЕСТВА
| ПРОДУКТЫ РЕАКЦИИ | ||||||
| А) | СН2=СН-СН2-СН3 + HСl → | 1) | СН2Cl-СН2-CH2-СН3 | ||||
| Б) | СН2=СН-СН2-СН3 + HCl | 2) | СН3-СНCl-CH2-СН3 | ||||
| В) | CH3-СН=СH2 + H2O | 3) | СН3-СНOH-СН3 | ||||
| Г) | СН3-СНCl-CH2-СН3+КОН(спирт.р-р)→ | 4) | СН3-СН2-СН2OH | ||||
|
| 5) | СН2=СН-СН2-CH3 + KCl + H2O | |||||
|
| 6) | СН3-CH=СН-СН3 + KCl + H2O | |||||
| А | Б | В | Г | ||||
|
|
| ||||||
55. Установите соответствие между схемой реакции и продуктом (продуктами) окисления алкена, преимущественно образующимся (образующимися) в результате реакции.
| СХЕМА РЕАКЦИИ | ПРОДУКТ (ПРОДУКТЫ) ОКИСЛЕНИЯ АЛКЕНА | ||||
| А) | СН2=СН2 + О2 → | 1) | CO2 + H2O | ||
| Б) | СН2=СН2 + О2 | 2) | СН2(OH)-СН(OH)-CH3 | ||
| В) | СН2=СН-СН3 + KMnO4 | 3) | СО2 + СН3-СООН | ||
| Г) | СН2=СН-СН3 + KMnO4 | 4) | С2Н5-СООН | ||
|
| 5) | Н2С─СН2 \ О / | |||
| А | Б | В | Г | ||
|
|
| ||||
56. Установите соответствие между схемой реакции и продуктом (продуктами) окисления алкена, преимущественно образующимся (образующимися) в результате реакции.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТ (ПРОДУКТЫ) ОКИСЛЕНИЯ АЛКЕНА | ||||||
| А) | СН2=СНСН2СН3 +KMnO4 | 1) | СН2(OH)-СН2(OH) | ||||
| Б) | СН3СН=СНСН3 + KMnO4 | 2) | СО2 + Н2О | ||||
| В) | СН2=СН2 + KMnO4 | 3) | СН3СООН | ||||
| Г) | СН2=СН2 + KMnO4 | 4) | СО2 + С2Н5-СООН | ||||
|
| 5) | С3Н7-СООН | |||||
|
| 6) | СН3-СН(ОН)-СН(ОН)-СН3
| |||||
| А | Б | В | Г | ||||
|
|
| ||||||
57. Масса брома, которую может присоединить этилен объемом 8,96 л (н.у.), равна _________ г. (Запишите число с точностью до целых.)
58. Объем бромоводорода (н.у.), который может присоединить пропилен массой 12,6 г, равен _________ л. (Запишите число с точностью до сотых.)
59. Объем этилена (н.у.), который можно получить при взаимодействии 43,6 г бромэтана со спиртовым раствором щелочи, равен _________ л. (Запишите число с точностью до сотых.)
60. Объем углекислого газа (н.у.), который получится при сгорании 40 л этена в кислороде объемом 90 л (н.у.), равен _________ л. (Запишите число с точностью до целых.)
61. Пропен объемом (н.у.) 20 л сожгли в кислороде объемом (н.у.) 100 л. Объем кислорода, не вступившего в реакцию, составил _________ л. (Запишите число с точностью до целых.)
62. Этилен объемом 4,48 л (н.у.) пропустили через водный раствор перманганата калия. Масса образовавшегося в результате реакции этиленгликоля равна _________ г. (Запишите число с точностью до десятых.)
63. Этилен объемом 200 л (н.у.) подвергли гидратации и с выходом 75% получили этанол, масса которого составила _________ г. (Запишите число с точностью до целых.)
64. При нагревании пропанола-1 массой 120 г в присутствии концентрированной серной кислоты с выходом 80% получили пропен, объем (н.у.) которого составил _________ л. (Запишите число с точностью до сотых.)
|
|
|
65. Масса бромной воды с массовой долей брома 3,2%, которая необходима для поглощения бутена-1 объемом 3,36 л (н.у.), равна _________ г. (Запишите число с точностью до целых.)
66. Смесь этана и этена объемом 13,44 л (н.у.) может обесцветить 500 г бромной воды с массовой долей брома 3,2%. Объемная доля этена в исходной смеси газов равна _________ %. (Запишите число с точностью до десятых.)
Высокий уровень сложности
67. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бутан 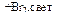 Х1
Х1 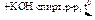 Х2
Х2 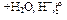 Х3
Х3  Х2
Х2  X4
X4
68. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
пропан → пропен 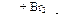 Х1
Х1 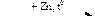 Х2
Х2 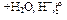 Х3
Х3  Х2
Х2
Укажите условия протекания первой реакции.
69. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H4 → С2Н5Сl → н-бутан 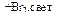 Х1
Х1 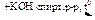 Х2
Х2 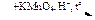 Х3
Х3
Укажите условия протекания реакций.
70. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО → C3H8 → пропен 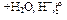 Х1 → пропен
Х1 → пропен 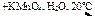 Х2
Х2
Укажите условия протекания реакций.
71. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СН3СН2СН3 → СН2=СНСН3 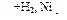 Х1
Х1 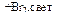 Х2 → СН2=СНСН3
Х2 → СН2=СНСН3  Х3
Х3
Укажите условия протекания реакций.
72. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СН2=СНСН2СН3  Х1
Х1 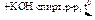 X2
X2 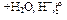 Х3 → бутен-2
Х3 → бутен-2 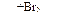 Х4
Х4
Укажите условия протекания реакций.
73. (С4) Этен, полученный при внутримолекулярной дегидратации 200 мл этанола (плотность 0,8 г/мл) с выходом 80%, сожгли. Определите минимальный объем 18,3%-ного раствора гидроксида натрия (плотность 1,2 г/мл), который необходим для полного поглощения углекислого газа, полученного при сгорании этена.
74. (С4) Определите массу 5%-ного водного раствора перманганата калия, которую способен обесцветить этилен, полученный в результате внутримолекулярной дегидратации 17,25 мл этанола (плотность 0,8 г/мл). Выход этилена составляет 80%.
75. (С4) Смесь этена и пропена массой 1,12 г может обесцветить 150 г бромной воды с массовой долей брома 3,2%. Определите объемную долю этена в исходной смеси газов.
76. (С4) Для полного обесцвечивания 5%-ного водного раствора перманганата калия потребовалось 672 мл (н.у.) этилена. Определите массовую долю щелочи в полученном растворе.
77. (С4) Через горячий 15%-ный раствор перманганата калия в сернокислой среде пропускали бутен-2 до полного обесцвечивания раствора. Объем бутена-2 составил 1,12 л (н.у.). Определите массовую долю уксусной кислоты в полученном растворе.
78. (С4) Через горячий 15%-ный раствор перманганата калия в сернокислой среде пропускали пропен до полного обесцвечивания раствора. Объем пропена составил 336 мл (н.у.). Определите массовую долю уксусной кислоты в полученном растворе.
79. (С5) Относительная плотность паров алкена по азоту равна 3,5. Установите молекулярную формулу алкена.
80. (С5) Алкен массой 12,6 г может присоединить 6,72 л (н.у.) водорода. Установите молекулярную формулу алкена.
81. (С5) Алкен массой 2,24 г может обесцветить 200г бромной воды, массовая доля брома в которой равна 3,2% . Установите молекулярную формулу алкена.
Дата добавления: 2019-01-14; просмотров: 4492; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!